Majoritatea tratamentelor medicale sunt concepute pentru „pacientul mediu” ca o abordare unică, care poate avea succes pentru unii pacienți, dar nu și pentru alții. Medicina de precizie, cunoscută uneori sub denumirea de „medicină personalizată”, este o abordare inovatoare pentru adaptarea prevenirii și tratamentului bolilor, care ține cont de diferențele dintre genele, mediile și stilurile de viață ale oamenilor. Scopul medicinei de precizie este de a direcționa tratamentele potrivite către pacienții potriviți, la momentul potrivit.
Progresele în medicina de precizie au condus deja la noi descoperiri puternice și la tratamente aprobate de FDA care sunt adaptate la caracteristicile specifice ale indivizilor, cum ar fi constituția genetică a unei persoane sau profilul genetic al tumorii unui individ. Pacienții cu o varietate de cancere sunt supuși în mod obișnuit testelor moleculare ca parte a îngrijirii pacienților, permițând medicilor să selecteze tratamente care îmbunătățesc șansele de supraviețuire și reduc expunerea la efecte adverse.
- Teste de secvențiere de generație următoare (NGS)
- Rolul FDA în progresul medicinei de precizie
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Clinical Databases Guidance
- Ghid de validare analitică
- Platforma bioinformatică a FDA
- Întrebări?
- Ce spun oficialii FDA
- NGS Final Guidances
- Rapoarte și documente de discuție
- Reuniunile anterioare
Teste de secvențiere de generație următoare (NGS)
Îngrijirile de precizie vor fi la fel de bune ca și testele care ghidează diagnosticul și tratamentul. Testele de secvențiere de generație următoare (NGS) sunt capabile să identifice sau să „secvențieze” rapid secțiuni mari din genomul unei persoane și reprezintă progrese importante în aplicațiile clinice ale medicinei de precizie.
Pacienții, medicii și cercetătorii pot folosi aceste teste pentru a găsi variante genetice care îi ajută să diagnosticheze, să trateze și să înțeleagă mai multe despre bolile umane.
Rolul FDA în progresul medicinei de precizie
FDA lucrează pentru a asigura acuratețea testelor NGS, astfel încât pacienții și medicii să poată primi rezultate precise și semnificative din punct de vedere clinic.
Celebrul mare de informații generate prin NGS ridică noi probleme de reglementare pentru FDA. În timp ce abordările actuale de reglementare sunt adecvate pentru diagnosticele convenționale care detectează o singură boală sau afecțiune (cum ar fi nivelul glicemiei sau al colesterolului), aceste noi tehnici de secvențiere conțin echivalentul a milioane de teste într-unul singur. Din acest motiv, FDA a colaborat cu părțile interesate din industrie, laboratoare, mediul academic și societățile profesionale și de pacienți pentru a dezvolta o abordare de reglementare flexibilă pentru a se adapta la această tehnologie în evoluție rapidă, care valorifică standardele de consens, datele provenite din surse publice și tehnologia de calcul open-source de ultimă generație pentru a sprijini dezvoltarea testelor NGS. Această abordare va permite inovarea în testare și cercetare și va accelera accesul la teste genetice precise și fiabile.
Streamlining FDA’s Regulatory Oversight of NGS Tests
În aprilie 2018, FDA a emis două ghiduri finale care recomandă abordări pentru a simplifica prezentarea și examinarea datelor care susțin validitatea clinică și analitică a testelor bazate pe NGS. Aceste recomandări au scopul de a oferi o abordare eficientă și flexibilă a supravegherii de reglementare: pe măsură ce tehnologia avansează, standardele pot evolua rapid și pot fi utilizate pentru a stabili parametrii corespunzători pentru domenii cu creștere rapidă, cum ar fi NGS. În mod similar, pe măsură ce dovezile clinice se îmbunătățesc, pot fi susținute noi afirmații. Această abordare adaptivă ar favoriza, în cele din urmă, inovarea în rândul dezvoltatorilor de teste și ar îmbunătăți accesul pacienților la aceste noi tehnologii.
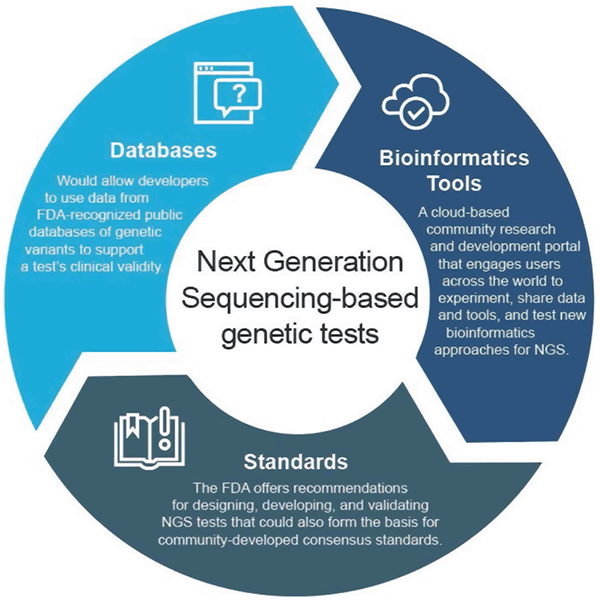
Clinical Databases Guidance
Consiliul final „Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” (Utilizarea bazelor de date publice privind variantele genetice umane pentru a susține validitatea clinică pentru diagnosticele in vitro bazate pe genetică și genomică) permite dezvoltatorilor să utilizeze date din bazele de date publice de variante genetice recunoscute de FDA pentru a contribui la susținerea validității clinice a unui test și prezintă modul în care administratorii bazelor de date pot solicita recunoașterea bazelor lor de date dacă acestea îndeplinesc anumite recomandări de calitate. Această abordare stimulează schimbul de date și oferă o cale mai eficientă de introducere pe piață.
Mai multe informații despre recunoașterea bazelor de date sunt disponibile pe pagina web a FDA „Recognition of Public Human Genetic Variants Databases”.
Ghid de validare analitică
Ghidul final „Considerations for Design, dezvoltare, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVD) In Vitro Diagnostics (IVD) Intended to Aid in the Diagnosis of Suspected Germline Diseases” (Considerații pentru proiectarea, dezvoltarea și validarea testelor NGS) oferă recomandări pentru proiectarea, dezvoltarea și validarea testelor NGS. Ghidul încurajează, de asemenea, implicarea comunității în elaborarea de standarde legate de NGS de către organizațiile de elaborare a standardelor (SDO), deoarece standardele pot evolua mai rapid odată cu schimbările din domeniul tehnologiei și al cunoștințelor și, prin urmare, pot fi utilizate pentru a stabili parametrii adecvați, cum ar fi praguri de performanță specifice pentru domenii în creștere rapidă, cum ar fi NGS.
Platforma bioinformatică a FDA
FDA a creat precisionFDA, un portal de cercetare și dezvoltare a comunității bazat pe cloud care implică utilizatori din întreaga lume pentru a partaja date și instrumente pentru a testa, pilota și valida abordările bioinformatice existente și noi pentru procesarea NGS. Persoanele și organizațiile din comunitatea de genomică pot găsi mai multe informații și se pot înscrie pentru a participa la http://precision.fda.gov.
Întrebări?
Vă rugăm să ne contactați pentru orice întrebări cu privire la eforturile FDA în domeniul medicinei de precizie la adresa [email protected].
Ce spun oficialii FDA
- FDA finalizează ghidurile pentru a accelera dezvoltarea de încredere, benefică a testelor bazate pe secvențierea de generație următoare
NGS Final Guidances
- Utilizarea bazelor de date publice privind variantele genetice umane pentru a sprijini validitatea clinică a testelor de diagnosticare in vitro bazate pe genetică și genomică – Ghid pentru părțile interesate și personalul Administrației Alimentelor și Medicamentelor (PDF – 444KB)
- Considerations for Design, Development, 869KB)
Rapoarte și documente de discuție
- Optimizarea supravegherii de reglementare de către FDA a testelor de diagnostic prin secvențiere de generație următoare (PDF – 424KB)
- Raport: Paving the Way for Personalized Medicine (Arhivă)
Reuniunile anterioare
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Implicații pentru pacienți și furnizori
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Aspecte tehnice și de reglementare
- 11/13/2015: Atelier public – Utilizarea bazelor de date pentru stabilirea relevanței clinice a variantelor genetice umane
- 11/12/2015: Abordare bazată pe standarde pentru evaluarea performanței analitice a testelor de diagnostic in vitro prin secvențiere de generație următoare
- 02/20/2015: Optimizarea supravegherii de reglementare de către FDA a testelor de diagnosticare prin secvențiere de generație următoare Workshop public