Printre Neisseria umană și speciile înrudite, trei specii – N. mucosa, M. catarrhalis și K. denitrificans reduc nitrații. Testul de reducere a nitratului este un test critic pentru diferențierea între N. gonorrhoeae și K. denitrificans, în special atunci când tulpinile de K. denitrificans par a fi diplococi gram-negativi în frotiurile colorate.
Principiul
Speciile bacteriene pot fi diferențiate pe baza capacității lor de a reduce nitratul în nitriți sau în gaze azotate. Dintre Neisseriaceae de origine umană, tulpinile de Neisseria mucosa, Moraxella catarrhalis și Kingella denitrificans reduc nitratul. Tulpinile de M. catarrhalis și K. denitrificans au fost identificate în mod eronat ca fiind N. gonorrhoeae. Testul de reducere a nitraților permite diferențierea între aceste specii, care sunt pozitive la nitrați, și N. gonorrhoeae (negative la nitrați). Reducerea nitraților poate fi cuplată cu respirația anaerobă la unele specii.
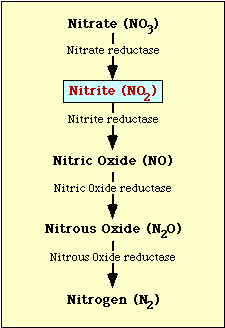
Calea biochimică implicată în reducerea nitraților este prezentată în figura 1. Nitratul este redus la nitriți care pot fi apoi reduși la oxid nitric, protoxid de azot sau azot (figura 1).
Figura l. Calea de reducere a nitraților.
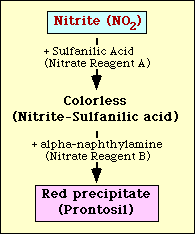
Testul de reducere a nitraților se bazează pe detectarea nitriților în mediu după incubarea cu un organism. Dacă este prezent în mediu, nitritul va reacționa cu acidul sulfanilic (reactivul A pentru nitrați) pentru a forma un complex incolor (nitrit-acid sulfanilic). Acest complex va produce apoi un precipitat roșu (prontosil) atunci când reactivul nitrat B (alfa-naftilamină) este apoi adăugat la test, așa cum se arată în figura 2.
Figura 2. Reprezentarea schematică a detectării nitriților în mediu.
O culoare roșie va fi produsă în mediu numai atunci când nitriții sunt prezenți în mediu. Lipsa unei culori roșii în mediu după adăugarea de acid sulfanilic și alfa-naftilamină înseamnă doar că nitritul nu este prezent în mediu. Pot exista două explicații pentru această observație.
- Este posibil ca nitratul să nu se fi redus; tulpina este nitrat-negativă.
- Este posibil ca nitratul să se fi redus la nitrit, care a fost apoi redus complet la oxid nitric, protoxid de azot sau azot care nu va reacționa cu reactivii care reacționează cu nitriții; tulpina este nitrat-pozitivă.
Care mediu de testare care dă un rezultat negativ după adăugarea reactivilor pentru nitrați trebuie să fie testat în continuare pentru a determina care dintre cele două interpretări este corectă.
Un test de reducere a nitraților reușit depinde de efectuarea testului în condiții corecte.
- Reacția va avea loc cel mai bine dacă mediul de bază susține creșterea organismului. Cu toate acestea, deși unele specii de Neisseria nu se dezvoltă bine în medii de bulion, testul de reducere a nitraților poate fi efectuat cu succes într-un mediu care nu susține creșterea prin inocularea puternică a mediului pentru a furniza suficientă enzimă preformată pentru ca reacția să aibă loc.
- Reacția nitraților are loc numai în condiții anaerobe. Mediul care conține nitrați se distribuie în tuburi pentru a obține un raport suprafață:adâncime scăzut care limitează difuzia oxigenului în mediu, de exemplu, 5 ml de mediu se distribuie într-un tub cu diametrul de 13 mm. Neisseria și speciile înrudite folosesc oxigenul din mediu și produc rapid condiții anaerobe care sunt ideale pentru ca reducerea nitraților să aibă loc.
Testul de reducere a nitraților se efectuează într-un mediu care conține 0,2% nitrat de potasiu. Mediul este puternic inoculat cu o cultură pură a organismului suspect și incubat la 35C până la 36,5C timp de 48 de ore într-un incubator cu sau fără adaos de dioxid de carbon.
Reducerea nitraților este detectată cu reactivii Griess Llosvay, acid sulfanilic și alfa-naftilamină. Acidul sulfanilic (reactivul A pentru nitrați) se adaugă la amestecul de incubare și formează un complex (nitrit-acid sulfanilic) cu orice nitrit prezent în mediu. Când se adaugă alfa-naftilamină (reactiv nitrat B) în mediul de incubare, se va forma un precipitat roșu (prontosil) cu orice complex nitrit-acid sulfanilic prezent în mediu.
Un organism poate fi raportat ca fiind pozitiv la nitrați dacă se dezvoltă o culoare roșie în mediu după ce reactivii de nitrați A și B sunt adăugați în mediu, ceea ce indică faptul că organismul a redus nitratul în nitriți.
Absența unei culori roșii după adăugarea ambilor reactivi nu înseamnă automat că organismul este incapabil să reducă nitratul. Este posibil ca tulpinile să fi redus nitratul la nitriți și apoi să fi redus complet nitriții la gaze azotate care nu sunt detectate atunci când reactivii A și B pentru nitrați sunt adăugați în mediu. În cazul în care mediul nu își schimbă culoarea după adăugarea acidului sulfanilic și a alfa-naftilaminei, se adaugă o cantitate mică („vârf de cuțit”) de praf de zinc în mediul incubat. Praful de zinc va cataliza reducerea chimică a nitraților în nitriți. Astfel, în cazul în care nitratul nu a fost redus de către organisme, adică acestea sunt nitrat-negative, acesta va fi redus de praful de zinc și se va dezvolta o culoare roșie în mediul incubat în decurs de 15 minute. Dacă nu se dezvoltă nici o culoare în mediul incubat după adăugarea prafului de zinc, organismele nu numai că au redus nitratul în nitriți, dar au redus nitriții în gaze azotate; aceste organisme sunt, de asemenea, nitrat-pozitive.
Deși mediul de nitrați este furnizat cu tuburi Durham inversate pentru a detecta producția de gaze, producția de gaze nu este înregistrată pentru speciile Neisseria. Deși unele specii pot reduce nitratul dincolo de nitriți la gaze azotate, este posibil ca gazul să nu se acumuleze în tub. Acumularea de gaz depinde de rata la care acesta este produs. Atunci când gazul este produs foarte lent, acesta se poate dizolva în mediu și nu se poate acumula în tubul Durham.
Cerințe pentru specimen
Specimen optim: O cultură pură a unui diplococ suspect gram negativ, oxidaza-pozitiv (Neisseria spp. sau M. catarrhalis) pe agar ciocolată incubat într-o atmosferă îmbogățită cu dioxid de carbon la 35C până la 36,5C timp de 18 până la 24 h.
Eșantion inacceptabil: Culturi de izolate pe agar ciocolată incubate într-o atmosferă îmbogățită cu dioxid de carbon la 35C până la 36,5C pentru mai mult de 24 h.
Factori compromițători care afectează rezultatele testului:
- Mediul de testare trebuie să fie inoculat suficient de puternic pentru a permite reacția cu enzimele preformate. Un inocul insuficient poate să nu permită organismelor să consume oxigenul pentru a produce condiții anaerobe în care poate avea loc reducerea nitraților.
- Puțin praf de zinc adăugat în tubul incubat poate duce la reducerea foarte rapidă a nitraților dincolo de nitriți în gaze azotate, astfel încât nitriții nu sunt detectați.
Stabilitatea probei: Detectarea reducerii nitraților pentru Neisseria și speciile înrudite depinde de prezența enzimelor preformate.
- Testele trebuie efectuate numai cu inocul recoltat din culturi de 24 h.
- Mediul de nitrați trebuie inoculat în termen de 30 de minute de la scoaterea culturii din incubator; expunerea prelungită a culturii la temperatura camerei poate duce la diminuarea activității enzimatice.
Mediu/Reactivi
Mediu: Bulion de nitrați (bulion de infuzie de inimă care conține 0,2% nitrat de potasiu)
Bulion de infuzie de inimă (Difco), 25,0 g
Nitrat de potasiu, 2,0 g
Apă distilată, 1000,0 ml
- Disolvați ingredientele în apă distilată; reglați soluția la pH 7.0.
- Dispuneți alicote de 5 ml din bulion în tuburi de 16 mm x 100 mm cu inserții de gaz (tuburi Durham, 6 mm x 50 mm).
- Autoclavizați timp de 15 min la 121C.
Stocați mediul la 4C până la 10C (refrigerat) până la utilizare. Preîncălziți mediul la temperatura camerei înainte de inoculare.
Reactivi: Soluție de acid sulfanilic (reactiv nitrat A): 0,8% în acid acetic 5N
Denumire chimică: Acid 4-aminobenzen sulfonic
Stocați reactivul nitrat A la 15C până la 30C (temperatura camerei) timp de până la 3 luni, la întuneric. Reactivii pot fi depozitați în recipiente de sticlă de culoare maro închis; flacoanele pot fi învelite în folie de aluminiu pentru a asigura întunericul.
Soluție de alfa-naftilamină (reactiv de nitrat B): 0,6% în acid acetic 5N
Denumire chimică: N,N-dimetil-1 naftil-1 naftilamină
Stocați reactivul de nitrat B la 2C până la 8C (refrigerat) timp de până la 3 luni, la întuneric. Reactivii pot fi depozitați în recipiente de sticlă de culoare maro închis; flacoanele pot fi învelite în folie de aluminiu pentru a asigura întunericul.
Pudră de zinc, calitate reactiv: A se păstra la temperatura camerei (15C până la 30C)
Atenție: Acidul acetic este coroziv. Contactul cu pielea poate provoca bășici și arsuri. În caz de contact, spălați imediat ochii și pielea cu apă din abundență (timp de cel puțin 15 min.)
Controlul calității/procedură de testare
Cepe de control al calității:
- Control pozitiv la nitrat reductază: Kingella denitrificans, CDC 10,236
Controlul negativ al reductazei nitratului: Neisseria gonorrhoeae, ATCC 43069
Cepele QC sunt păstrate la -70C într-o soluție de bulion triptic de soia care conține 20% glicerol. Reacțiile tulpinilor de control trebuie să fie confirmate în momentul în care se pregătesc stocurile congelate. Tulpinile QC pot fi păstrate la -70C timp de până la 2 ani.
Procedură:
Cele de control sunt testate în același mod ca și izolatele clinice. Tulpinile QC trebuie să fie subcultivate cel puțin o dată după cultura inițială din proba congelată înainte de efectuarea testului. Izolatele clinice pot fi subcultivate din mediu selectiv sau din subculturi purificate. Asigurați-vă că culturile sunt pure.
- Dezghețați flacoanele de tulpini de control păstrate la -70C. Dezghețați pe plăci de agar ciocolată sau de agar GC suplimentat pentru izolare. Se incubează la 35C până la 36,5C într-o atmosferă îmbogățită cu dioxid de carbon timp de 18 până la 24 h.
-
Cu un tampon steril, se prepară o suspensie consistentă de colonii bine izolate dintr-o cultură pură a izolatului incubat pe mediu de ciocolată la 35C până la 36C.5 C într-o atmosferă îmbogățită cu dioxid de carbon timp de 18 până la 24 h. Inoculați mediul de testare pentru a da o turbiditate puternică.
Nota: Tulpinile de N. gonorrhoeae și unele alte Neisseria spp. pot să nu se dezvolte în acest mediu. Astfel, reacția poate depinde de o enzimă preformată.
- Incubați mediul inoculat și un tub cu mediu de control neinoculat la 35C până la 36,5 C într-o atmosferă îmbogățită cu dioxid de carbon timp de 48 de ore.
-
După 48 de ore de incubare adăugați, cu pipete Pasteur, 5 picături de reactiv #A, urmate de 5 picături de reactiv #B în fiecare tub. Agitați bine tubul pentru a amesteca reactivii cu mediul.
Examinați suspensia pentru o culoare roșu-roz care ar trebui să se dezvolte în câteva minute dacă mediul este încă cald. Reacția poate dura un pic mai mult dacă mediul este rece când se adaugă reactivii.
Dacă suspensia devine roșu-roz înainte de adăugarea pulberii de Zn, recția este pozitivă și testul este finalizat. Nu efectuați pasul 4.
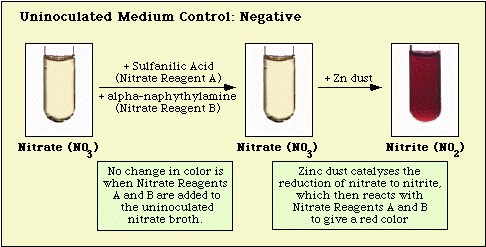
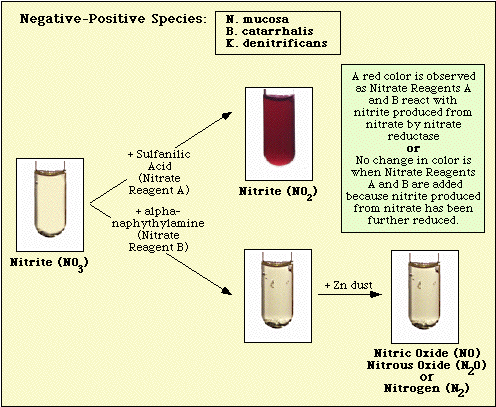
Reacțiile observate cu mediul martor neinoculat și cu izolatele negative la nitrați și pozitive la nitrați sunt ilustrate în figura 3, figura 4 și, respectiv, figura 5.
-
În cazul în care suspensia este incoloră după adăugarea reactivilor A și B, adăugați o cantitate mică (4 până la 5 mg; „vârf de cuțit ascuțit”) de pulbere de zinc în mediu. Agitați energic tubul și lăsați-l să stea la temperatura camerei timp de 10-15 minute.
Dacă mediul rămâne incolor după adăugarea prafului de Zn, rezultatul testului este pozitiv.
Dacă mediul devine roz după adăugarea prafului de Zn, rezultatul este negativ. - Lecturați și notați rezultatele.
Figura 3. Reacția observată cu mediul de nitrați neinoculat.
Figura 4. Reacția observată cu specii negative pentru nitrați.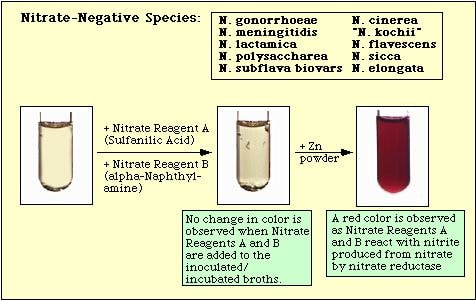
Figura 5. Reacții observate cu specii pozitive la nitrați.
Programul de control al calității:
- În fiecare zi în care se testează izolatele clinice se efectuează un test QC de nitrat reductază.
Probleme & Soluții
Testul de reducere a nitraților poate da rezultate fals-negative sau fals pozitive dacă mediul nu este produs cu exactitate sau dacă testul nu este efectuat cu exactitate. Reacția în acest test depinde de o serie de factori.
- Eșecul de a detecta culoarea roz în tubul de control al mediului neinoculat după adăugarea prafului de Zn se poate datora (1) faptului că mediul nu conține nitrați sau (2) faptului că s-a adăugat prea mult praf de zinc care a catalizat reducerea nitraților dincolo de nitriți în gaze azotate. Cea mai simplă soluție este să se obțină mai mult mediu cu nitrat, asigurându-se că s-a adăugat nitrat în mediul de bază. Alternativ, inoculați mediul cu o tulpină de control pozitivă, dar testați pentru o reacție după un timp de incubare mai scurt; tulpinile de N. mucosa vor produce o reacție pozitivă la nitriți după câteva ore de incubare. În cazul în care se confirmă că mediul conține nitrat, repetați testul până când ați determinat cantitatea corectă de praf de zinc care trebuie adăugată. Este esențial să învățați cât de mult praf de zinc să adăugați la test. Adăugarea unei cantități prea mari de praf de zinc poate duce la un rezultat fals pozitiv.
- Dacă se detectează o culoare roz în mediul de control neinoculat după ce reactivii de nitrat A și B au fost adăugați în mediu, mediul este contaminat cu nitriți. Singura soluție este obținerea unui nou lot de mediu care nu este contaminat cu nitriți.
- În mediul care conține nitrați, eșecul tulpinii de control pozitiv, Kingella denitrificans, de a da o reacție pozitivă ar avea loc numai dacă tulpina nu este K. denitrificans. Verificați din nou identitatea tulpinii de control pozitiv. Se selectează o nouă cultură a tulpinii de control și se repetă testul. În mod similar, în cazul în care se obține un test pozitiv pentru nitrat reductază cu tulpina martor negativă, N. gonorrhoeae, fie tulpina martor negativă nu este N. gonorrhoeae, fie cultura este contaminată cu un organism pozitiv la nitrați. Se verifică din nou puritatea și identitatea tulpinii de referință gonococice. Repetați testul cu o cultură pură a unei culturi confirmate de N. gonorrhoeae.
- Reacția de reducere a nitraților indică abilitatea organismelor de a reduce nitrații, reacție care are loc numai în condiții anaerobe; reacția nu va avea loc dacă organismele primesc un aport continuu de oxigen. Astfel, este posibil ca reacția să nu aibă loc în culturile statice (în special a speciilor cu creștere lentă) în care mediul este distribuit în straturi puțin adânci care permit oxigenului să se difuzeze în mediu. Un test pentru a determina dacă oxigenul este prezent în mediu poate fi efectuat prin adăugarea unei picături de reactiv de oxidază în mediu. Dacă mediul devine purpuriu, înseamnă că mediul conține oxigen și este posibil ca reacția de reducere a nitraților să nu aibă loc. Dacă mediul rămâne incolor, înseamnă că mediul nu conține oxigen și este posibil să aibă loc testul de reducere a nitraților. S-a observat că celulele de N. gonorrhoeae consumă rapid oxigenul în cazul în care se inoculează suficiente celule în mediu. Dacă se adaugă reactiv de oxidază după aproximativ 1 până la 2 ore de incubare, mediul va rămâne limpede. Deoarece reactivul de oxidază ucide gonococii prezenți în mediu, mediul va deveni treptat purpuriu, începând cu partea superioară a tubului, pe măsură ce oxigenul difuzează în mediu. În cazul în care mediul este distribuit în tuburi de dimensiuni diferite de cele sugerate mai sus, asigurați-vă că raportul dintre suprafață și adâncime este cel puțin egal sau mai mic decât cele sugerate mai sus. În cazul în care diametrul tubului în care se distribuie mediul este mai mare decât cel descris mai sus, utilizați un volum mai mare de mediu pentru a menține același raport suprafață/profunditate.
-
Reacția de reducere a nitraților poate să nu aibă loc dacă mediul în care se efectuează testul nu permite o creștere normală a organismului. Cu toate acestea, testul poate fi efectuat într-un mediu care nu permite creșterea organismelor dacă inoculul este suficient de dens pentru ca enzimele preformate să poată epuiza rezerva de oxigen existentă și să reducă nitrații cu o viteză mai mare decât cea cu care oxigenul difuzează în mediu.
Nota: Pentru a verifica dacă oxigenul a fost eliminat din mediu, adăugați 2-3 picături de reactiv de oxidază la un duplicat al mediului inoculat. Dacă oxigenul a fost îndepărtat în mod corespunzător din mediu, reactivul de oxidază nu va deveni violet imediat. În cazul în care mediul conține oxigen dizolvat, reactivul de oxidază va deveni violet. Rețineți, de asemenea, că testul de reducere a nitraților poate fi efectuat în mediul în care a fost adăugat reactivul de oxidază.
- Când reactivul A este adăugat în mediul de testare, nitriții produși ca urmare a reducerii nitraților vor forma un complex cu acidul sulfanilic care produce un precipitat roșu cu alfa-naftilamina din reactivul B. Prezența unei culori roșii în mediul de testare indică faptul că nitriții sunt prezenți ca urmare a reducerii nitraților. Cu toate acestea, absența unei culori roșii după adăugarea reactivilor A și B nu înseamnă neapărat că nitratul nu a fost redus. Lipsa apariției culorii roșii poate însemna (1) că nitratul nu a fost redus sau (2) că nitriții, produși ca rezultat al reducerii nitraților, au fost ei înșiși reduși la gaze azotate. Pentru a determina dacă nitriții au fost reduși, se introduce o cantitate mică de praf de zinc în amestecul de incubare dacă acesta este incolor după adăugarea reactivilor A și B. Praful de zinc catalizează reducerea nitraților în nitriți; în mediul care conține încă nitrați nereduși ar trebui să apară o culoare roșie. Cu toate acestea, este important să nu se adauge prea mult praf de zinc; excesul de praf de zinc va cataliza reducerea nitriților produși din acel nitrat, rezultând un mediu incolor și interpretarea incorectă a testului ca fiind pozitiv (un rezultat fals pozitiv).
- Un test pozitiv al nitrat reductazei este obținut cu tulpina martor negativă, N. gonorrhoeae, după adăugarea prafului de zinc indică faptul că nitratul a fost redus dincolo de nitriți, probabil din cauza adăugării prea mult praf de zinc la test. Se repetă testul, asigurându-se că se adaugă foarte puțin praf de zinc. Culoarea roz, care indică faptul că organismul nu a redus nitratul, poate dura între 10 și 15 minute pentru a se dezvolta. Nu adăugați mai mult praf de zinc! Așteptați să se dezvolte culoarea. Dacă în 30 min. nu s-a dezvoltat nicio culoare, interpretați testul ca fiind pozitiv.
Limitări ale testului
Dacă testul este efectuat corect și tulpinile de control al calității dau rezultate corespunzătoare, nu ar trebui să existe limitări ale acestui test. Trebuie avut grijă să se asigure că toate componentele testului sunt efectuate în mod corespunzător .
Nu se poate face nici o identificare a genului sau a speciei doar pe baza testului de reducere a nitraților.
Rezultate, interpretare și raportare
Isolatele pot fi raportate ca fiind pozitive la nitrați dacă în mediul inoculat se detectează nitriți (culoare roz) după adăugarea reactivilor A și B sau dacă nu se detectează culoare în mediu după adăugarea prafului de zinc.
Izolatele pot fi raportate ca fiind Nitrat-negative dacă nu se detectează nitriți (nicio schimbare de culoare) după adăugarea reactivilor A și B sau dacă apare o culoare roz după adăugarea prafului de zinc în mediul inoculat.
Bibliografie
Knapp JS, Clark VL. Creșterea anaerobă a Neisseria gonorrhoeae cuplată la reducerea nitriților. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Ghid de identificare a genurilor de bacterii. The Williams & Wilkins Co., Baltimore, MD.
.