Guanozină trifosfat (Guanozină-5′-trifosfat pentru a fi mai precis sau, de asemenea, abreviat în mod obișnuit GTP pentru simplificare) este o nucleotidă de înaltă energie (a nu se confunda cu nucleozida) care se găsește în citoplasmă sau polimerizată pentru a forma baza guanină.
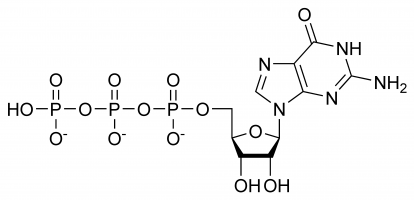
GTP are roluri selective în formarea șirurilor de ARN, funcționând ca o moleculă purtătoare de energie pentru sinteza proteinelor, o coenzimă, un predecesor al cGMP – o moleculă mesager secundar sau ca o moleculă efectoare. Ultimele două sunt în mod obișnuit demonstrate prin modularea proteinei G. Toate acestea sunt rezultatul structurii sale tridimensionale complexe și a varietății de grupe chimice diferite care o compun. Prin urmare, pentru simplificare, poate fi privită ca o combinație de grupuri funcționale diferite care, practic, îndeplinesc funcții diferite în mod izolat (deși, uneori, structura va fi implicată, de exemplu, atunci când interacționează cu o enzimă și cu un alt substrat), de exemplu, numai trifosfatul este implicat în eliberarea de energie pentru polimerizare, în timp ce numai baza guanină este implicată în dezaminare. Este important de reținut că lista de la început nu prezintă toate interacțiunile sale chimice, ci este doar o demonstrație a diferitelor sale capacități.
În GTP, zahărul riboză este central în aranjamentul tridimensional al moleculelor de guanină și trifosfat legate covalent. Această monosaharidă furnizează grupe hidroxil pentru reacții de condensare și atacuri nucleofile, acestea din urmă fiind importante pentru distrugerea moleculelor de ARN și, astfel, pentru reglarea expresiei genice. Molecula de guanină și trifosfatul formează legături covalente la atomii C’1 și, respectiv, C’5, însă este posibil ca acestea să utilizeze și alte grupe hidroxil atâta timp cât structura rezultată nu provoacă ciocniri. Din punctul de vedere al purinei, aceasta este legată ca urmare a unei reacții de condensare la 9’N, care anterior fusese legată covalent de un atom de hidrogen. Deoarece guanina este o bază purinică, este clasificată ca trifosfat purinic alături de trifosfatul de adenină (ATP) și se formează prin modificarea monofosfatului de inozină.
Contenit
- 1 Concepție greșită: GTP, un bloc de construcție de bază
- 2 Unul dintre numeroșii predecesori ai bazelor ARN
- 3 GTP; un văr al ATP-ului universal
- 4 O resursă pentru semnalizare
- 5 Referințe
Concepție greșită: GTP, un bloc de bază
Fătul este principalul organ care sintetizează nucleotidele purinice și piramidice. Nucleotidele purinice (GTP și ATP) sunt sintetizate prin crearea mai întâi a monofosfatului de inozină din ATP, glutamină, glicină, CO2, aspartat și formiat. IMP
pot fi apoi modificate pentru a obține oricare dintre molecule.
În cazul formării GTP, IMP este mai întâi transformat în XMP de către IMP dehidrogenază. Modificarea chimică și structurală rezultată permite acțiunea GTP-sintetazei care transformă rapid XMP în GMP. Cu toate acestea, GMP nu este o moleculă cu energie ridicată, deoarece nu posedă un trifosfat, astfel încât este apoi fosforilată de nucleozidele fosfat kinazice pentru a produce mai întâi un difosfat și, în cele din urmă, un trifosfat.
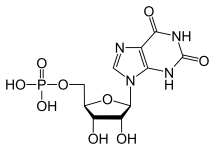
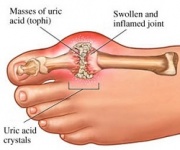
GTP este în mod normal catabolizat în acid uric insolubil care poate apărea apoi în urină sub formă de cristale de urat de sodiu. Acest proces este considerat anormal dacă are loc în articulațiile sinoviale, rezultând acid uric care este apoi transformat în urat monosodic dăunător sau în pirofosfat de calciu dihidrat. Prezența acestor substanțe chimice permite dezvoltarea inflamației și a artritei, iar simptomele combinate duc la clasificarea bolii drept gută. Un alt exemplu al importanței catabolismului adecvat al nucleotidelor purinice este boala imunodeficienței combinate severe, care duce la distrugerea limfocitelor B și T esențiale
One Of Many RNA Base Predecesors
Există mai multe diferențe între ARN și ADN, dar distincția principală constă în structura nucleobazelor care construiesc fiecare polimer. Nucleobazele ARN conțin o grupare 2’OH pe zahărul lor riboză, ceea ce le permite să fie semnificativ mai reactive din punct de vedere chimic, catalitice și instabile. Este important de reținut că trifosfatul de guanozină este preocupat doar de producerea bazei guanină în ARN. Analogul GTP pentru formarea unei baze de guanină în ADN este Deoxiguanosin trifosfatul. Acest trifosfat conține un zahăr deoxiriboză fără o
Gruparea 2’OH, ceea ce îl face semnificativ mai stabil – împiedicând atacurile nucleofile care ar scinda legăturile fosfodiesterice dintre bazele nucleice. Acest lucru este ideal, deoarece ARN-ul ar trebui să se dezintegreze după ce a fost tradus într-o proteină, în timp ce ADN-ul trebuie să rămână intact pentru trecerea informației genetice pe celula fiică.
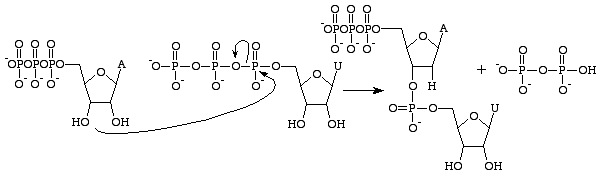
Guanosina trifosfat va avea ca rezultat formarea unei baze guanină ca urmare a scindării unei legături anhidride și a eliberării fosfaților alfa și gama ca fosfați liberi. GMP va forma apoi o legătură fosfodiester cu baza din apropiere care conține grupa 3’OH și va furniza o grupă 3’OH pentru următoarea bază ARN. Această reacție are loc numai în cazul în care baza opusă GMP este citozina, cu care poate forma legături de hidrogen și a cărei viteză este mărită de ARN polimeraza. ARN polimeraza nu aliniază trifosfații. Ea doar catalizează reacția care are loc după ce aceasta a avut loc în mod independent. După cataliză, molecula face parte dintr-un lanț polinucleotidic și nu mai este cunoscută sub numele de GTP, ci sub denumirea de bază guanină.
GTP; o verișoară a ATP-ului universal
Mecanismul care stă la baza producerii energiei din scindarea legăturii anhidride este același la toți trifosfații. Statutul energetic ridicat al trifosfaților se obține prin trei mecanisme distincte. Primul se datorează forțelor de repulsie
pe fiecare dintre grupările fosfat. Acest lucru contribuie la o mare instabilitate a trifosfaților legați și la o mare „dorință” de a atinge un statut energetic mai scăzut. Cea de-a doua se datorează stabilizării prin rezonanță. Atunci când GTP este
transformat în GDP crește cantitatea de poziții posibile pentru perechile de electroni existente, ceea ce contribuie la o stabilitate mai mare. Acest argument se susține și în cazul conversiei GDP în GMP. Al treilea se datorează efectului entropic nefavorabil pe care o cantitate crescută de fosfați îl are asupra conformației moleculelor de apă care înconjoară molecula.
Din moment ce concentrația de GTP în citoplasmă este semnificativ mai mică decât cea de ATP, acesta este utilizat pentru funcții specifice în procesele metabolice celulare.
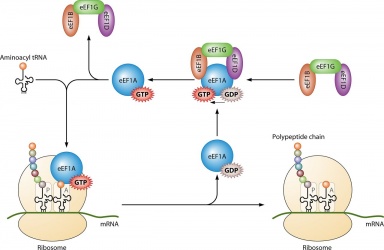
Principala sa utilizare este în sinteza proteinelor atunci când este cuplat cu IF2 în timpul inițierii ribozomale, Ef-Tu și Ef-G în timpul alungării și ;RF3 în timpul terminării. Toate moleculele de GTP care se leagă cu proteinele menționate devin defosforilate, rezultând GDP și un fosfat liber
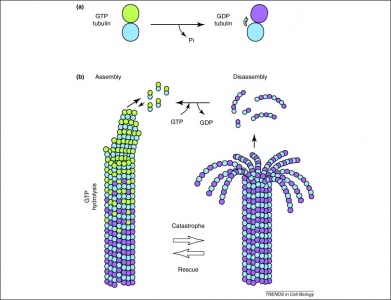
În plus, GTP este, de asemenea, utilizat de dimerii de tubulină în formarea microtubulilor. Dimerii de tubulină sunt compuși din alfa și beta tubulină, fiecare dintre acestea posedând situsuri de legare a GTP. Deoarece beta tubulina există la capătul pozitiv al filamentului, GTP este întotdeauna hidrolizat aici atunci când un alt dimer este adăugat la polimerul de alungire. Este important faptul că hidroliza GTP-ului slăbește interacțiunile necovalente dintre dimerii de tubulină, ceea ce facilitează dizolvarea microtubulilor atunci când este necesar. Rețineți că proteina alfa tubulină GTP nu este defosforilată, astfel încât poate fi considerată ca fiind consistentă în toată structura microtubulului.
O resursă pentru semnalizare
Utilizarea chimiei specifice și a conformației spațiale a GTP este demonstrată în mod eficient prin utilizarea sa în transmiterea de semnale. În primul rând, acesta este capabil să se lege și să reglementeze activitatea diferitelor proteine ale căilor de semnalizare care sunt clasificate în două grupuri diferite. Prima este reprezentată de proteinele heterotrimerice de legare a GTP (cunoscute și sub numele de proteine G heterotrimerice), care utilizează GTP la activarea receptorilor cuplați cu proteina G pentru a modifica activitatea altor proteine din cale… Cele de-a doua sunt proteinele monomerice de legare a GTP (cunoscute și sub numele de proteine G monomerice). Acestea răspund la alți receptori decât receptorii cuplați cu proteina G. Un exemplu tipic citat în timpul explicației lor este proteina Ras. Rețineți că acestea sunt capabile să lege selectiv GTP b nu numai datorită chimiei sale specifice, ci și datorită fenomenului de potrivire indusă. GTP-ul legat va fi apoi hidrolizat după o anumită perioadă de timp și va duce astfel la o autoinactivare a proteinei și la prevenirea stimulării excesive a unei căi de semnalizare. După ce GTP este hidrolizat, GDP va rămâne legat, deoarece modificarea conformațională va duce la o schimbare de afinitate față de molecula de GTP și față de molecula de GDP. Cu toate acestea, aceasta este o modificare impernamentală și poate fi inversată prin activarea ulterioară de către receptorul cuplat la proteina G.
GTP poate fi, de asemenea, utilizat ca reactant pentru a produce cGMP, care este o moleculă de semnalizare secundară relativ comună. Cataliza este declanșată de eliberarea de NO care activează guanilatciclaza, o enzimă care produce cGMP sub formă de GTP. cGMP poate acționa apoi ca un efector față de protein-kinazele care fosforilează și modifică acțiunea unor proteine specifice.
- J Koolman și KH Roehm, Color Atlas of Biochemistry, ediția a 3-a, Stuttgart, Germania. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell și P A Weil. Harper’s Illustrated Biochemistry (Biochimie ilustrată de Harper). Ediția a 28-a. Beijing, China. 2009.
- J Dow, G Lindsay și J Morrison, Biochimie: Molecule, Cells and the Body. Ediția 1. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay și J Morrison, Biochimie: Molecule, Cells and the Body. Ediția 1. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay și J Morrison, Biochimie: Molecule, Cells and the Body. Ediția 1. Wokingham, Anglia. Addison-Wesley. 1996.
- J Koolman și KH Roehm, Color Atlas of Biochemistry, Ediția a 3-a, Stuttgart, Germania. Thieme 2013.
- J Koolman și KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germania. Thieme 2013.
- M W King. Pagina de biochimie medicală. Septembrie 2016. Citat: 11:31. 03.12.2016. Disponibil la: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell și P A Weil. Harper’s Illustrated Biochimie. Ediția a 28-a. Beijing, China. 2009.
- M W King. The Medical Biochemistry Page (Pagina de biochimie medicală). Septembrie 2016. Citat: 11:31. 03.12.2016. Disponibil la: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. Septembrie 2016. Citat: 11:31. 03.12.2016. Disponibil la: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. Septembrie 2016. Citat: 11:31. 03.12.2016. Disponibil la: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. Septembrie 2016. Citat: 11:31. 03.12.2016. Disponibil la: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay și J Morrison, Biochemistry: Molecules, Cells and the Body (Molecule, Cells and the Body). Ediția 1. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay și J Morrison, Biochimie: Molecule, Cells and the Body. Ediția 1. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay și J Morrison, Biochimie: Molecule, Cells and the Body. Ediția 1. Wokingham, Anglia. Addison-Wesley. 1996.
- J Koolman și KH Roehm, Color Atlas of Biochemistry, Ediția a 3-a, Stuttgart, Germania. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto și R Stryer. Biochimie. Ediția a opta. Oraș și țară neidentificate. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, J L Tymoczko, G J Gatto și R Stryer. Biochimie. Ediția a opta. Oraș și țară neidentificate. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, J L Tymoczko, G J Gatto și R Stryer. Biochemistry. Ediția a opta. Oraș și țară neidentificate. Freeman and Co. 2015.
- T E Dever și R Green. The Elongation, Termination and Recycling phases in Eukaryotes. CSHPB. Iulie 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. Ediția a 6-a. New York, SUA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. Ediția a 6-a. New York, SUA. Garland Science. 2015.
- J Koolman și KH Roehm, Color Atlas of Biochemistry, Ediția a 3-a, Stuttgart, Germania. Thieme 2013.
- J Koolman și KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germania. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germania. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germania. Thieme 2013.