Introduction: Clinica de migrenă
Migrena constă în cefalee unilaterală însoțită de un grup de alte simptome senzoriale, autonome și cognitive și a fost identificată de studiul global burden of disease (GBD) 2016 ca fiind a șasea cea mai răspândită tulburare și una dintre principalele cauze de dizabilitate în întreaga lume, apărând adesea la vârsta activă și la femeile adulte tinere și de vârstă mijlocie (Collaborators, 2018). Prin urmare, migrena reprezintă o problemă socială foarte gravă în ceea ce privește anii de viață trăiți cu dizabilitate (YLD) și cea mai importantă cauză de YLD în intervalul de vârstă cuprins între 15 și 49 de ani (a se vedea Steiner et al., 2018). Povara acestei boli nu a fost identificată până de curând, deoarece: migrena nu este o cauză de invaliditate permanentă sau de deces; cefaleea apare ocazional în populația generală (Colaboratori, 2018). Deși nu se cunoaște o patogenie definită pentru migrenă, circulația extracraniană este implicată (Drummond și Lance, 1983). Evoluția clinică a migrenei se articulează în diferite etape următoare sau concomitente: premonitorie, aură, cefalee și postdrom (similară cu faza premonitorie) (Goadsby et al., 2017a). Faza premonitorie include iritabilitate, poftă de mâncare, înțepenire a gâtului și poate apărea între 2 și 72 h înainte de atac și se continuă peste celelalte faze. Conform definițiilor din Clasificarea internațională a tulburărilor de cefalee ediția a treia (ICHD-3):
– aura se caracterizează prin unul sau mai multe deficite neurologice tranzitorii, reversibile, dintre care cel puțin unul trebuie să aibă o localizare unilaterală, care se dezvoltă pe parcursul a 5 min sau mai mult și din care fiecare deficit durează între 5 și 60 min;
– migrena constă în atacuri de cefalee care durează 4-72 h, însoțite de greață, fotofobie și fonofobie, sau ambele (vezi Goadsby et al., 2017a).
Alodinia cutanată, definită ca fiind percepția durerii în urma unor stimuli nedureroși, apare la mai mult de 70% dintre pacienți (Lambru et al., 2018). Cefaleea severă se atenuează până la oprire în timpul fazei de postdramă, în timp ce alte simptome, cum ar fi astenia, somnolența și fotofobia continuă să afecteze pacientul, afișând astfel baza neuronală complexă care stă la baza migrenei (Lambru et al., 2018). În funcție de numărul de zile pe lună afectate, migrena este clasificată ca episodică (mai puțin de 15 zile de migrenă sau cefalee) sau cronică (cel puțin 15 zile, dintre care 8 sau mai multe sunt zile de migrenă) (a se vedea Goadsby et al., 2017b). Acest aspect influențează în mod remarcabil impactul bolii și opțiunile terapeutice (Giamberardino et al., 2017). În cazul a 1 până la 3 crize pe lună este posibil să se utilizeze doar medicamente simptomatice abortive, în timp ce dacă apar 4 până la 14 crize pe lună este obligatoriu să se adauge tratamente preventive; aceste din urmă tratamente sunt necesare pentru a evita cronicizarea bolii (Giamberardino și Martelletti, 2015; Giamberardino et al, 2017) și pentru a reduce riscul de cefalee prin suprasolicitare medicamentoasă și de migrenă refractară (Martelletti, 2017).
Pathophysiology of Migraine and Calcitonin Gene-Related Peptide (CGRP)
Cauza exactă a atacurilor de migrenă nu este încă bine cunoscută, dar cercetările actuale au evidențiat importanța proceselor de sensibilizare în cadrul sistemului trigeminovascular și a întregului trunchi cerebral, precum și observarea reducerii materiei cenușii în zonele de procesare a durerii (a se vedea Goadsby et al, 2017a). Din ganglionul trigemenului care conține corpul celular, aferențele primare pseudounipolare fac sinapsă pe vasele de sânge și pe complexul trigeminocervical din care fibrele de ordinul al doilea fac sinapsă pe neuronii talamocorticali de ordinul al treilea și pe locus coeruleus, pe cenușiul periacueductal și pe hipotalamus (Goadsby et al., 2017a). Fibrele nociceptive de la ganglionul trigemenului și de la ganglionii rădăcinii dorsale cervicale inervează vasele din dura mater, iar terminalele lor eliberează neuropeptide vasoactive, cum ar fi peptida legată de gena calcitoninei (CGRP), care induc vasodilatație. Expresia CGRP, CLR și RAMP1 în vasele dura materne umane este prezentată în figurile 1A-C. Într-adevăr, fibrele nervoase autonome care inervează vasculatura extracerebrală conțin mai multe molecule vasoactive neurotransmițătoare: noradrenalina, serotonina, acetilcolina, neuropeptida Y (NPY), polipeptida intestinală vasoactivă (VIP), substanța P (SP), neurokinina A (NU) și CGRP (Goadsby et al., 1990). Antagoniștii receptorilor CGRP acționează blocând informația nociceptivă din dura mater: aceasta este procesată în nucleii talamici de unde ajunge în regiunile corticale superioare. Aceste intrări din sistemul trigeminovascular sunt supuse unei modulații prin calea descendentă din trunchiul cerebral: se consideră că agoniștii receptorilor de 5-hidroxitriptamină (5HT)1B/1D, adică triptanii, acționează prin intermediul acestui sistem și contracarează vasodilatația apărută. În timp ce propranololul și topiramatul ca tratament preventiv, ultimele medicamente sunt utilizate în episoadele acute de migrenă. În special, în afară de activitatea lor vasoconstrictoare, triptanii care acționează direct asupra receptorilor presinaptici 5HT1B/D inhibă eliberarea de mediatori precum CGRP implicați în nocicepție. Mai mult, s-a demonstrat experimental că sumatriptanul inhibă curentul de intrare mediat de receptorul tranzitoriu potențial vaniloid 1 (TRPV1) în ganglionii trigeminali (Evans et al., 2012). CGRP este eliberat în timpul atacurilor de migrenă și prezintă mai multe roluri, fiind cea mai vasoactivă neuropeptidă ale cărei niveluri craniovasculare cresc în cursul tulburării (Goadsby et al., 1990). S-a demonstrat că CGRP suferă modificări și în lichidul cefalorahidian (van Dongen et al., 2017). Factorii declanșatori ai excitabilității centrale alterate și a următoarei izbucniri a episoadelor de durere migrenoasă au fost cercetați de mult timp. Stimularea fibrelor nervoase poate favoriza atât potențiale de acțiune ortodromice, cât și antidromice și, în special, activarea aferenților senzoriali primari peptidergici durali care exprimă potențialul receptor tranzitoriu (TRP) poate induce eliberarea mai multor molecule, inclusiv CGRP, care declanșează reacții inflamatorii tisulare cunoscute sub numele de inflamație neurogenă (Xanthos și Sandkuhler, 2014). În special, CGRP este implicat în nocicepția craniană și în epifenomenul de vasodilatație prin legarea receptorilor săi pe vasele de sânge meningeale și cerebrale (Deen et al., 2017). Aceste procese favorizează sensibilizarea fibrelor trigeminale de ordinul al doilea care duc stimulii dureroși amplificați în regiuni mai înalte, cum ar fi talamusul, hipotalamusul și cortexul, dând astfel naștere migrenei (Dussor et al., 2014). TRPs sunt supuși activării ca răspuns la mai mulți stimuli iritanți din mediul înconjurător, cum ar fi variațiile de temperatură și pH, care, la persoanele predispuse, pot declanșa durerea de migrenă. CGRP este produs prin splicarea alternativă specifică țesutului a genei CALC I a calcitoninei de pe cromozomul 11, care codifică, de asemenea, pentru calcitonină. Dimpotrivă, β CGRP este produsă de gena CALC II localizată pe un alt sit al cromozomului 11. Neuropeptida α CGRP este prezentă în sistemul nervos central ca izoformă α de 37 de aminoacizi, iar transducția semnalului său este mediată de doi receptori.
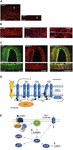
Figura 1. Apariția și calea CGRP în migrenă. Expresia CGRP, CLR și RAMP1 în vasele dura umane: (A) imunoreactivitatea CGRP se găsește în fibrele subțiri din adventice; (B) secțiuni transversale și longitudinale care arată expresia RAMP1 în citoplasma celulelor musculare netede; (C) coexpresia CLR și RAMP1 în stratul de celule musculare netede. (D) componente ale receptorului CGRP și reziduuri importante pentru semnalizarea și internalizarea receptorului. Receptorul CGRP este format din CLR (albastru), RAMP1 (galben) și RCP (portocaliu). Reziduurile importante din punct de vedere funcțional sunt prezentate ca abrevieri cu o singură literă. Reziduurile de aminoacizi sunt numerotate de la începutul peptidei semnal N-terminale prezise (Swiss-Prot Q16602). Mai mulți aminoacizi din C-terminalul CLR (∼N400-C436) și I312 la joncțiunea ICL3/TM5 sunt necesari pentru o internalizare eficientă mediată de CGRP. Sunt ilustrate caracteristici importante ale receptorului CGRP, inclusiv „cotul” TM6 (P343) și cea de-a opta helixă putativă (∼G388-W399) din CLR. C′, C-terminal; ECL, buclă extracelulară; ICL, buclă intracelulară; N′, N-terminal; TM, transmembranar. (E) Semnalizarea intracelulară mediată de receptorul CGRP: Semnalizarea Gαs crește activitatea AC (verde), crescând cAMP intracelular, activând PKA și, ulterior, mulți potențiali efectori din aval. Panourile (A-C) sunt adaptate după Eftekhari et al. (2013) și, respectiv, panoul (D,E) după Walker et al. (2010), cu permisiune.
Primul este cunoscut sub numele de receptor CGRP canonic și este un receptor cuplat cu proteina Gαs care necesită proteina modificatoare a activității receptorului (RAMP) 1 pentru a fi funcțional (Goadsby et al., 2017a). Cel de-al doilea este receptorul uman de subtip 1 al amilinei (AMY1): amilina face parte din familia genelor calcitoninei și are activitate hormonală. Atunci când CGRP se leagă de receptorul său, acesta este supus internalizării dependente de dinamină/clatrin după ce a fost complexat cu β-arrestină (a se vedea Walker et al., 2010). Au loc modificări conformaționale care induc activarea adenilatciclazei (AC), creșterea AMPc și activarea proteinei kinazei A (PKA) care poate promova vasodilatația prin activarea directă a sintezei endoteliale a oxidului nitric endotelial și a răspunsurilor la durere. Acest din urmă receptor poate fi cuplat la Gαq/11 cu activarea fosfolipazei C (PLC), la proteina kinaza activată de mitogen (MAPK) și la eliberarea de NO (a se vedea Walker et al., 2010) (a se vedea figurile 1D,E pentru reprezentarea schematică a semnalizării intracelulare mediate de receptorul CGRP). Administrarea de CGRP la migreniști declanșează crizele, iar aceste dovezi susțin rolul său esențial în patogeneza migrenei (Lassen et al., 2002). Un sistem de terminare a semnalului nu a fost încă identificat: CGRP este metabolizat de neprilizină, de enzima de degradare a insulinei și de enzima de conversie a endotelinei-1 și s-a emis ipoteza unui sistem de transport activ de recaptare (a se vedea Russell et al., 2014). Mai mult, atunci când receptorul este activat tranzitoriu de CGRP, acesta este internalizat în endosomi și reciclat rapid înapoi la membrana celulară, în timp ce stimularea cronică a receptorului induce desensibilizarea și degradarea lizozomală (a se vedea Russell et al., 2014).
Intervenții farmacologice asupra căii CGRP
Migraina este o tulburare neurovasculară invalidantă cu multiple fațete, iar terapia actuală cu triptani pe cale orală este eficientă în crizele acute, deși aproximativ 40% dintre pacienți sunt rezistenți la tratament (Ferrari et al., 2001; Edvinsson, 2015). Acești agoniști selectivi 5-HT1B/1D, dintre care cel mai frecvent utilizat este sumatriptanul activ mai ales pe cale subcutanată, își exercită acțiunea terapeutică prin vasoconstricția vaselor craniene și inhibarea sistemului trigeminal și trigeminocervical (a se vedea Ferrari et al., 2001). Cu toate acestea, vasoconstricția reprezintă o limită pentru efectele secundare cardiovasculare ale acestor medicamente. În plus, tratamentul cu triptani nu poate dura mai mult de 9 zile pe lună din cauza riscului de cefalee indusă de medicamente. În 2010, toxina botulinică de tip A (BoNT-A) a fost aprobată de Food and Drug Administration (FDA) în prevenirea migrenei la migrenele cronice care nu răspund, iar administrarea sa complexă (necesită injectarea în 31 de locuri) limitează complianța pacienților. Datorită rolului esențial jucat de CGRP în fiziopatologia migrenei, au fost dezvoltați antagoniști ai receptorului său. Aceste medicamente fac parte din clasa gepanților. Telgecepant, primul gepant oral, a rezultat bine tolerat la migreniștii afectați de boală coronariană (ClinicalTrials.gov NCT00662818, Ho et al., 2012), dar a prezentat hepatotoxicitate, astfel că, în ciuda cercetărilor continue asupra acestor molecule mici, a fost propusă o nouă abordare constând în dezvoltarea de anticorpi monoclonali (mAbs) față de CGRP (nezumabs) sau față de receptorul CGRP (numabs). Se crede că aceste medicamente inhibă acțiunea moleculelor de CGRP circulante pentru a preveni atacurile de migrenă și, deoarece nu traversează bariera hematoencefalică (BBB) din cauza dimensiunii lor, locurile de acțiune ar trebui să fie în sistemul trigemenin (Edvinsson, 2015). În special, vasele durale nu sunt incluse în BBB. În plus, CGRP probabil că nu traversează BBB și acționează ca un modulator paracrin, deoarece este exprimat de jumătate din neuronii ganglionului trigemenului care nu prezintă receptorul CGRP, exprimat de celulele gliale satelit și de cele 30 % din soma neuronală a ganglionului trigemenului (a se vedea Yuan et al., 2017). În prezent, există patru mAb, eptinezumab, fremanezumab, galcanezumab și erenumab, studiați în studii clinice pentru migrena episodică și cronică. Primii trei mAb sunt anticorpi umanizați îndreptați spre CGRP, în timp ce erenumab este un anticorp uman îndreptat spre receptorul său canonic. Timpul de înjumătățire al acestor medicamente este destul de lung, permițând astfel nu mai mult de o administrare pe lună, ceea ce reprezintă o chestiune de interes, deoarece mAb-urile trebuie să fie administrate pe cale intravenoasă sau subcutanată. În special, eptinezumab se administrează doar intravenos (Israel et al., 2018). Studiul de fază III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) a evaluat eficacitatea eptinezumabului în ceea ce privește prevenirea migrenei episodice frecvente. Rezultatele au arătat o reducere semnificativă a criteriului principal de evaluare constând în scăderea numărului de zile de migrenă lunară (MMD) de la valoarea inițială medie de 8,5 zile în săptămânile 1-12 la 4,3 MMD cu doza de 300 mg, 3,9 cu 100 mg și 4,0 cu 30 mg față de 3,2 zile cu placebo (Saper et al., 2018). Pentru evaluarea eptinezumabului în prevenirea migrenei cronice, 1121 de participanți au fost înrolați în studiul PROMISE 2 (ClinicalTrials.gov NCT02974153). Eficacitatea galcanezumab a fost evaluată pentru prevenirea migrenei episodice în cadrul studiului EVOLVE-1 de fază 3 dublu-orb, randomizat, controlat cu placebo (ClinicalTrials.gov NCT02614183) disecat în 4 perioade și în cadrul studiului clinic EVOLVE-2 de fază 3, randomizat, controlat, dublu-orb, dublu-orb, de 6 luni (ClinicalTrials.gov NCT02614196). În cadrul studiului EVOLVE-1, ambele doze de galcanezumab (120 și 240 mg) au îndeplinit rezultatul primar de reducere semnificativă a zilelor lunare de migrenă de 4,7 zile și, respectiv, 4,6 zile, în comparație cu cele 2,8 zile ale placebo (Stauffer et al., 2018). În cadrul studiului EVOLVE-2, pacienții au primit o injecție lunară de 120 sau 240 mg de galcanezumab. Media lunară a zilelor lunare de migrenă a fost redusă cu 4,3 și, respectiv, 4,2 zile, în comparație cu reducerea de 2,3 zile obținută cu placebo (p < 0,001) (Skljarevski et al., 2018). De asemenea, au fost îndeplinite și parametrii finali secundari de reducere a tulburărilor funcționale evaluate prin scorul domeniului Role Function-Restrictive (R-FR) din Chestionarul privind calitatea vieții specific migrenei (MSQ) și de îmbunătățire a scorului de la Patient Global Impression of Severity (PGI-S) și a scorului de la Migraine Disability Assessment (MIDAS; punct temporal = luna 6) (Skljarevski et al., 2018). 147 (65,0%) și 163 (71,5%) dintre pacienții tratați cu galcanezumab, 120 și, respectiv, 240 mg, și 287 (62,3%) cu placebo au prezentat evenimente adverse, printre care infarct miocardic acut și atac ischemic tranzitoriu în cadrul unui grup de șapte pacienți aflați sub tratament cu galcanezumab 240 mg (Skljarevski et al., 2018). Nu au existat diferențe semnificative din punct de vedere statistic în ceea ce privește modificarea medie față de valorile inițiale pentru tensiunea arterială sistolică/diastolică. La 19 (8,6 %), 11 (5,1 %) și 2 (0,5 %) pacienți din grupurile galcanezumab 120 mg, galcanezumab 240 mg și, respectiv, placebo, au prezentat anticorpi antidrog (ADA) apăruți în timpul tratamentului. În cadrul studiului REGAIN de fază III de evaluare a galcanezumab împotriva migrenei cronice, MMD au fost reduse de 4,8 zile cu doza de 120 mg și de 4,6 zile cu doza de 240 mg, comparativ cu 2,7 cu placebo (a se vedea Yuan et al., 2017). În plus, s-a demonstrat că tratamentul cu galcanezumab este dotat cu o persistență semnificativă din punct de vedere statistic a efectului (Forderreuther et al., 2018). Fremanezumab a fost investigat în cadrul studiului de fază III HALO pentru tratamentul preventiv al migrenei (ClinicalTrials.gov NCT02638103). Acesta a redus MMD de migrenă episodică la 12 săptămâni de 3,7 zile la 225 mg lunar timp de 3 luni și de 3,4 zile la 675 mg o dată în regim de doză trimestrială, în comparație cu scăderea de 2,2 zile a placebo (a se vedea Yuan et al., 2017). Eficacitatea erenumab în prevenirea migrenei episodice a fost studiată în cadrul studiului de fază 3, randomizat, dublu-orb, controlat cu placebo ARISE (ClinicalTrials.gov NCT02483585). MMD au fost reduse cu 70 mg de erenumab subcutanat lunar de 2,9 zile în comparație cu 1,8 zile de placebo (p < 0,001) și a fost eficient în ceea ce privește parametrii finali secundari de reducere cu cel puțin 50 % a MMD și modificarea numărului de zile de tratament medicamentos lunar specific migrenei (MSMD) (Dodick et al., 2018). Proporția de pacienți care au prezentat evenimente adverse a fost similară între grupul tratat cu mAb și cel cu placebo; 4,3 % au fost testați pozitiv pentru anticorpi de legare anti-erenumab până în săptămâna 12, dintre care unul a fost pozitiv în mod tranzitoriu pentru anticorpi de neutralizare, dar numai în săptămâna 4 (Dodick et al., 2018). De asemenea, studiul clinic STRIVE de fază III (ClinicalTrials.gov NCT02456740) a evaluat eficacitatea erenumabului pentru prevenirea migrenei episodice. Erenumab a fost administrat în doze de 70 sau 140 mg lunar, timp de 6 luni (Goadsby et al., 2017b). Numărul mediu inițial de MMD a fost de 8,3, iar dozele de 70 mg și 140 mg l-au redus cu 3,2 și, respectiv, 3,7, în comparație cu 1,8 zile de placebo (cu p < 0,001 pentru fiecare doză față de placebo) (Goadsby et al., 2017b). De asemenea, pe parcursul ultimelor 3 luni de tratament, fiecare doză de erenumab a îndeplinit parametrii secundari de reducere cu cel puțin 50 % față de valoarea inițială a numărului mediu de zile de migrenă pe lună și de reducere față de valoarea inițială atât în cadrul Jurnalului de impact al funcției fizice în migrenă (MPFID) privind activitățile cotidiene (MPFID-EA), cât și în ceea ce privește afectarea fizică (MPFID-PI) (Goadsby et al., 2017b). La acei pacienți cu anticorpi anti-erenumab, doar unul din grupul tratat cu 70 mg a fost testat pozitiv pentru anticorpi neutralizanți, iar mAb-ul a fost, în general, bine tolerat în ceea ce privește nivelul creatininei, toxicitatea hepatică, numărul total de neutrofile și funcția electrocardiografică (Goadsby et al., 2017b). Potrivit autorilor, una dintre limitele acestui studiu este că au fost excluși pacienții care nu au prezentat un răspuns terapeutic la mai mult de două clase de medicamente de prevenire a migrenei (Goadsby et al., 2017b). În plus, există studii clinice care investighează eficacitatea fremanezumabului (NCT02945046 și NCT02964338) și a galcanezumabului (NCT 02397473 și NCT02438826) în prevenirea cefaleei în ciorchine (a se vedea Israel et al., 2018), adică a cefaleei primare caracterizată prin durere unilaterală severă în zona periorbitală însoțită de lăcrimare, roșeață conjunctivală și rinoree (Vollesen et al., 2018). Într-adevăr, s-a demonstrat că infuzia intravenoasă continuă, prin intermediul pompei de perfuzie, de 1,5 μg/min de CGRP timp de 20 de minute (în 2 zile separate de cel puțin 7 zile) la pacienții cu cefalee în ciorchine episodică (fază activă sau de remisiune) sau cronică a provocat atacuri de tip cluster la pacienții aflați în faza activă sau cu cefalee în ciorchine cronică, dar nu și în faza de remisiune (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). Principalele avantaje PK ale mAb-urilor sunt reprezentate de timpul de înjumătățire lung de eliminare, limitând astfel nevoia de dozare zilnică și eliminarea prin proteoliză. Din cauza efectelor gepanților asupra ficatului și din cauza proprietăților vasodilatatoare ale CGRP, cele mai de temut riscuri ale inhibării semnalizării CGRP constau în ipoteza hepatotoxicității și a riscului cardiovascular teoretic (Yuan et al., 2017). Federația Europeană a Cefaleei (EHF) a elaborat ghiduri privind utilizarea mAb-urilor anti-CGRP aplicând metoda Grading of Recommendation, Assessment, Development and Evaluation (GRADE) și, atunci când nu a fost posibil, bazându-se pe opinia unui grup de experți (Sacco et al., 2019).
Relația farmacocinetică (PK)/farmacodinamică (PD) a mAb-urilor anti-migrenă
Dezvoltarea mAb-urilor a reprezentat o abordare complet nouă pentru inhibarea căii CGRP. Principala îmbunătățire PD obținută prin utilizarea mAb-urilor în locul moleculelor mici constă în faptul că este mai ușor să se țintească situsul larg de legare a receptorului CGRP-ligand (Taylor, 2018). Principalele avantaje PK ale mAb-urilor sunt reprezentate de timpul de înjumătățire de eliminare lung, fără a fi nevoie de o dozare zilnică și de clearance-ul prin proteoliză, iar cele mai temute riscuri ale inhibării semnalizării CGRP constau în hepato-toxicitatea ipotetică, datorită efectelor gepanților asupra ficatului, și în riscul cardiovascular teoretic, din cauza proprietăților vasodilatatoare ale CGRP. Cu toate acestea, urmărind traseul acestor mAbs de la producerea lor până la țintă, primul obstacol pe care îl întâmpină aceste molecule este administrarea lor, din cauza biodisponibilității orale reduse. Prin urmare, este necesară o cale de administrare parenterală și, pentru a favoriza aderența la tratament, timpul de înjumătățire trebuie să fie lung (Taylor, 2018). Imunoglobulinele (Ig)G1, 2 sau 4 sunt posibilitățile (Wang et al., 2008; Taylor, 2018). În afară de originea IgG, eventuala reactivitate încrucișată și modificările individuale ale catabolismului pot afecta timpul de înjumătățire (Bonilla, 2008; Taylor, 2018). Tehnologia utilizată pentru a produce mAb-uri se bazează pe utilizarea hibridomurilor compuse din celule în diviziune continuă care produc clone determinate ale unui singur tip de anticorp, cu o variabilitate nulă sau redusă (Taylor, 2018). Pe baza originii aminoacizilor care compun mAb-ul, este posibil să se facă distincția între mAb-uri chimerice (imunizare la rozătoare; menținerea regiunii de legare a antigenului Fab de rozătoare Fragment, dar introducerea regiunii cristalizabile Fc de Fragment uman), umanizate (zumabs, cu regiuni de determinare a complementarității, CDR, de șoarece, grefate pe regiuni Fab umane) și umane (introducerea întregii secvențe a genei anticorpului uman în șoarecele care devine umanizat, ca de exemplu XenoMouse) (a se vedea Taylor, 2018). CDR-urile influențează adaptarea la țintă. Dintre cei 4 mAb antimigrenă, doar erenumab este uman, în timp ce CDR-urile grefate sunt de șoarece pentru fremanezumab, de iepure pentru eptinezumab și probabil de șoarece pentru galcanezumab (a se vedea Taylor, 2018). În special, singurul mAb anti-receptor CGRP este erenumab, care este un IgG2λ uman, iar celelalte trei mAb-uri îndreptate împotriva situsurilor de CGRP sunt: eptinezumab, un IgG1k umanizat modificat genetic; fremanezumab, un IgG2k umanizat; galcanezumab, un IgG4 umanizat (Edvinsson et al., 2018). Erenumab (Tmax 3-14 zile) necesită administrare subcutanată lunară, la fel ca și fremanezumab (Tmax 3-20 de zile) și galcanezumab (Tmax 7-14 zile) (Taylor, 2018). Dimpotrivă, eptinezumab (Tmax 4,8 h) se administrează intravenos o dată la 3 luni; se asociază mai rapid și se disociază mai lent decât fremanezumab și galcanezumab. Deoarece mAb-urile sunt proteine de dimensiuni mari, acestea nu pot traversa cu ușurință BBB. Unii receptori CGRP se află în afara BBB, permițând astfel acțiunea mAb-urilor anti-CGRP (Edvinsson, 2018). Înainte de legare, anticorpul intră în celulele endoteliale vasculare prin pinocitoză. Volumele mari de distribuție aparentă ar putea depinde de țesut și de capacitatea aferentă de legare a mAb-ului (Lobo et al., 2004; Taylor, 2018). Erenumab este cea mai nouă abordare, deoarece este singura care vizează o proteină de fuziune a domeniilor extracelulare ale receptorului uman CALCRL (necesar în receptorii pentru CGRP și adrenomedullină) și RAMP1, inclusiv buzunarul de legare a CGRP (Edvinsson et al., 2018). S-a demonstrat că inhibă în mod competitiv legarea -CGRP la receptorul uman CGRP în celulele de neuroblastom uman (SK-N-MC) cu un Ki de 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab a exercitat un antagonism puternic și complet al acumulării de AMPc stimulată de CGRP cu o CI50 de 2,3 ± 0,9 nM în testele funcționale efectuate în SK-N-MC (Shi et al., 2016). Mai mult, a rezultat de 5000 de ori mai selectiv pentru receptorul CGRP, prezentând niciun efect agonist/antagonist asupra altor receptori umani din familia calcitoninei, inclusiv asupra receptorilor de adrenomedullină, calcitonină și amilină până la cea mai mare concentrație testată de 10 μM (Shi et al., 2016). Fremanezumab și-ar putea exercita efectul asupra diferitelor vase; de fapt, acesta provoacă o inhibiție dependentă de concentrație a vasodilatației induse de CGRP în arterele cerebrale, meningeale și abdominale periferice umane precontractate (Ohlsson et al., 2018). În plus, CGRP poate acționa, de asemenea, asupra neuronilor și celulelor gliale și asupra glifatice (asemănătoare limfaticei), acestea din urmă fiind implicate în exprimarea aurei (a se vedea Messlinger, 2018). Absența probabilă a metabolizării de către enzimele hepatice ar putea evita interacțiunile medicamentoase. Eliminarea are loc prin proteoliza renală a aminoacizilor. Deși studiile clinice raportează că acești anticorpi sunt în general bine tolerați, în afară de durerea evidențiată la locul de injectare, există preocupări legate de imunogenitatea lor prin producerea de ADA (Taylor, 2018). În timpul unui studiu clinic dublu-orb, randomizat, controlat cu placebo (ClinicalTrials.gov NCT 01337596) care a evaluat tratamentul cu diferite regimuri de doze unice și multiple de galcanezumab, 11 dintre pacienții tratați (26 %) au prezentat titruri scăzute (1:10 – 1:80) de ADA emergente de tratament (la 3 pacienți anticorpii preexistenți au crescut în titru), fără efecte de răspuns la doză și fără efecte detectate asupra PK și PD (Monteith et al., 2017). Studiul imunogenității este esențial, deoarece prezența ADA poate accelera eliminarea medicamentului sau, mai rău, poate favoriza afectarea organelor terminale (Taylor, 2018). Principalele caracteristici ale mAb-urilor antimigrenă sunt rezumate în tabelul 1.

Tabel 1. Principalele caracteristici ale fremanezumabului, eptinezumabului, galcanezumabului și erenumabului.
Concluzie
Migraina este o afecțiune dureroasă neurovasculară invalidantă și debilitantă care reprezintă peste 90% din cazurile de cefalee recurentă și spre care tendința poate fi moștenită (MacGregor, 2017). Divalproex sodic, valproatul de sodiu, topiramatul, metoprololul, propranololul și timololul au dovedit dovezi solide, de nivel A, pentru prevenirea migrenei (American Academy of Neurology și American Headache Society, 2015). Cu toate acestea, toate tratamentele preventive orale clasice, inclusiv antidepresivele triciclice, betablocantele, antagoniștii 5-HT2 ergots și medicamentele antiepileptice nu au fost dezvoltate pentru migrenă și asigură o reducere cu 50% a numărului de zile lunare de durere migrenoasă doar până la 45% dintre migreniști (D’Amico și Tepper, 2008), de asemenea, din cauza aderenței scăzute din cauza tolerabilității reduse. Persistența și întreruperea medicației au fost examinate într-o analiză retrospectivă a cererilor de rambursare din SUA (Hepp et al., 2017), iar rezultatele sugerează o persistență scăzută la medicamentul utilizat inițial și o cantitate ridicată de întreruperi până la 6 luni, independent de clasa de medicamente. Datorită rolului fundamental al CGRP în susținerea neuroinflamării și a sensibilizării centrale în calea de la ganglionul trigemenului și trunchiul cerebral la regiunile superioare implicate în fiziopatologia migrenei, au fost dezvoltate noi mAb-uri față de CGRP și receptorul său. Primii antagoniști CGRP cu molecule mici au arătat că induc toxicitate hepatică, dar mAbs nu au produs nici metaboliți toxici, nici reacții secundare cardiovasculare din cauza inhibării vasodilatației (a se vedea Deen et al., 2017). De asemenea, efectele secundare centrale nu au fost evidențiate. Efectele potențiale pe termen lung ale blocării CGRP trebuie încă să fie studiate, dar, un avantaj fundamental al acestor anticorpi provine din timpul de înjumătățire lung al acestora, permițând injecții lunare sau mai puțin frecvente, ceea ce poate îmbunătăți în mod remarcabil aderența la tratament și eficacitatea ulterioară a acestuia (Deen et al., 2017). Astfel, anticorpii mAb anti-CGRP ar putea reprezenta instrumente eficiente în arsenalul terapeutic împotriva migrenei fără răspuns; cu toate acestea, este obligatorie o monitorizare aprofundată a eficacității și siguranței (de exemplu, producerea de metaboliți toxici, imunogenitatea cu ADA, anticorpi neutralizanți și reactivitate încrucișată tisulară și efecte secundare) (Taylor, 2018). De fapt, dovezile provenite de la produse biotehnologice mai vechi arată că terapiile cu mAb-uri anti-factori de necroză tumorală α (TNFα) pot fi supuse unui eșec secundar (spre deosebire de non-răspunsurile primare) al răspunsului terapeutic inițial, deoarece aceste medicamente induc producerea de anticorpi care pot degrada mAb-ul, dar pot, de asemenea, să neutralizeze acțiunea acestuia înainte de a se lega de țintă (a se vedea Prado et al., 2017). Imunogenitatea poate fi influențată de glicozilare, de tipul de mAb, de numărul de epitopi și de impuritățile din formulare (a se vedea Prado et al., 2017). În plus, mai multe efecte secundare grave aparent inexplicabile sunt asociate cu imunogenitatea anti-TNFα. Au fost evidențiate reacții de hipersensibilitate locală și sistemică, imunodeficiență cu sensibilitate crescută la infecții și formarea de complexe imune care pot duce chiar la deces (a se vedea Prado et al., 2017). Prin urmare, utilizarea diagnosticelor terapeutice (teranotice) poate îmbunătăți cunoașterea și gestionarea corectă a acestor dispozitive farmacologice (Bendtzen, 2013; Prado et al., 2017).
Contribuții ale autorilor
MTC, LAM, PT și GB au conceput studiul. DS a colectat rezultatele studiului, a analizat literatura de specialitate și a redactat manuscrisul. AA, LR și MN au participat la studiul literaturii de specialitate. Toți autorii au citit și au aprobat manuscrisul final.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Academia Americană de Neurologie și Societatea Americană de Cefalee (2015). Anexa a: rezumat al ghidului bazat pe dovezi pentru clinicieni, actualizare: tratamentul farmacologic pentru prevenirea migrenei episodice la adulți. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | Reflect Full Text | Google Scholar
Bendtzen, K. (2013). Medicina personalizată: teranostica (diagnosticare terapeutică) esențială pentru utilizarea rațională a antagoniștilor factorului de necroză tumorală-alfa. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmacocinetica imunoglobulinei administrate pe cale intravenoasă sau subcutanată. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Colaboratori, G. B. D. H. (2018). Povara globală, regională și națională a migrenei și a cefaleei de tip tensiune, 1990-2016: o analiză sistematică pentru studiul privind povara globală a bolilor 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., și Tepper, S. J. (2008). Profilaxia migrenei: principii generale și acceptarea de către pacienți. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Blocarea CGRP la pacienții cu migrenă – o analiză a argumentelor pro și contra. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | Refef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: un studiu randomizat de fază 3 al erenumab pentru migrena episodică. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D. D., și Lance, J. W. (1983). Modificări vasculare extracraniene și sursa durerii în cefaleea migrenoasă. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | Refef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., și Porreca, F. (2014). Direcționarea canalelor TRP pentru noi terapii împotriva migrenei. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | Full CrossRef Text | Google Scholar
Edvvinsson, L. (2015). Antagoniștii receptorilor CGRP și anticorpii împotriva CGRP și a receptorilor săi în tratamentul migrenei. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | Reflect Full Text | Google Scholar
Edvvinsson, L. (2018). Calea CGRP în migrenă ca o țintă viabilă pentru terapii. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | Refef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., K. A., Warfvinge, K., și Krause, D. N. (2018). CGRP ca țintă a noilor terapii împotriva migrenei – transpunerea cu succes de la bancă la clinică. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | Refef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W. și Edvinsson, L. (2013). Diferențierea fibrelor nervoase care stochează CGRP și receptorii CGRP în sistemul trigeminovascular periferic. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., și Premkumar, L. S. (2012). Sumatriptanul inhibă canalele TRPV1 în neuronii trigeminalului. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., și Goadsby, P. J. (2001). Oral triptans (agoniști ai serotoninei 5-HT(1B/1D)) în tratamentul acut al migrenei: o meta-analiză a 53 de studii. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., și Lainez, M. J. A. (2018). Efectele preventive ale galcanezumabului la pacienții adulți cu migrenă episodică sau cronică sunt persistente: date din studiile EVOLVE-1, EVOLVE-2 și REGAIN de fază 3, randomizate, dublu-orb, controlate cu placebo. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | Full CrossRef Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., și Martelletti, P. (2017). Receptorul peptidei legate de gena calcitoninei ca țintă nouă pentru gestionarea persoanelor cu migrenă episodică: dovezi actuale și profilul de siguranță al erenumabului. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., și Martelletti, P. (2015). Medicamente emergente pentru tratamentul migrenei. Expert Opin. Emergent. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | Full CrossRef Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Eliberarea peptidelor vasoactive în circulația extracerebrală a oamenilor în timpul migrenei. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | Text integral | Google Scholar
Goadsby, P. J., Holland, P. R., P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., și Akerman, S. (2017a). Fiziopatologia migrenei: o tulburare a procesării senzoriale. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | Full CrossRef Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Un studiu controlat al erenumab pentru migrena episodică. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistența și modelele de schimbare a medicamentelor profilactice orale pentru migrene în rândul pacienților cu migrenă cronică: o analiză retrospectivă a cererilor de rambursare. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Studiu randomizat, controlat al telcagepant la pacienții cu migrenă și boală coronariană. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., și Reuter, U. (2018). Anticorpii monoclonali CGRP pentru tratamentul preventiv al migrenei. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | Ref Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., și Martelletti, P. (2018). Medicamente emergente pentru tratamentul migrenei: o actualizare. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., și Olesen, J. (2002). CGRP poate juca un rol cauzal în migrenă. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., și Balthasar, J. P. (2004). Antibody pharmacokinetics and pharmacodynamics (Farmacocinetica și farmacodinamica anticorpilor). J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | Full Text | Google Scholar
MacGregor, E. A. (2017). Migrenă. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC20170404040
PubMed Abstract | Ref Full CrossRef Text | Google Scholar
Martelletti, P. (2017). Aplicarea anticorpilor monoclonali CGRP(r) în spectrul migrenei: nevoi și priorități. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Marea inundație CGRP – surse, chiuvete și site-uri de semnalizare în sistemul trigeminovascular. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Siguranța, tolerabilitatea, farmacocinetica și farmacodinamica anticorpului monoclonal LY2951742 (Galcanezumab) care se leagă de CGRP la voluntari sănătoși. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | Refef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., și Edvinsson, L. (2018). Fremanezumab blochează dilatarea indusă de CGRP în arterele cerebrale, meningeale medii și abdominale umane. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | Refef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., și Andrade, L. E. C. (2017). Medicamente anti-TNF biologice: imunogenitatea care stă la baza eșecului tratamentului și a evenimentelor adverse. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | Cross Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., și Brain, S. D. (2014). Peptida legată de gena calcitoninei: fiziologie și fiziopatologie. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | Red Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Ghidul federației europene de cefalee privind utilizarea anticorpilor monoclonali care acționează asupra peptidei legate de gena calcitoninei sau a receptorului acesteia pentru prevenirea migrenei. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Rezultatele primare ale studiului PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1): un studiu de fază 3, randomizat, dublu-orb, controlat cu placebo pentru evaluarea eficacității și siguranței eptinezumabului pentru prevenirea migrenelor episodice frecvente (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Caracterizarea farmacologică a AMG 334, un anticorp monoclonal uman puternic și selectiv împotriva receptorului peptidei legate de gena calcitoninei. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., și Yang, J. Y. (2018). Eficacitatea și siguranța galcanezumabului pentru prevenirea migrenei episodice: rezultatele studiului clinic controlat și randomizat de fază 3 EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., și Conley, R. R. (2018). Evaluarea galcanezumabului pentru prevenirea migrenei episodice: studiul clinic randomizat EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., și Katsarava, Z. (2018). Migrena este prima cauză de dizabilitate la persoanele sub 50 de ani: politicienii din domeniul sănătății vor lua acum notă? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amilină, imunologie și medicină pentru dureri de cap. Cefalee 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | Text integral | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Biomarkeri de migrenă în lichidul cefalorahidian: o revizuire sistematică și o meta-analiză. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Efectul infuziei de peptidă legată de gena calcitoninei asupra atacurilor de cefalee cluster: un studiu clinic randomizat. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., și Hay, D. L. (2010). Reglarea transducției semnalului de către receptorii peptidei legate de gena calcitoninei. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | Refef Full Text | Google Scholar
Wang, W., Wang, E. Q., și Balthasar, J. P. (2008). Farmacocinetica și farmacodinamica anticorpilor monoclonali. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | Full CrossRef Text | Google Scholar
Xanthos, D. N., și Sandkuhler, J. (2014). Neuroinflamarea neurogenică: reacții inflamatorii ale SNC ca răspuns la activitatea neuronală. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | Ref. Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., și Silberstein, S. D. (2017). Anticorpii monoclonali CGRP pentru migrenă: raționament și progres. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar
.