Complicațiile mecanice ale infarctului miocardic acut (IMA) sunt defectul septal ventricular (DSV), ruptura sau disfuncția mușchiului papilar, ruptura peretelui liber cardiac, anevrismul ventricular, obstrucția dinamică a tractului de ieșire (OT) al ventriculului stâng (LV) și insuficiența ventriculară dreaptă (VR). Toate aceste afecțiuni ar putea duce potențial la insuficiență LV cu șoc cardiogen.
O înțelegere temeinică a complicațiilor mecanice ale IMA și a factorilor de risc ai acestora poate ajuta clinicienii să pună un diagnostic precoce. Pentru rezultate favorabile pentru pacienți, este necesar un diagnostic prompt cu terapie medicală adecvată și o intervenție chirurgicală în timp util. Factorii importanți pentru mortalitatea intraspitalicească din cauza complicațiilor mecanice ale IM includ vârsta avansată, șocul cardiogen și insuficiența cardiorespiratorie.
Ruptura peretelui liber ventricular
Ruptura peretelui liber ventricular este cea mai gravă complicație a IAM. VFWR este de obicei asociată cu infarcte transmurale mari și expansiunea antecedentă a infarctului. Este cea mai frecventă cauză de deces, a doua după insuficiența LV, și este responsabilă pentru 15-30% din decesele asociate cu IAM. Incontestabil, cea mai catastrofală dintre complicațiile mecanice, RVS duce la hemopericardie acută și deces prin tamponadă cardiacă.
Incidența globală a RVS variază între 0,8-6,2%. Incidența acestei complicații a scăzut de-a lungul anilor, odată cu un control mai bun al tensiunii arteriale sistolice de 24 de ore; utilizarea crescută a terapiei de reperfuzie, a betablocantelor și a inhibitorilor ECA; și utilizarea redusă a heparinei.
Datele din Registrul Național al Infarctului de Miocard (NRMI) au arătat o incidență ridicată a mortalității intraspitalicești în rândul pacienților care au primit terapie trombolitică (12,1%) decât în rândul pacienților care nu au primit-o (6,1%). În cadrul studiului Thrombolysis in Myocardial Infarction Phase II (TIMI II), 16% dintre pacienți au murit din cauza rupturii cardiace în termen de 18 ore de la terapie. Pacienții care au fost supuși angioplastiei coronariene transluminale percutanate (PTCA) au avut o incidență a rupturii peretelui liber mai mică decât cea a pacienților care au primit terapie trombolitică.
Factori de risc pentru RVS includ vârsta avansată mai mare de 70 de ani, sexul feminin, lipsa IM anterioare, unde Q pe ECG, hipertensiune arterială în timpul fazei inițiale a STEMI, utilizarea de corticosteroizi sau AINS și terapie fibrinolitică la mai mult de 14 ore de la debutul STEMI. Pacienții cu antecedente de angină pectorală, IAM anterior, boală coronariană cu mai multe vase și insuficiență cardiacă cronică sunt mai puțin susceptibili decât ceilalți de a dezvolta VFWR a LV, deoarece aceștia dezvoltă colaterale și precondiționare ischemică.
Prezentarea clinică a VFWR
VFWR sunt dramatice; ele se prezintă acut sau ocazional subacut ca pseudoanevrisme; și cel mai adesea implică peretele anterior sau lateral al LV. Cele mai multe VFWRs apar în prima săptămână după IAM.
Becker et al au clasificat următoarele 3 tipuri de VFWRs :
-
Tipul I – o ruptură bruscă în formă de fantă care este frecvent asociată cu infarcte anterioare și care apare precoce (în decurs de 24 de ore)
-
Tipul II. o eroziune a miocardului infartat la granița dintre miocardul infartat și miocardul viabil
-
Tipul III – o formare precoce de anevrism corelată cu infarcte mai vechi și sever expandate
Tipul III apare de obicei mai târziu decât rupturile de tip I sau tip II. Terapia trombolitică accelerează apariția rupturii cardiace în VFWR de tip I și II Becker. În infarcturile sever expandate (tip III), terapia trombolitică scade incidența rupturii cardiace.
Un pseudoanevrism se formează atunci când pericardul și hematomul adiacent închid o ruptură sau o perforație miocardică. Peretele unui pseudoanevrism este cel mai adesea vizualizat ca o ieșire anevrismală care comunică cu cavitatea LV prin intermediul unui gât îngust. Acest perete este alcătuit din pericard și tromboză organizată și/sau hematom. Este lipsit de elemente miocardice, în timp ce un anevrism adevărat are toate elementele peretelui miocardic original și o bază relativ largă. Pseudoanevrismul poate avea dimensiuni variabile și prezintă un risc ridicat de ruptură.
Prezentările clinice ale VFWR variază în funcție de acuitatea, localizarea și mărimea rupturii. Pacienții cu VFWR acută prezintă durere toracică severă, disociere electromecanică bruscă sau asistolie, colaps hemodinamic și, posibil, deces. La aproximativ o treime dintre pacienți, evoluția este subacută, iar aceștia se prezintă cu simptome precum sincopa, hipotensiune, șoc, aritmie și dureri toracice prelungite și recurente.
Diagnosticarea VFWR
Diagnosticarea precoce a VFWR și intervenția sunt esențiale pentru supraviețuirea pacienților. Este necesar un indice ridicat de suspiciune atunci când pacienții cu IMA se prezintă cu durere toracică severă, șoc sau aritmii și apariția bruscă a disocierii electromecanice. Semnele ECG ale unei FVR iminente au o specificitate limitată, dar includ tahicardia sinusală, defectul de conducere intraventriculară și supradenivelarea persistentă sau recurentă a segmentului ST.
Ecocardiografia este instrumentul de diagnostic de elecție. Descoperirea diagnostică cheie este un revărsat pericardic moderat spre mare, cu semne clinice și ecocardiografice de tamponadă pericardică iminentă. La pacienții cu tamponadă cardiacă și disociere electromecanică, revărsarea pericardică moderată spre severă crește riscul de mortalitate. Acei pacienți fără tamponadă cardiacă inițială, deși au o rată mai mică de mortalitate, trebuie totuși urmăriți, deoarece ruperea tardivă poate să apară în continuare. Absența efuziunii pericardice la ecocardiografie are o valoare predictivă negativă ridicată. În cazul în care capacitatea de a obține ecocardiograme transtoracice este limitată la pacienții care beneficiază de ventilație mecanică, ecocardiografia transesofagiană poate ajuta la confirmarea VFWR.
IRM oferă o calitate superioară a imaginii și permite identificarea locului și a anatomiei unui pseudoanevrism ventricular (adică ruptură a LV reținută de pericard cu cheag inclus). Cu toate acestea, IRM are o utilizare limitată în contextul acut din cauza timpului necesar și a neportabilității unităților de imagistică.
Tratamentul RVS
Cea mai importantă strategie de prevenire este terapia de reperfuzie precoce, intervenția coronariană percutanată (ICP) fiind modalitatea preferată. Terapia fibrinolitică este asociată cu scăderea globală a riscului de RVS; cu toate acestea, utilizarea acesteia la mai mult de 14 ore de la debutul STEMI poate crește riscul de ruptură precoce.
Tratamentul standard pentru VFWR este repararea chirurgicală de urgență după ce se obține stabilitatea hemodinamică. Pacienții pot avea nevoie mai întâi de fluide intravenoase, agenți inotropi și pericardiocenteză de urgență.
Pifarré și asociații au recomandat implementarea unei pompe cu balon intraaortic pentru a reduce postîncărcarea sistolică și a îmbunătăți perfuzia miocardică diastolică.
Au fost aplicate mai multe tehnici chirurgicale, inclusiv infarctomia, aderarea cu plasturi de lipici biologic din fibre de poliester din polietilen tereftalat (Dacron; DuPont, Wilmington, DE) sau rășină de politetrafluoretilenă fluoropolimerică (Teflon; DuPont); și utilizarea suturilor cu gaj fără infarctomie.
Rata mortalității este semnificativ ridicată și depinde în mare măsură de starea hemodinamică preoperatorie a pacientului. Diagnosticul precoce, instituirea rapidă a măsurilor descrise mai sus pentru obținerea stabilității hemodinamice și repararea chirurgicală promptă pot îmbunătăți ratele de supraviețuire. O urmărire a studiului randomizat Acorn a demonstrat o îmbunătățire pe termen lung a structurii și funcției ventriculare stângi după intervenția chirurgicală asupra valvei mitrale timp de până la 5 ani. Aceste date oferă dovezi care susțin repararea valvei mitrale în combinație cu dispozitivul Acorn CorCap pentru pacienții cu insuficiență cardiacă non-ischemică cu disfuncție ventriculară stângă severă, care au fost optimizați din punct de vedere medical, dar care rămân simptomatici cu regurgitare mitrală semnificativă.
Ruptura septului ventricular
RVSR este o complicație infreventă, dar care pune în pericol viața, a IAM. În ciuda tratamentului medical și chirurgical optim, pacienții cu VSR au o rată ridicată a mortalității intraspitalicești. În era prethrombolitice, VSR se producea la 1-3% dintre persoanele cu IM. Incidența a scăzut odată cu terapia trombolitică (la 0,2-0,34%) datorită îmbunătățirii reperfuziunii și salvării miocardului. Distribuția bimodală a VSR se caracterizează printr-o incidență ridicată în primele 24 de ore, cu un alt vârf în zilele 3-5 și rareori la mai mult de 2 săptămâni după IAM.
La pacienții care au primit trombolitice, timpul median de la debutul simptomelor de IMA până la ruptura de sept a fost de 1 zi în studiul Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) și de 16 ore în studiul Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK).
Factori de risc pentru ruptura de sept includ vârsta avansată (>65 ani), sexul feminin, boala cu un singur vas, IM extins și circulație colaterală septală slabă. Înainte de apariția tromboliticilor, hipertensiunea arterială și absența antecedentelor de angină pectorală erau factori de risc pentru RVS. Dimensiunea extinsă a infarctului și implicarea VD sunt alți factori de risc cunoscuți pentru ruptura septală.
La pacienții cu IMA fără reperfuzie, necroza de coagulare se dezvoltă în 3-5 zile după infarct. Neutrofilele migrează în zona necrotică și suferă apoptoză, eliberează enzime litice și grăbesc dezintegrarea miocardului necrotic. Unii pacienți au infarcte cu hematoame intramurale mari, care se disecă în țesut și duc la ruperea precoce a septului. Dimensiunea rupturii septale variază de la câțiva milimetri la câțiva centimetri.
VSR este clasificată ca fiind simplă sau complexă în funcție de lungimea, evoluția și localizarea sa. În ruptura septală simplă, perforația se află la același nivel pe ambele părți ale septului și este prezentă o comunicare directă de la un capăt la altul al septului. O ruptură septală complexă se caracterizează printr-o hemoragie extensivă cu traiecte neregulate, serpiginoase în țesutul necrotic.
Rupturile septale sunt cele mai frecvente la pacienții cu IM anterioare mari din cauza ocluziei arterei LAD care provoacă infarcte septale extinse. Aceste infarcte sunt asociate cu supraînălțări ale segmentului ST și unde Q în derivațiile inferioare (II, III, aVF) și aceste modificări ECG sunt, prin urmare, mai frecvent observate în rupturile septale. Aceste rupturi sunt în general apicale și simple.
Rupturile septale la pacienții cu IM inferior apar relativ rar. Aceste rupturi implică septul inferoposterior bazal și sunt adesea complexe.
Prezentarea clinică a VSR
Simptomele VSR care complică IAM includ durere toracică, dificultăți de respirație, hipotensiune arterială, insuficiență biventriculară și șoc în decurs de câteva ore până la câteva zile. Pacienții se prezintă adesea cu un suflu holosistolic nou, puternic și aspru. Acest suflu este cel mai puternic de-a lungul marginii sternale inferioare stângi și este asociat cu un fior sistolic parasternal palpabil. Galopurile RV și LV S3 sunt frecvente.
La pacienții cu șoc cardiogen care complică ruptura de sept, murmurul și thrill-ul pot fi dificil de identificat. În schimb, pacienții cu RM acută au adesea un murmur sistolic moale la apex, fără un thrill.
Diagnosticul VSR
Ecocardiografia cu imagistică Doppler cu flux color este instrumentul de diagnostic de elecție pentru identificarea unui VSR. (A se vedea imaginea de mai jos.) Sensibilitatea și specificitatea sa au fost raportate ca fiind de până la 100%. În plus, aceasta poate fi utilizată pentru următoarele:
-
Definiți locul și mărimea rupturii septale
-
Evaluați LV și RV funcționale
-
Estimați presiunea sistolică a VD
-
Cuantificați presiunea sistolică a VD
-
Cuantificați presiunea sistolică stângato-right shunt
Cateterizarea cardiacă este de obicei necesară pentru a confirma diagnosticul, cuantificarea gradului de șunt stânga-dreapta, diferențierea VSR de alte afecțiuni (de exemplu, regurgitarea mitrală), plus vizualizarea arterelor coronare.
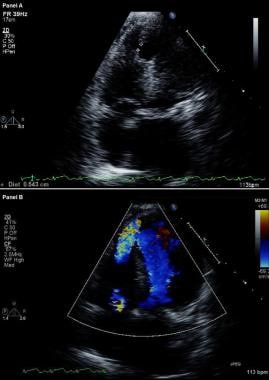
 Complicații ale infarctului miocardic. Ecocardiogramă bidimensională modificată (sus) și imagine Doppler cu flux colorat (jos). Vederile apicale cu patru camere arată o breșă în septul interventricular și o comunicare liberă între ventricule prin intermediul unui defect septal ventricular mare de sept apical la un pacient care a avut recent un infarct miocardic anterior.
Complicații ale infarctului miocardic. Ecocardiogramă bidimensională modificată (sus) și imagine Doppler cu flux colorat (jos). Vederile apicale cu patru camere arată o breșă în septul interventricular și o comunicare liberă între ventricule prin intermediul unui defect septal ventricular mare de sept apical la un pacient care a avut recent un infarct miocardic anterior. La pacienții cu VSR, cateterizarea inimii drepte arată o creștere treptată a saturației de oxigen dinspre atriul drept spre VD; în schimb, în rândul pacienților cu RM nu apare nicio creștere treptată a saturației de oxigen. Prezența undelor V mari în trasarea curenților capilari pulmonari sprijină diagnosticul de RM acută severă.
Ventriculografia stângă poate fi, de asemenea, utilizată pentru a identifica locul rupturii ventriculare (vezi Cateterism cardiac ). Cu toate acestea, acest studiu este de obicei inutil după efectuarea unei examinări ecocardiografice și Doppler de bună calitate.
Tratamentul VSR
Cheia pentru managementul VSR este diagnosticarea promptă și o abordare agresivă a stabilizării hemodinamice, angiografiei și intervenției chirurgicale. Abordarea optimă include stabilizarea hemodinamică prin administrarea de oxigen și suport mecanic cu utilizarea unei pompe cu balon intraaortic, precum și administrarea de vasodilatatoare (pentru a reduce postîncărcarea și, astfel, presiunea LV și șuntul stânga-dreapta), diuretice și agenți inotropici.
Cateterizarea cardiacă este necesară pentru a defini anatomia coronariană; aceasta este urmată de o reparație chirurgicală urgentă.
Într-un studiu efectuat pe 52 de pacienți consecutivi cu ruptură de sept ventricular postinfarct care a fost reparată chirurgical, cercetătorii au constatat că rata mortalității la 30 de zile a fost de 36% (n = 19). Majoritatea pacienților care au supraviețuit mai puțin de 30 de zile au avut o stare de șoc preoperator. Cercetătorii concluzionează că, pentru pacienții cu ruptură de sept ventricular, este necesară îmbunătățirea preoperatorie a stării de șoc și o revascularizare coronariană agresivă.
Terapia medicală este destinată doar stabilizării temporare înainte de intervenția chirurgicală, deoarece starea majorității pacienților se deteriorează rapid și aceștia mor în absența intervenției chirurgicale. În studiul GUSTO-I, rata mortalității la 30 de zile a fost mai mică la pacienții cu VSR care au fost supuși unei reparații chirurgicale decât la pacienții tratați medical (47% față de 94%), la fel ca și rata mortalității la 1 an (53% față de 97%). Lemery et al. au raportat o rată de supraviețuire la 30 de zile de 24% la pacienții tratați medical, comparativ cu 47% la cei tratați chirurgical.
Ghidurile Colegiului American de Cardiologie/Asociația Americană a Inimii (ACC/AHA) pentru tratamentul pacienților cu ruptură septală care complică IMA evidențiază intervenția chirurgicală urgentă, indiferent de starea lor clinică. Tratamentul chirurgical al rupturii de sept include următoarele elemente:
-
Înființarea rapidă a bypass-ului cardiopulmonar hipotermic
-
O abordare a rupturii septale prin zona infarctului și excizia tuturor marginilor necrotice, friabile ale septului și pereților ventriculari pentru a evita hemoragia postoperatorie, defectul septal rezidual, sau ambele
-
Reconstrucția septului și a pereților ventriculari prin utilizarea de material protetic și conservarea configurației geometrice a ventriculilor și a funcției cardiace
Închiderea percutanată a rupturii de sept este o abordare relativ nouă, o abordare utilizată la anumiți pacienți ca alternativă la repararea chirurgicală sau pentru stabilizarea acută a pacienților în stare critică. Cu toate acestea, închiderea percutanată nu este disponibilă în prezent în multe instituții și nu sunt disponibile date privind rezultatele pe termen lung.
Diverse studii nu au reușit să demonstreze o relație între mortalitatea perioperatorie și revascularizarea coronariană concomitentă (grefa de bypass coronarian). Pacienții cu șoc cardiogen datorat rupturii septale au cel mai slab rezultat. În studiul SHOCK, rata mortalității intraspitalicești a fost mai mare la pacienții cu șoc cardiogen datorat rupturii septale (87,3%) decât la pacienții cu șoc cardiogen din toate celelalte cauze (59,2% cu insuficiență ventriculară ventriculară pură și 55,1% cu RM acută).
La pacienții care supraviețuiesc reparației chirurgicale, rata defectului septal recurent sau rezidual este raportată a fi de aproximativ 28%, iar rata mortalității asociate este ridicată.
Intervenția chirurgicală repetată este indicată la pacienții care prezintă insuficiență cardiacă clinică sau o fracție pulmonaro-sistemică mai mare de 2.
Regurgitarea mitrală acută
RMR este o complicație frecventă a IAM care rezultă din remodelarea locală și globală a LV și care este un predictor independent al insuficienței cardiace și al decesului. RM apare de obicei la 7-10 zile după un IMA, deși acest debut poate varia în funcție de mecanismul de RM. Ruptura mușchiului papilar care duce la RM apare în decurs de 1-14 zile (mediana, 1 d).
RMR ușoară până la moderată este adesea tăcută din punct de vedere clinic și este detectată la ecocardiografia Doppler efectuată în timpul fazei precoce a IMA. În astfel de cazuri, RM rareori cauzează compromitere hemodinamică.
Speckle tracking și ecocardiografia tridimensională s-au dovedit a fi instrumente imagistice importante în evaluarea remodelării inverse a LV după intervenția chirurgicală de regurgitare degenerativă a valvei mitrale. Modificările regionale preoperatorii subtile ale funcției diastolice a peretelui septal și lateral au putut fi identificate preoperator, ajutând la optimizarea momentului de trimitere și la recunoașterea potențialilor vinovați ca indicatori ai recidivei bolii după repararea mitrală.
RMR acută severă care rezultă din ruptura mușchilor papilari sau a cordoanelor tendinoase determină o deteriorare hemodinamică bruscă cu șoc cardiogen. Diagnosticul rapid, stabilizarea hemodinamică și intervenția chirurgicală promptă sunt necesare deoarece RM acută severă este asociată cu o rată ridicată a mortalității.
Incidența raportată a RM poate varia din cauza mai multor factori, inclusiv metodele de diagnosticare utilizate, prezența sau absența insuficienței cardiace, gradul de RM raportat, tipul de terapie prestată și timpul de la debutul infarctului până la testare.
În timpul studiului GUSTO-I, incidența RM la pacienții care au primit terapie trombolitică a fost de 1,73%. Studiul SHOCK, care a inclus pacienți cu infarct miocardic care prezentau șoc cardiogen, a observat o incidență de 39,1% a RM moderată până la severă. Kinn et al. au raportat că reperfuzia cu angioplastie a dus la o scădere cu 82% a ratei de RM acută, în comparație cu terapia trombolitică (0,31% vs. 1,73%).
Factori de risc pentru RM sunt vârsta înaintată, sexul feminin, infarctul mare, IAM anterior, ischemia recurentă, boala coronariană multivesselară și insuficiența cardiacă.
Diverse mecanisme pot cauza RM după IAM. Ruptura mușchiului papilar este cel mai frecvent raportat mecanism.
O astfel de ruptură apare la 1% dintre pacienții cu IMA și implică frecvent mușchiul papilar posteromedial mai degrabă decât mușchiul papilar anterolateral, deoarece primul are o singură sursă de sânge față de sursa dublă pentru cel de-al doilea. Ruptura mușchiului papilar poate duce la fluturarea sau prolapsul pliantelor, ceea ce duce la o RM severă. Disfuncția mușchiului papilar datorată cicatrizării sau ischemiei recurente poate duce, de asemenea, la RM în fazele subacută și cronică după IM; această afecțiune se poate rezolva spontan.
Infarcturile posterioare mari produc RM acută din cauza dilatării inelare asimetrice și a modificării funcției și geometriei mușchiului papilar.
Prezentarea clinică a RM
Pacienții cu RM funcțională ușoară sau moderată sunt adesea asimptomatici. Severitatea simptomelor variază în funcție de funcția ventriculară. Caracteristicile clinice ale MR acut sever includ dificultăți respiratorii, oboseală, un nou suflu holosistolic apical, edem pulmonar fulgerător și șoc.
Noul suflu sistolic poate fi doar sistolic timpuriu-mediu, nu holosistolic. Acesta poate fi slab sau chiar absent din cauza creșterii abrupte a presiunii atriale stângi, care diminuează gradientul de presiune dintre atriul stâng și LV, în comparație cu RM cronic. Murmurul se aude cel mai bine la apex, mai degrabă decât la marginea sternală stângă inferioară, și este rareori asociat cu un thrill. Sunt așteptate galopuri S3 și S4.
Diagnosticul RM
Clinicianul nu se poate baza pe un nou suflu holosistolic pentru a diagnostica RM sau pentru a evalua severitatea acestuia din cauza stării hemodinamice variabile. La un pacient cu IMA care se prezintă cu un nou suflu sistolic apical, edem pulmonar acut și șoc cardiogen, un indice ridicat de suspiciune clinică pentru RM severă este cheia diagnosticului.
Radiografia toracică poate arăta dovezi de edem pulmonar în context acut fără o mărire de volum cardiacă semnificativă din punct de vedere clinic.
Ecocardiografia cu imagistică Doppler cu flux color este instrumentul standard de diagnostic pentru detectarea RM. Ecocardiografia transtoracică este instrumentul de screening inițial preferat, dar ecocardiografia transesofagiană este neprețuită în definirea severității și a mecanismului exact al RM acute, în special atunci când suspiciunea de ruptură a mușchiului papilar este ridicată. Cateterismul cardiac trebuie efectuat la toți pacienții pentru a determina amploarea și severitatea bolii coronariene.
Tratamentul RM
Determinarea stabilității hemodinamice, elucidarea mecanismului exact al RM acute și o terapie expeditivă sunt toate necesare pentru un rezultat favorabil. Managementul medical include reducerea postîncărcării cu ajutorul diureticelor, nitroprusiatului de sodiu și nitraților la pacienții care nu sunt hipotensivi.
La pacienții care prezintă un compromis hemodinamic, trebuie să se desfășoare rapid contrapulsația cu balon intraaortic. Această intervenție reduce de obicei substanțial postîncărcarea și volumul regurgitant, îmbunătățind debitul cardiac în vederea pregătirii pentru repararea chirurgicală. Fără reparație chirurgicală, terapia medicală singură la pacienții cu ruptură a mușchiului papilar duce la o ameliorare hemodinamică inadecvată și la un prognostic slab pe termen scurt.
Intervenția chirurgicală de urgență este tratamentul de elecție pentru ruptura mușchiului papilar. Abordările chirurgicale pot include repararea sau înlocuirea valvei mitrale. În absența necrozei mușchiului papilar, repararea valvei mitrale îmbunătățește rata de supraviețuire mai mult decât înlocuirea valvei mitrale. Această diferență se datorează faptului că aparatul subvalvular este de obicei păstrat. Repararea valvei mitrale elimină, de asemenea, complicațiile legate de funcționarea defectuoasă a protezei.
La pacienții cu necroză extinsă a mușchiului papilar și/sau a peretelui liber ventricular, înlocuirea valvei mitrale este modalitatea preferată. S-a demonstrat într-un studiu că grefa de bypass coronarian (CABG) efectuată în momentul intervenției chirurgicale îmbunătățește supraviețuirea pe termen scurt și lung.
Singura situație în care intervenția chirurgicală de urgență poate fi evitată în siguranță este în cazul RM intermitent datorat ischemiei recurente. La acești pacienți, revascularizarea miocardică de succes poate fi eficientă. Această procedură se realizează fie prin angioplastie, fie prin by-pass coronarian.
LVOTO dinamic
Pensat inițial că este prezent doar în cardiomiopatia hipertrofică, diverși cercetători au raportat prezența LVOTO dinamic ca o complicație a IM anterior acut. Prezența LVOTO dinamic a fost, de asemenea, postulată ca fiind una dintre etiologiile pentru ruptura miocardică.
LVOTO dinamică este cauzată mecanic de hiperchinezia compensatorie a segmentelor bazale și medii ale LV la pacienții cu infarcte distale ale LAD. Factorii predictivi ai mișcării îmbunătățite a peretelui regional în zonele neinfarctante sunt absența bolii multivasculare, sexul feminin și fluxul mai mare în vasul legat de infarct. Forța contractilă crescută a miocardului bazal determină regurgitarea mitrală prin efectul Venturi. Aceasta duce la creșterea OTO, ceea ce duce la o reducere suplimentară a debitului LV în contextul hipoperfuziei sistemice deja prezente.
Acest OTO crescut al LVO în contextul unui miocard transmural deteriorat formează un cadru perfect în care există o presiune intraventriculară end-sistolică crescută, care induce o tensiune crescută a peretelui zonei infarctului slăbit, necrotic. Această complicație frecvent fatală apare cel mai adesea la femei, la pacienții mai în vârstă (>70 de ani) și la cei fără IM anterior.
Prezentarea clinică a LVOTO
Pacienții afectați pot avea simptomele obișnuite ale unui complex de simptome autonome crescute, cum ar fi detresă respiratorie, diaforeză și extremități reci și umede, pe lângă semnele și simptomele tipice ale IMA.
Acești pacienți pot evolua rapid spre șoc cardiogen cu ortopnee severă, dispnee și oligurie și pot avea starea mentală alterată din cauza hipoperfuziei cerebrale. Pacienții se pot prezenta cu un nou suflu de ejecție sistolică, un nou suflu holosistolic care iradiază spre axilă ca urmare a mișcării anterioare sistolice (SAM) a frunzei mitrale. Pot fi prezente, de asemenea, un galop S3, raluri pulmonare, hipotensiune și tahicardie; aceste din urmă semne fizice pot fi complet absente în contextul acut.
Ecocardiografia transtoracică sau transesofagiană (ETT/TEE) este testul de diagnostic de elecție și poate caracteriza cu acuratețe segmentul hiperchinetic, LVOTO și SAM a frunzei mitrale.
Tratamentul LVOTO
Considerați reducerea hipercontractilității miocardului prin utilizarea atentă a adaosului de betablocante. De asemenea, resuscitarea lentă a volumului prin creșterea postîncărcării (fenileferină) poate crește preîncărcarea și reduce LVOTO și SAM. Cel mai bine ar fi să se evite medicamentele de augmentare a postîncărcării. Vasodilatatoarele, inotropele și pompele cu balon ar trebui, de asemenea, evitate deoarece pot crește LVOTO.
Insuficiența VD
Frecvent întâlnită în cadrul unui IM inferior, disfuncția ușoară a VD post IM este frecventă; cu toate acestea, în cele mai multe cazuri, efectul asupra LV este minim.
Hipochinezia semnificativă a VD apare atunci când există ocluzie proximală a arterei corinare drepte cu puține colaterale din circulația stângă. Se postulează că, deoarece VD este cu pereți subțiri și are o cerere mai mică de oxigen, există perfuzie coronariană în timpul întregului ciclu cardiac; prin urmare, infarctul ireversibil extins este rar.
Insuficiența tipică a VD se poate prezenta cu hipotensiune (datorită lipsei preîncărcării LV) și distensie venoasă jugulară cu un câmp pulmonar liber. Deși descrisă în mod clasic în cadrul insuficienței VD, această triadă este rar întâlnită în forma sa pură în mediul clinic. Majoritatea pacienților se prezintă cu șoc cardiogen sau insuficiență ventriculară inferioară cu simptome autonome asociate.
Prezența presiunii venoase jugulare peste 8 cm H2O și a semnului Kussmaul este foarte sensibilă și specifică pentru insuficiența severă a VD.
Ocazional, șuntul de la dreapta la stânga prin intermediul unui foramen ovale patent determină hipoxemie persistentă. Țineți cont de această complicație particulară.
Electrocardiografic, pacienții se prezintă cu supradenivelare ST inferioară în asociere cu supradenivelare ST în derivația V4R. Radiografia toracică apare de obicei fadă, fără distensie venoasă a lobului superior.
Diagnosticarea insuficienței VD
Ecocardiografia bidimensională (2D) și imagistica prin rezonanță magnetică (IRM) sunt foarte utile. De cele mai multe ori, ecocardiografia va ajuta la stabilirea diagnosticului.
Constatările cateterismuluiwan-Ganz sunt de obicei sugestive pentru presiuni ridicate ale RA cu o PCWP scăzută.
Tratamentul insuficienței VD
Resuscitarea volumului pentru a menține PCWP la sau în jurul a 15 mmHg ar putea ajuta la temporizarea prin creșterea tranzitorie a preîncărcării VD. Deși tratamentul definitiv implică restabilirea circulației coronariene. În cazuri rare de insuficiență severă a VD, ar trebui să se ia în considerare suportul circulator mecanic cu ajutorul dispozitivelor de asistență a VD (AD), fie temporar, fie ca terapie de tranziție în cazul unei implicări biventriculare extinse.