Proprietăți fizice ale compușilor ionici față de cei covalenți
În general, compușii ionici și covalenți au proprietăți fizice diferite. Compușii ionici formează solide cristaline dure care se topesc la temperaturi ridicate și sunt rezistente la evaporare. Aceste proprietăți derivă din structura internă caracteristică a unui solid ionic, ilustrată schematic în partea (a) din figura 2.7.4, care arată rețeaua tridimensională de ioni alternativ pozitivi și negativi ținuți împreună prin atracții electrostatice puternice. În schimb, așa cum este ilustrat în partea (b) din figura 9.5.1, majoritatea compușilor covalenți constau din molecule discrete ținute împreună prin forțe intermoleculare relativ slabe (forțele dintre molecule), chiar dacă atomii din fiecare moleculă sunt ținuți împreună prin legături covalente intramoleculare puternice (forțele din interiorul moleculei). Substanțele covalente pot fi gaze, lichide sau solide la temperatura și presiunea camerei, în funcție de puterea interacțiunilor intermoleculare. Solidele moleculare covalente tind să formeze cristale moi care se topesc la temperaturi scăzute și se evaporă ușor.
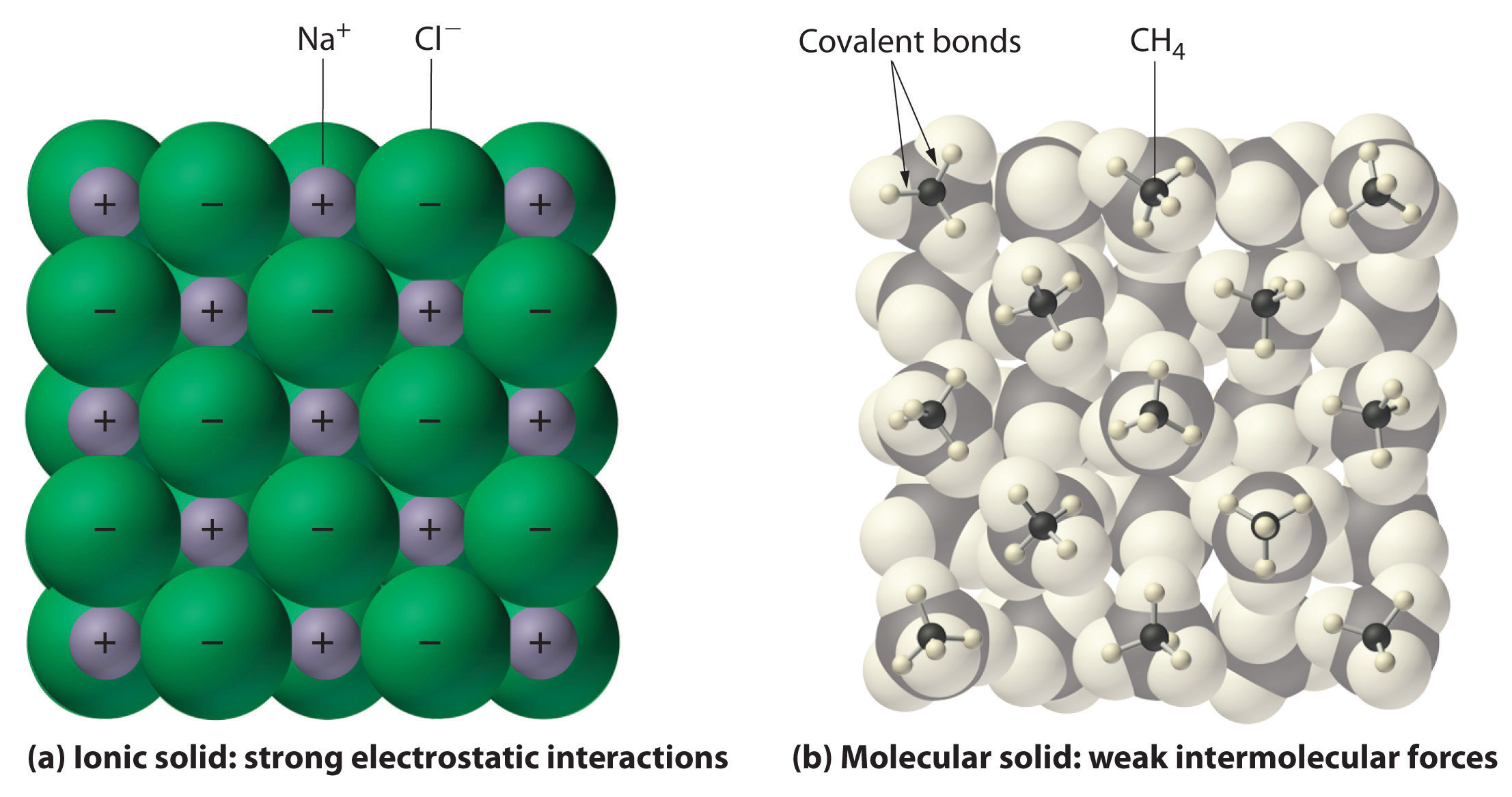
Figura 9.5.1: Interacțiuni în solidele ionice și covalente. (a) Ionii încărcați pozitiv și negativ dintr-un solid ionic, cum ar fi clorura de sodiu (NaCl), sunt ținuți împreună prin interacțiuni electrostatice puternice. (b) În această reprezentare a împachetării moleculelor de metan (\(CH_4\)) în metanul solid, un solid molecular prototipic, moleculele de metan sunt ținute împreună în solid doar prin forțe intermoleculare relativ slabe, chiar dacă atomii din fiecare moleculă de metan sunt ținuți împreună prin legături covalente puternice.
Hidrocarburi
Solidele moleculare constau din atomi sau molecule ținute unele de altele prin interacțiuni dipol-dipol, forțe de dispersie London sau legături de hidrogen, sau orice combinație a acestora. Aranjamentul moleculelor în benzenul solid este următorul:

Figura 9.5.2: Structura benzenului solid. În benzenul solid, moleculele nu sunt dispuse cu planurile lor paralele între ele, ci în unghiuri de 90°.
Pentru că interacțiunile intermoleculare într-un solid molecular sunt relativ slabe în comparație cu legăturile ionice și covalente, solidele moleculare tind să fie moi, cu punct de topire scăzut și ușor de vaporizat (\(ΔH_{fus}\) și \(ΔH_{vap}\) sunt scăzute). Pentru substanțe similare, intensitatea forțelor de dispersie London crește ușor odată cu creșterea masei moleculare. De exemplu, punctele de topire ale benzenului (C6H6), naftalinei (C10H8) și antracenului (C14H10), cu unul, două și trei inele aromatice fuzionate, sunt de 5,5°C, 80,2°C și, respectiv, 215°C. Entalpiile de fuziune cresc, de asemenea, lin în cadrul seriei: benzen (9,95 kJ/mol) < naftalină (19,1 kJ/mol) < antracenă (28,8 kJ/mol). Cu toate acestea, dacă moleculele au forme care nu se pot împacheta eficient în cristal, atunci punctele de topire și entalpiile de fuziune tind să fie neașteptat de scăzute, deoarece moleculele nu se pot aranja pentru a optimiza interacțiunile intermoleculare. Astfel, toluenul (C6H5CH3) și m-xilena au puncte de topire de -95°C și, respectiv, -48°C, care sunt semnificativ mai mici decât punctul de topire al analogului mai ușor, dar mai simetric, benzenul.
Cauciu cu autovindecare este un exemplu de solid molecular cu potențial pentru aplicații comerciale semnificative. Materialul se poate întinde, dar, atunci când este rupt în bucăți, se poate lega din nou laolaltă prin restabilirea rețelei sale de legături de hidrogen, fără a da niciun semn de slăbiciune. Printre alte aplicații, este studiat pentru utilizarea sa în adezivi și în anvelope de bicicletă care se vor autovindeca.

Figura 9.5.3: Toluen și m-xilenă. Grupările metil atașate la inelul fenil din toluen și m-xilenă împiedică inelele să se împacheteze împreună la fel de bine ca în benzenul solid.
.