24-6C Reacții ale compușilor nitro
Compușii nitro sunt destul de instabili din punct de vedere termodinamic; de exemplu, căldura de descompunere a nitrometanului, conform următoarei stoichiometrii, este \(67.4 \: \text{kcal mol}^{-1}\).
\
Se profită de energiile considerabile și de vitezele rapide ale unor astfel de reacții în utilizarea comercială a compușilor nitro ca explozibili. În cazul unor compuși nitro, cum ar fi TNT, există un avantaj suplimentar de sensibilitate scăzută la șocuri.
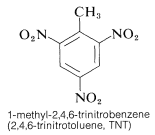
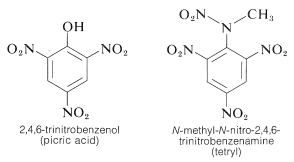
TNT nu este detonat ușor prin simplu impact și chiar arde fără să explodeze. Cu toate acestea, odată ce începe detonarea, descompunerea se propagă rapid. Caracteristicile de stabilitate rezonabilă la manipulare și potențial termodinamic ridicat fac compușii nitro deosebit de utili. Alți compuși polinitro care sunt utili ca explozibili includ PETN (secțiunea 17-3C), ciclonitul (secțiunea 16-4C), acidul picric și tetrilul:
O caracteristică importantă a compușilor polinitro aromatici este capacitatea lor de a forma complecși de „transfer de sarcină” cu hidrocarburile aromatice, în special cu cele care sunt substituite cu grupe alchil. Complexele de 2,4,6-trinitrobenzenol (acid picric) și hidrocarburi aromatice sunt adesea solide cristaline, care sunt utile pentru separarea, purificarea și identificarea hidrocarburilor aromatice. Aceste substanțe sunt denumite „picrați de hidrocarburi”, dar denumirea este înșelătoare, deoarece nu sunt de fapt săruri. În plus, se formează complexe similare între hidrocarburile aromatice și trinitrobenzen, ceea ce demonstrează că grupele nitro, mai degrabă decât grupa hidroxil, sunt esențiale pentru formarea complexului. Legătura din acești complecși se aseamănă cu cea din complecșii \(\pi\) ai halogenilor cu alchene și benzen (secțiunile 22-4D și 10-3C) și rezultă din forțele de atracție dintre substanțele bogate în electroni și cele sărace în electroni. Denumirea descriptivă – complex cu transfer de sarcină – sugerează că complexul are structuri VB care implică transferul unui electron de la molecula donatoare (bogată în electroni) la molecula acceptoare (săracă în electroni). Denumirea de complex \(\pi\) este, de asemenea, utilizată deoarece, de obicei, cel puțin o componentă a complexului are un sistem de \(\pi\)-electroni. Complecșii cu transfer de sarcină sau \(\pi\) dintre compușii polinitro și hidrocarburile aromatice par să dea structuri de tip sandwich cu inelele aromatice în planuri paralele, deși nu neapărat centrate exact unul peste celălalt:
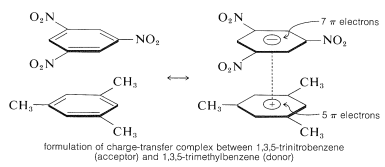
Complecșii cu transfer de sarcină sunt aproape întotdeauna mai puternic colorați decât componentele lor individuale. Un exemplu spectaculos este benzenul și tetraccianoetena, fiecare dintre ele separat fiind incoloră, dar care dau un complex portocaliu strălucitor atunci când sunt amestecate. În cazul complexelor cu transfer de sarcină este de așteptat o deplasare spre lungimi de undă mai mari de absorbție, în raport cu componentele lor, din cauza posibilității sporite de stabilizare a stării excitate prin delocalizarea electronilor care implică ambele componente.
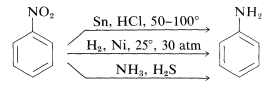
Reducerea compușilor nitro are loc cu ușurință cu o varietate de agenți reducători și astfel de reduceri permit o sinteză deosebit de utilă a aminelor aromatice (secțiunea 23-12B):
Reducerea unui compus nitro la o amină necesită șase echivalenți de agent reducător:
\
Nu ne-am aștepta ca o astfel de reducere să aibă loc într-o singură etapă. Într-adevăr, reducerea este etapizată și se desfășoară printr-un șir de intermediari, care, în cazul agenților reducători puternici în soluție acidă, au cel mult o existență trecătoare. Intermediarii formați succesiv din \(\ce{RNO_2}\) prin creșteri de doi echivalenți de agent reducător sunt compuși nitrozați, \(\ce{R-N=O}\), și azanoli substituiți cu \(\ce{N}\ (hidroxilamine), \(\ce{RNHOH}\):
\}}{\longrightarrow}}}. \ce{RN=O} \overset{2 \left}{\longrightarrow} \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}\]
Astfel, azanolii \(\ce{N}\)-aril-substituiți pot fi obținuți direct din compușii nitro corespunzători cu zinc și soluție de clorură de amoniu. Cu toate acestea, cu zinc și acid clorhidric se obține amina:
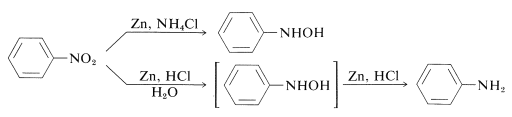
Diferența dintre aceste reacții constă în ratele de reducere asociate cu aciditatea soluției. Clorura de amoniu este un acid mult mai slab decât \(\ce{HCl}\); pH-ul soluțiilor de clorură de amoniu este în jur de 6.
Oxidarea \(\ce{N}\)-arilazanilor în condiții controlate produce compuși nitrozați. Această reacție nu este diferită de oxidarea alcoolilor în cetone (secțiunea 15-6B):
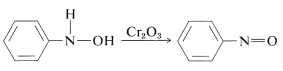
Reducerea compușilor aril nitro cu agenți reducători mai puțin puternici, în special în medii alcaline, dă ceea ce poate părea a fi un conglomerat misterios de produși de reducere bimoleculară. De exemplu, cu nitrobenzen,
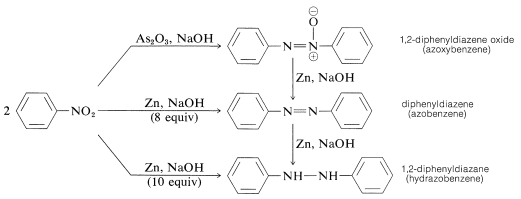
Toate aceste substanțe pot fi reduse la benzenamină cu staniu și acid clorhidric. Ca urmare, fiecare ar putea fi, dar nu neapărat este, un intermediar în reducerea compușilor nitro la amine. Formarea produselor de reducere bimoleculară este rezultatul unor reacții induse de baze între compușii nitroși și azanoli sau amine și, eventual, reducerea ulterioară a substanțelor produse inițial.
Câțiva derivați de polinitrobenzen au utilizări erbicide importante. Exemple sunt \(\ce{N}^3\), \(\ce{N}^3\)-dietil-6-trifluorometil-2,4-dinitro-1,3-benzendiamină și \(\ce{N}\),\(\ce{N}\),\(\ce{N}\)-dipropil-4-trifluorometil-2,6-dinitrobenzenamina:
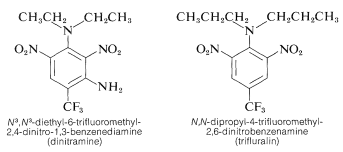
Aceste substanțe, atunci când sunt amestecate cu solul, ucid răsadurile de buruieni, dar nu și plantele de cultură, cum ar fi bumbacul, soia și arahidele. Activitatea este ridicată; în mod normal, pentru o bună combatere a buruienilor este nevoie doar de aproximativ \(0,08 \: \text{g m}^{-2}\).
Cele mai importante reacții ale nitroalcanilor sunt cele care implică hidrogenii \(\alpha\) din compușii primari și secundari. De exemplu, nitrometanul este suficient de acid pentru a se dizolva în soluții apoase de hidroxid. Anionul astfel produs are o structură electronică analogă cu cea a anionului nitrat:
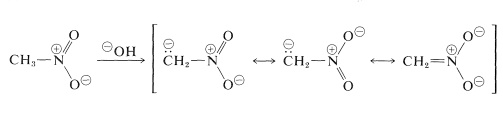
O proprietate interesantă a acestui ion este că, atunci când soluțiile sale sunt acidificate, se produce un izomer instabil, destul de puternic acid, al nitrometanului (numit forma aci), care revine lent la forma nitro, mai stabilă:
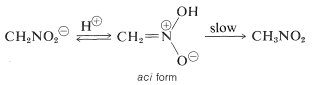
Modificări similare au loc la acidificarea sării enol a unui compus carbonilic, principala diferență fiind durata de viață mult mai mare a compusului aci-nitro în comparație cu cea a unui enol al unei cetone simple (a se vedea secțiunea 17-1B).
Compușii nitro primari și secundari suferă adiții aldol și adiții Michael cu compuși carbonilici adecvați și catalizatori bazici:
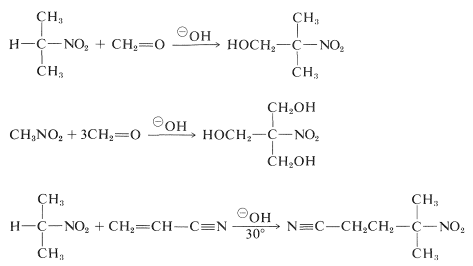
Din păcate, reacțiile de alchilare analoge cu alchilarea catalizată de baze a compușilor carbonilici nu sunt, în general, utile pentru sinteza compușilor nitro superiori, deoarece \(\ce{C}\)-alchilarea bazelor conjugate ale compușilor nitro primari este mai lentă decât \(\ce{O}\)-alchilarea \(\ce{O}\).