La maggior parte dei trattamenti medici sono progettati per il “paziente medio” come un approccio a taglia unica, che può avere successo per alcuni pazienti ma non per altri. La medicina di precisione, a volte conosciuta come “medicina personalizzata” è un approccio innovativo alla prevenzione e al trattamento delle malattie che tiene conto delle differenze nei geni, negli ambienti e negli stili di vita delle persone. L’obiettivo della medicina di precisione è quello di indirizzare i trattamenti giusti ai pazienti giusti al momento giusto.
I progressi nella medicina di precisione hanno già portato a nuove potenti scoperte e trattamenti approvati dalla FDA che sono adattati alle caratteristiche specifiche degli individui, come il patrimonio genetico di una persona, o il profilo genetico del tumore di un individuo. I pazienti con una varietà di tumori si sottopongono abitualmente a test molecolari come parte della cura del paziente, permettendo ai medici di selezionare trattamenti che migliorano le possibilità di sopravvivenza e riducono l’esposizione agli effetti avversi.
- Test di sequenziamento di prossima generazione (NGS)
- Il ruolo della FDA nel progresso della medicina di precisione
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Guida ai database clinici
- Analytical Validation Guidance
- Piattaforma bioinformatica della FDA
- Domande?
- Cosa dicono i funzionari della FDA
- Linee guida finali della FDA
- Rapporti e documenti di discussione
- Riunioni passate
Test di sequenziamento di prossima generazione (NGS)
La cura di precisione sarà buona solo quanto i test che guidano diagnosi e trattamento. I test di Next Generation Sequencing (NGS) sono in grado di identificare o “sequenziare” rapidamente ampie sezioni del genoma di una persona e sono importanti progressi nelle applicazioni cliniche della medicina di precisione.
Pazienti, medici e ricercatori possono usare questi test per trovare varianti genetiche che li aiutino a diagnosticare, trattare e comprendere meglio le malattie umane.
Il ruolo della FDA nel progresso della medicina di precisione
La FDA sta lavorando per garantire l’accuratezza dei test NGS, in modo che i pazienti e i medici possano ricevere risultati accurati e clinicamente significativi.
La grande quantità di informazioni generate attraverso NGS pone nuove questioni normative per la FDA. Mentre gli attuali approcci normativi sono appropriati per la diagnostica convenzionale che rileva una singola malattia o condizione (come la glicemia o i livelli di colesterolo), queste nuove tecniche di sequenziamento contengono l’equivalente di milioni di test in uno. A causa di questo, la FDA ha lavorato con le parti interessate nell’industria, nei laboratori, nel mondo accademico e nelle società professionali e di pazienti per sviluppare un approccio normativo flessibile per accogliere questa tecnologia in rapida evoluzione che sfrutta gli standard di consenso, i dati crowd-sourced e la tecnologia di calcolo open-source all’avanguardia per sostenere lo sviluppo dei test NGS. Questo approccio consentirà l’innovazione nei test e nella ricerca e accelererà l’accesso a test genetici accurati e affidabili.
Streamlining FDA’s Regulatory Oversight of NGS Tests
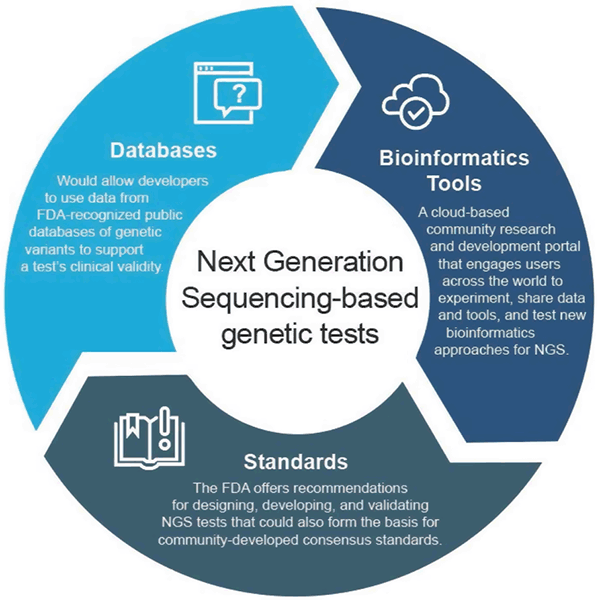
Nell’aprile 2018, la FDA ha pubblicato due orientamenti finali che raccomandano approcci per semplificare la presentazione e la revisione dei dati a sostegno della validità clinica e analitica dei test basati su NGS. Queste raccomandazioni sono destinate a fornire un approccio di supervisione normativa efficiente e flessibile: man mano che la tecnologia avanza, gli standard possono evolvere rapidamente ed essere utilizzati per impostare metriche appropriate per campi in rapida crescita come NGS. Allo stesso modo, man mano che l’evidenza clinica migliora, nuove affermazioni potrebbero essere supportate. Questo approccio adattivo favorirebbe l’innovazione tra gli sviluppatori di test e migliorerebbe l’accesso dei pazienti a queste nuove tecnologie.
Guida ai database clinici
La guida finale “Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” permette agli sviluppatori di usare i dati dai database pubblici riconosciuti dalla FDA delle varianti genetiche per aiutare a sostenere la validità clinica di un test e delinea come gli amministratori dei database possono chiedere il riconoscimento dei loro database se soddisfano certe raccomandazioni di qualità. Questo approccio incentiva la condivisione dei dati e fornisce un percorso più efficiente verso il mercato.
Più informazioni sul riconoscimento dei database sono disponibili sulla pagina web della FDA Recognition of Public Human Genetic Variants Databases.
Analytical Validation Guidance
La guida finale “Considerations for Design, sviluppo, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases” offre raccomandazioni per progettare, sviluppare e validare i test NGS. La guida incoraggia anche l’impegno della comunità nello sviluppo di standard relativi a NGS da parte delle organizzazioni di sviluppo degli standard (SDO) poiché gli standard possono evolvere più rapidamente con i cambiamenti nella tecnologia e nella conoscenza e possono quindi essere utilizzati per impostare metriche appropriate come soglie di prestazioni specifiche per campi in rapida crescita come NGS.
Piattaforma bioinformatica della FDA
La FDA ha creato precisionFDA, un portale di ricerca e sviluppo della comunità basato sul cloud che impegna gli utenti di tutto il mondo a condividere dati e strumenti per testare, pilotare e convalidare approcci bioinformatici esistenti e nuovi al trattamento NGS. Gli individui e le organizzazioni della comunità genomica possono trovare maggiori informazioni e iscriversi per partecipare a http://precision.fda.gov.
Domande?
Contattateci per qualsiasi domanda sugli sforzi della medicina di precisione della FDA a [email protected].
Cosa dicono i funzionari della FDA
- La FDA finalizza le linee guida per accelerare lo sviluppo di test affidabili, test affidabili e vantaggiosi basati sul sequenziamento di prossima generazione
Linee guida finali della FDA
- Uso dei database pubblici di varianti genetiche umane per supportare la validità clinica dei test genetici e genomici in vitro – Guida per le parti interessate e il personale della Food and Drug Administration (PDF – 444KB)
- Considerazioni sulla progettazione, Development, e la convalida analitica della diagnostica in vitro (IVD) basata sul sequenziamento di nuova generazione (NGS) destinata ad aiutare nella diagnosi di sospette malattie della linea germinale – Guida per le parti interessate e il personale della Food and Drug Administration (PDF – 869KB)
Rapporti e documenti di discussione
- Ottimizzare la supervisione normativa della FDA sui test diagnostici di sequenziamento di prossima generazione (PDF – 424KB)
- Rapporto: Paving the Way for Personalized Medicine (Archiviato)
Riunioni passate
- 07/27/16: Webinar – Bozze delle linee guida sul sequenziamento di prossima generazione (NGS): Implicazioni per pazienti e fornitori
- 07/27/16: Webinar – Bozze delle linee guida sul sequenziamento di prossima generazione (NGS): Aspetti tecnici e normativi
- 11/13/2015: Workshop pubblico – Uso delle banche dati per stabilire la rilevanza clinica delle varianti genetiche umane
- 11/12/2015: Approccio basato su standard alla valutazione delle prestazioni analitiche dei test diagnostici in vitro di sequenziamento di nuova generazione
- 02/20/2015: Ottimizzazione della supervisione normativa della FDA sui test diagnostici di sequenziamento di prossima generazione Workshop pubblico
.