- trans-Cinnamaldeide Proprietà chimiche, usi, produzione
- Panoramica
- Farmacocinetica
- Applicazioni
- Tossicità
- Proprietà chimiche
- Proprietà chimiche
- Proprietà chimiche
- Definizione
- Riferimento(i) di sintesi
- Descrizione generale
- Aria &Reazioni con l’acqua
- Profilo di reattività
- Rischio di incendio
- Potenziale esposizione
- Spedizione
- Incompatibilità
- Smaltimento dei rifiuti
trans-Cinnamaldeide Proprietà chimiche, usi, produzione
Panoramica
La cinnamaldeide, un’antica sostanza aromatizzante derivata dagli alberi di cannella e da altre specie del genere Cinnamomum, ha ora attirato un interesse crescente per la sua capacità di prevenire lo sviluppo del diabete e le sue complicazioni. Come liquido giallo e viscoso, la cinnamaldeide costituisce il 98% dell’olio essenziale della corteccia di cannella, ed è stata isolata per la prima volta da Dumas e Péligot e poi sintetizzata in laboratorio dal chimico italiano Luigi Chiozza (1828-1889) nel 1854. Nel 2007, Subash et al. hanno riportato per la prima volta un effetto ipoglicemico e ipolipemizzante della cinnamaldeide sui ratti Wistar maschi diabetici indotti da streptozotocina (STZ). La cinnamaldeide è stata poi ampiamente studiata in modelli animali di diabete e obesità.
La cassia o cannella cinese è una spezia ampiamente utilizzata estratta dalla corteccia interna dell’albero di cannella. La Cassia è stata usata per migliaia di anni per scopi medicinali ed è considerata una delle 50 erbe fondamentali nella medicina tradizionale cinese. Diverse parti della pianta di Cassia sono utilizzate per scopi medicinali, tra cui la radice, la corteccia, le foglie e i fiori. Gli estratti di cannella sono stati segnalati per avere vari effetti benefici, tra cui effetti antiallergici, antimicrobici, antivirali, antiossidativi, gastroprotettivi, antiangiogenici e anti-Alzheimer, nonché attività biologiche simili all’insulina. Gli estratti di cannella contengono diversi composti attivi, tra cui oli essenziali (cinnamaldeide e aldeide cinnamilica), tannini, muco e carboidrati. È interessante notare che la cinnamaldeide, conosciuta anche come aldeide cinnamica, mostra effetti anti-obesità riducendo l’accumulo di lipidi e downregolando il peroxisome proliferator-activated receptor-γ, CCAAT/enhancer-binding protein α, e sterol regulatory element-binding protein 1. Inoltre, la cinnamaldeide inibisce l’attivazione microgliale indotta dal lipopolisaccaride puntando la low-density lipoprotein receptor-related protein-1. È stato anche riportato che la cinnamaldeide ha effetti antimutageni nelle cellule tumorali.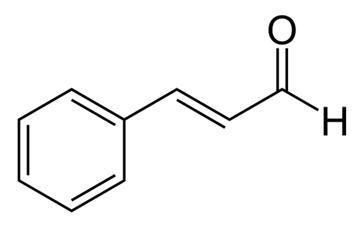
Figura 1 la struttura chimica della cinnamaldeide;
Farmacocinetica
La cinnamaldeide esiste naturalmente nella forma trans-cinnamaldeide. In un esperimento eseguito da Zhao et al. valuta la farmacocinetica della cinnamaldeide nei ratti utilizzando un approccio sensibile relativo della gascromatografia-spettrometria di massa (GC-MS) tramite somministrazione orale (500 mg/kg) e iniezione intravenosa (i.v., 20 mg/kg). I risultati rivelano che l’AUC0-t della cinnamaldeide per via orale e per via endovenosa sono 1984 ± 531 e 355 ± 53 ng h/ml, rispettivamente. Il T1/2 e il Tmax della cinnamaldeide sono più lunghi per la somministrazione orale (6,7 ± 1,5 h e 1,6 ± 0,5 h) che per la somministrazione i.v. (1,7 ± 0,3 h e 0,033 h). La Cmax è 249±36 ng/ml per la somministrazione orale e 547±142 ng/ml per la somministrazione i.v., rispettivamente. I risultati indicano che la biodisponibilità della cinnamaldeide è migliorata meglio con la somministrazione i.v. che con la somministrazione orale.
Inoltre, gli autori dimostrano che la Cmax e l’AUC0-t sono proporzionali alla dose (da 125 a 500 mg), mentre la Tmax e il tempo di residenza medio non cambiano in risposta all’aumento della dose. Dato che la cinnamaldeide e l’alcol cinnamilico potrebbero trasformarsi l’uno nell’altro nei ratti, gli autori analizzano anche le proprietà farmacocinetiche dell’alcol cinnamilico nel plasma dei ratti. I dati farmacocinetici dell’alcool cinnamilico sono 1105±337 ng-h/ml per AUC0-t, 6,7±2,8 h per T1/2, 1,5±0,7 h per Tmax, e 221±66 ng/ml per Cmax, al dosaggio orale di 500 mg/kg. È interessante notare che il cinnamato di metile è stato scoperto anche nei metaboliti. Per la proprietà farmacocinetica del cinnamato di metile, i lettori interessati sono invitati a consultare l’articolo di Zhao et al. In breve, la cinnamaldeide è ben distribuita in tutto il corpo dopo l’assorbimento. La cinnamaldeide ha la possibilità di trasformarsi in alcol cinnamilico e può anche essere ossidata in acido cinnamico dopo essere entrata nel corpo. Per comprendere appieno le proprietà farmacocinetiche della cinnamaldeide, anche il cinnamato di metile e l’alcol cinnamilico dovrebbero essere determinati nel plasma. Tuttavia, l’instabilità della cinnamaldeide mette in dubbio che la bioattività della cinnamaldeide sia probabilmente dovuta alla somma dei suoi metaboliti. Pertanto, sono attesi ulteriori tentativi per affrontare le potenziali preoccupazioni. Inoltre, lo SME-cinnamaldeide di recente sviluppo con una migliore biodisponibilità ha anche bisogno di ulteriori indagini sull’effetto antidiabetico.
Applicazioni
Gli estratti di cannella hanno vari effetti benefici tra cui effetti antiallergici, antimicrobici, antivirali, antiossidativi, gastroprotettivi, antiangiogenici e anti-Alzheimer e attività biologiche simili all’insulina. La cinnamaldeide mostra effetti anti-obesità riducendo l’accumulo di lipidi e abbassando la regolazione del perossisoma proliferator-activated receptor-γ, CCAAT/enhancer-binding protein α, e sterol regulatory element-binding protein 1. Inoltre, la cinnamaldeide inibisce l’attivazione microgliale indotta dal lipopolisaccaride prendendo di mira la low-density lipoprotein receptor-related protein-1. È stato anche riportato che la cinnamaldeide ha effetti antimutageni nelle cellule tumorali. L’effetto della cinnamaldeide sul trattamento del cancro e del diabete è evidenziato di seguito:
Anticancro
Kwon et al. hanno riportato per la prima volta che gli estratti di cannella inducono in vitro e in vivo la morte delle cellule di melanoma attraverso l’inibizione di NF-κB e AP-1. Uno studio successivo ha dimostrato che l’HCA è il principale composto antitumorale trovato negli estratti di cannella, esercitando i suoi effetti inibitori della crescita in 29 tipi di cellule tumorali umane in vitro e in xenotrapianti di tumori umani SW620 in vivo.
Altri gruppi di ricerca hanno anche riportato effetti antitumorali degli estratti di cannella. Essi inibiscono le cellule tumorali del melanoma inducendo l’espressione di fattori pro-angiogenici; hanno anche migliorato le attività antitumorali delle cellule T CD8 aumentando la loro attività citolitica. Gli estratti di cannella inibiscono anche il fattore di crescita endoteliale vascolare, che è stato scoperto dallo screening dei composti per la loro attività inibitoria contro VEGFR2. La maggior parte degli effetti antitumorali degli estratti di cannella può essere attribuita alle cinnamaldeidi, il componente principale dell’olio essenziale, responsabile del sapore e dell’aroma della cannella intera. È stato riportato che le cinnamaldeidi hanno inibito la proliferazione delle cellule tumorali inibendo la ciclina D1 in diversi tipi di tumori. Le cinnamaldeidi inducono anche l’apoptosi generando specie reattive dell’ossigeno nelle cellule leucemiche HL-60 e attraverso l’attivazione delle proteine pro-apoptotiche della famiglia Bcl-2 e la via di segnalazione MAPK nelle cellule di epatoma umano. Inoltre, le cinnamaldeidi dimeriche derivate dall’HCA hanno mostrato maggiori effetti antitumorali rispetto alle cinnamaldeidi monomeriche, inducendo apoptosi e arresto del ciclo cellulare. Inoltre, una serie di studi ha rivelato che gli effetti antitumorali dell’HCA e dei suoi derivati sono mediati attraverso diversi meccanismi molecolari. Uno studio recente ha dimostrato che i polifenoli con un’impalcatura di cinnamaldeide hanno innescato l’arresto del ciclo cellulare nella fase G2/M e la morte cellulare apoptotica nelle cellule di cancro ovarico umano resistenti al cisplatino, suggerendo che i composti di cinnamaldeide potrebbero essere efficaci nelle chemioterapie combinate per i pazienti con cancro. Nel complesso, i meccanismi molecolari alla base degli effetti anticancro e antimetastatici delle cinnamaldeidi sono diversi, suggerendo che la cinnamaldeide è un composto multitargeting. La risposta differenziale dei vari tumori ai diversi derivati della cinnamaldeide deve essere valutata per permettere la selezione del composto più efficace per ogni tipo di cancro.
Anti-diabete
Studi emergenti sono stati effettuati negli ultimi decenni per valutare il suo ruolo benefico nella gestione del diabete e delle sue complicazioni. È stato dimostrato che la somministrazione orale di cinnamaldeide da 20 mg/kg di peso corporeo a 40 mg/kg-BW al giorno per una durata da 21 a 60 giorni ha portato a un miglioramento significativo dei livelli di glucosio nel sangue e di emoglobina glicosilata, nonché della sensibilità all’insulina nei ratti diabetici indotti da STZ. E si presume che 20 mg/kg-BW sia la dose efficace per prevenire lo sviluppo del diabete negli animali. Inoltre, il trattamento con cinnamaldeide per 4 settimane aumenta i livelli di insulina nel plasma e il contenuto di glicogeno nel fegato, così come diminuisce i livelli di trigliceridi e di lipoproteina-colesterolo a bassa densità nei ratti Wistar maschi insultati con STZ e/o HFD. Inoltre, Camacho et al. hanno scoperto che la somministrazione di cinnamaldeide per 5 settimane a topi C57BL/6J alimentati con HFD ha portato significativamente a una riduzione dell’aumento della massa grassa del corpo. Tuttavia, hanno affermato che il trattamento con cinnamaldeide non ha alterato i livelli plasmatici di insulina a digiuno e il consumo di mangime. La ragione dell’incoerenza per quanto riguarda la regolazione dell’insulina potrebbe essere attribuita al fatto che il background genetico dei topi C57BL/6J è alterato in alcune strutture di produzione. Le diverse sottospecie di topi possono presentare differenze significative nei fenotipi. Inoltre, la cinnamaldeide può avere un effetto di abbassamento del glucosio attraverso il miglioramento della sensibilità all’insulina in periferia nello studio di Camacho.
La cinnamaldeide ha la capacità di migliorare i tessuti adiposi diabetici riducendo la deposizione di grasso viscerale e promuovendo la lipolisi e l’ossidazione degli acidi grassi e la termogenesi, che è associata a un’upregolazione dei geni di spesa energetica, un’inibizione di PPARγ/CEBP-α e SREBP1, un’upregolazione di HSL e PNPLA2 e MGL, un’induzione della fosforilazione di AMPK, e un aumento di Cpt1a nel WAT e Acsl4 nel BAT, nonché una stimolazione del sistema nervoso simpatico. Inoltre, la cinnamaldeide previene l’espressione dei geni infiammatori e migliora l’espressione dei GLUT negli animali diabetici. La cinnamaldeide può proteggere dal diabete migliorando la sensibilità all’insulina e l’assorbimento del glucosio attraverso la regolazione della via PI3K/IRS-1 e RBP4-GLUT4 nel tessuto muscolare scheletrico, così come la regolazione del metabolismo dei mitocondri attraverso la via PGC-1α/MEF2/GLUT4 nelle cellule C2C12. La cinnamaldeide ha anche effetti positivi sul fegato diabetico attraverso il miglioramento delle sintesi di glicogeno regolando le attività di PK e PEPCK e diminuendo il livello di RBP4 e normalizzando gli enzimi epatici aberranti, suggerendo un ruolo benefico di questo composto nel metabolismo del glucosio e nella sensibilità all’insulina nel fegato diabetico.
Effetti antimicrobici
Studi hanno confermato l’attività antimicrobica di cinnamaldeide, chiodi di garofano, timo e rosmarino contro E. coli O157:H7 e Salmonella. Wendakoon e Sakaguchi hanno riferito che il gruppo carbonile della cinnamaldeide si lega alle proteine, impedendo l’attività della decarbossilasi degli aminoacidi in Enterobacter aerogenes. Smid et al. hanno osservato il danno alla membrana citoplasmatica di Saccharomyces cerevisiae quando trattata con cinnamaldeide, portando a un’eccessiva perdita di metaboliti ed enzimi dalla cellula, e infine alla perdita di vitalità. La maggior parte degli studi ha suggerito che le modalità d’azione degli oli essenziali dipendono dal tipo di microrganismi, principalmente dalla loro struttura della parete cellulare e dalla disposizione della loro membrana esterna. Hanno osservato danni dovuti alle differenze significative nelle membrane esterne dei batteri gram-negativi e gram-positivi.
Tossicità
Ancora oggi, la cinnamaldeide è considerata un ingrediente naturale sicuro e ben tollerato nell’uomo e negli animali. Il concetto è anche ben accettato dalla FDA e dal consiglio d’Europa con il suggerimento della dose giornaliera accettabile di 1,25 mg/kg.
Tossicità acuta
La cinnamaldeide è riportata per avere l’alto margine di sicurezza, e somministrata 20 volte della dose efficace (20 mg/kg) di questo composto non ha causato segni comportamentali anormali e valori chimici del siero disturbati durante lo studio. La tossicità acuta della cinnamaldeide è bassa, con valori di dose letale mediana orale (LD50) che vanno da un minimo di 0,6 g/kg BW a un massimo di 3,4 g/kg BW in diverse specie.
Tossicità a lungo termine
I risultati di uno studio di tre mesi mostrano che il peso del corpo è ridotto nei ratti femmina esposti a 16.500 o 33.000 ppm e nei topi femmina esposti a 8200 ppm o più. Inoltre, il consumo di cibo è ridotto in tutti i gruppi di ratti esposti e nel gruppo di topi con la dose più alta. Inoltre, l’esposizione alla cinnamaldeide aumenta l’incidenza dell’iperplasia epiteliale squamosa del forestomach. Inoltre, i topi esposti alla cinnamaldeide mostrano anche una maggiore incidenza di degenerazione epiteliale olfattiva della cavità nasale. Tutti i ratti sono sopravvissuti durante lo studio di tre mesi.
Altro
La cinnamaldeide può anche mostrare effetti di citotossicità negli epatociti di ratto F344 evidenziati dall’esaurimento dei livelli di glutatione, e nelle cellule HepG2 evidenziate dall’aumento del numero di micronuclei. Behar et al. hanno studiato la potenziale tossicità di questo prodotto in cellule embrionali e polmonari umane. I risultati dimostrano che il trattamento con cinnamaldeide depolimerizza i microtubuli nei fibroblasti polmonari umani. La cinnamaldeide diminuisce anche la proliferazione e la differenziazione cellulare inibendo la crescita e la differenziazione delle cellule e alterando la morfologia e la motilità delle cellule, oltre ad aumentare le rotture del filamento di DNA e la morte cellulare. Uno studio effettuato da Olsen et al. rivela che la cinnamaldeide provoca irritazione della pelle aumentando la soglia del dolore freddo e diminuendo la soglia del dolore meccanico, nonché aumentando la temperatura della pelle e la perfusione nell’uomo.
- Zhou M, Chen Z, Shen S. Recent advanceson cinnamaldehyde. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. L’integrazione di cinnamaldeide previene l’iperfagia indotta dal digiuno, l’accumulo di lipidi e l’infiammazione nei topi alimentati con dieta ricca di grassi. BioFactors 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Diabetic osteoporosis: Una revisione del suo uso medicinale tradizionale cinese e la ricerca clinica e preclinica. Evidence-based complementary and alternative medicine : eCAM 2016;2016:3218313.
- Dumas JP, E. Ricerche di chimica organica – sull’olio di cannella, l’acido ippurico e l’acido sebacico. Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l’essence de cannelle”. Comptes rendus 1856;42:222-227.
- Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldeide-un potenziale agente antidiabetico. Phytomedicine : international journal of phytotherapy and phytopharmacology 2007;14:15-22.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013. L’estratto di cannella inibisce la degranulazione e la sintesi de novo di mediatori infiammatori nei mastociti. Allergy 68: 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006. Attività antimicrobica di oli di cannella e chiodi di garofano in condizioni di atmosfera modificata. Int J Food Microbiol 107: 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. Inibitori dell’ingresso dell’HIV tipo 1 con una nuova modalità d’azione. Antivir Chem Chemother 19: 243-255.
- Yang CH, Li RX, Chuang LY. 2012. Attività antiossidante di varie parti di Cinnamomum cassia estratte con diversi metodi di estrazione. Molecole 17: 7294-7304.
- Peterson DW et al. 2009. L’estratto di cannella inibisce l’aggregazione tau associata alla malattia di Alzheimer in vitro. J Alzheimers Dis 17: 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012. In vivo e in vitro effetti antidiabetici di estratto acquoso di cannella e cannella polifenolo-enhanced matrice alimentare. Food Chem 135: 2994-3002.
- Kim JE et al. 2015a. Un nuovo prodotto naturale legato alla cannella con attività Pim-1 inibisce la leucemia e il cancro della pelle. Cancer Res 75: 2716-2728.
- Hwang H et al. 2011. 2′-Hydroxycinnamaldehyde ha come obiettivo la proteina-1 legata al recettore delle lipoproteine a bassa densità per inibire l’attivazione microgliale indotta dal lipopolisaccaride. J Neuroimmunol2011 230: 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. L’effetto antimutageno della vanillina e della cinnamaldeide sulla mutazione spontanea in Salmonella TA104 è dovuto a una riduzione delle mutazioni nei siti GC ma non AT. Mutat Res 480: 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. Progressi nella ricerca degli effetti farmacologici della trans-cinnamaldeide. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Studio farmacocinetico della cinnamaldeide nei ratti tramite gc-ms dopo somministrazione orale ed endovenosa. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al. 1998. Sintesi e citotossicità in vitro delle cinnamaldeidi alle cellule tumorali solide umane. Arch Pharm Res 21: 147-152.
- Lee CW et al. 1999. Inibizione della crescita del tumore umano da 2′-idrossi e 2′-benzoyloxycinnamaldehydes. Planta Med 65: 263-266
- Kwon HK et al. 2009. L’estratto di cannella sopprime la progressione del tumore modulando l’angiogenesi e la funzione effettrice delle cellule T CD8+. Cancer Lett 278: 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. Nuova attività inibitoria dell’angiogenesi nell’estratto di cannella blocca la chinasi VEGFR2 e la segnalazione a valle. Carcinogenesi 31: 481-488.
- Jeong HW et al. 2000. Le cinnamaldeidi inibiscono la chinasi 4-ciclina D1 dipendente. Bioorg Med Chem Lett 10: 1819-1822.
- Ka H et al. 2003. La cinnamaldeide induce l’apoptosi attraverso la transizione di permeabilità mitocondriale mediata dai ROS nelle cellule di leucemia promielocitica umana HL-60. Cancer Lett 196: 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. L’apoptosi indotta dalla cinnamaldeide nelle cellule PLC/PRF/5 umane attraverso l’attivazione delle proteine proapoptotiche della famiglia Bcl-2 e il percorso MAPK. Life Sci 77: 938-951.
- Shin DS et al. 2006. Sintesi e valutazione biologica di cinnamaldeidi dimeriche come potenti agenti antitumorali. Bioorg Med Chem 14: 2498-2506.
- Shin SY et al. 2014. Polifenoli con impalcatura cinnamaldeide che mostrano effetti inibitori della crescita cellulare sulle cellule di cancro ovarico A2780/Cis resistenti al cisplatino. Bioorg Med Chem 22: 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. Composizione chimica ed effetto ipoglicemico e pancreas-protettivo dell’olio essenziale di foglie di cannella indigena. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Cinnamaldeide protegge dall’ipertensione associata al diabete. Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association 2011;49:3007-3012.
- Li M, Xu Y, Zhang W. Effects of cinnamaldehyde on the expression levels of irs-1 and p85 alpha in gastrocnemius of type 2 diabetic rats. Medical Journal of Wuhan University 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Analisi Gc-ms e screening del potenziale antidiabetico, antiossidante e ipolipemizzante dell’olio di cinnamomum tamala nel diabete mellito indotto da streptozotocina nei ratti. Cardiovascular diabetology 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. Anti-obesità ed effetti anti-iperglicemici della cinnamaldeide tramite alterata secrezione di grelina e impatto funzionale sull’assunzione di cibo e svuotamento gastrico. Scientific reports 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR. Lo sfondo del ceppo di topo c57bl/6j modifica l’effetto di una mutazione in bcl2l2. G3 2012;2:99-102.
- Mekada K, Abe K, Murakami A, Nakamura S, Nakata H, Moriwaki K, Obata Y, Yoshiki A. Differenze genetiche tra ceppi c57bl/6. Animali sperimentali 2009;58:141-149.
- Kiselycznyk C, Holmes A. Tutti i topi non sono creati uguali. Frontiers in neuroscience 2011;5:10.
- Attane C, Peyot ML, Lussier R, Zhang D, Joly E, Madiraju SR, Prentki M. Secrezione insulinica differenziale di dieta ad alto contenuto di grassi alimentato c57bl/6nn e c57bl/6nj topi: Implicazioni di sfondo genetico misto in studi metabolici. PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK, Mermierd. CM, Conne. CA, Vaughanc. RA. Trans-cinnamaldeide stimola la biogenesi mitocondriale attraverso pgc-1α e pparβ/δ portando ad una maggiore espressione di glut4. Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. Effetti antidiabetici di cinnamaldeide e berberina e il loro impatto sull’espressione della proteina 4 legante il retinolo nei ratti con diabete mellito di tipo 2. Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Aumento dell’espressione p85/55/50 e diminuzione dell’attività della fosfotidilinositolo 3-chinasi nel muscolo scheletrico umano insulino-resistente. Diabete 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS. Impatto della carenza ematopoietica cicloossigenasi-1 sull’infiammazione del tessuto adiposo legata all’obesità e disturbi metabolici nei topi. Metabolismo: clinica e sperimentale 2013;62:1673-1685.
- Ohaeri OC. Effetto dell’olio di aglio sui livelli di vari enzimi nel siero e nel tessuto dei ratti diabetici streptozotocina. Bioscience rapporti 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH. Valutazione della lipocalina associata alla gelatinasi dei neutrofili (ngal) e della proteina 4 legata al retinolo in pazienti diabetici di tipo 2 con nefropatia. Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. e CORKE, H. 2007. Proprietà antibatteriche e principali componenti bioattivi del bastoncino di cannella: Attività contro i batteri patogeni di origine alimentare. J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K. e REMMAL, A. 2003. Il meccanismo di azione battericida degli oli essenziali di origano e chiodi di garofano dei loro componenti fenolici principali su Escherichia coli e Bacillus subtilis. J. Essent. Oil Res. 15, 356-362.
- KIM, H.-O., PARK, S.-W. and PARK, H.-D. 2004. Inattivazione di Escherichia coli O157:H7 da parte dell’aldeide cinnamica purificata dal germoglio di Cinnamomum cassia. Food Microbiol. 21, 105-110
- WENDAKOON, C. e SAKAGUCHI, M. 1995. Inibizione dell’attività di decarbossilasi degli aminoacidi di Enterobacter aerogenes da componenti attivi nelle spezie. J. Food Prot. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. e GORRIS, L.G.M. 1996. Azione fungicida e fungistatica dei metaboliti vegetali secondari cinnamaldeide e carvone. In Fungicidi moderni e composti antimicrobici pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. Dal diabete di tipo 2 all’attività antiossidante: Una revisione sistematica della sicurezza ed efficacia della corteccia di cannella comune e cassia. Canadian journal of physiology and pharmacology 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Effetto insulinotropico della cinnamaldeide sulla regolazione trascrizionale della piruvato chinasi, fosfoenolpiruvato carbossichinasi, e glut4 traslocazione in ratti diabetici sperimentali. Interazioni chimico-biologiche 2010;186:72-81.
- Gowder SJT. Valutazione della sicurezza dell’aroma alimentare -cinnamaldeide. Biosafety 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR. Studi di tossicologia e carcinogenesi della trans-cinnamaldeide microincapsulata nei ratti e nei topi. Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes. Toxicology in vitro: an international journal published in association with BIBRA 1996;10:37-42.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens. Mutagenesi 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribuzione, quantificazione e tossicità della cinnamaldeide nei liquidi di ricarica delle sigarette elettroniche e negli aerosol. Tobacco control 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Somatosensory and vasomotor manifestations of individual and combined stimulation of trpm8 and trpa1 using topical l-menthol and trans-cinnamaldehyde in healthy volunteers. European journal of pain 2014;18:1333-1342.
Proprietà chimiche
La trans-cinnamaldeide è il componente principale dell’olio di cassia (circa 90%) e dell’olio di corteccia di cannella dello Sri Lanka (circa 75%). Piccole quantità si trovano in molti altri oli essenziali. In natura, l’isomero trans è predominante.
La trans-cinnamaldeide è un liquido giallastro con un caratteristico odore speziato, che ricorda fortemente la cannella. Essendo un’aldeide insatura, subisce molte reazioni, di cui l’idrogenazione ad alcool cinnamico, diidrocinnamaldeide e alcool diidrocinnamico è importante. L’acido cinnamico si forma per autossidazione.
Su scala industriale, la cinnamaldeide viene preparata quasi esclusivamente per condensazione alcalina di benzaldeide e acetaldeide. L’autocondensazione dell’acetaldeide può essere evitata usando un eccesso di benzaldeide e aggiungendo lentamente l’acetaldeide.
La cinnamaldeide è usata in molte composizioni per creare note speziate e orientali (per esempio, profumi di sapone). È il componente principale dell’olio di cannella artificiale. Inoltre, è un importante intermedio nella sintesi dell’alcool cinnamico e dell’alcool diidrocinnamico.
Proprietà chimiche
LIQUIDO GIALLO CHIARO
Proprietà chimiche
Liquido oleoso combustibile, giallastro (si addensa all’esposizione all’aria). Forte odore pungente, speziato, di cannella.
Definizione
ChEBI: Lo stereoisomero E (trans) della cinnamaldeide, il capostipite della classe delle cinnamaldeidi.
Riferimento(i) di sintesi
Chemistry Letters, 12, p. 1207, 1983
Journal of the American Chemical Society, 93, p. 2080, 1971 DOI: 10.1021/ja00737a057
Tetrahedron Letters, 18, p. 1215, 1977
Descrizione generale
Liquido giallo chiaro con un odore di cannella e un sapore dolce.
Aria &Reazioni con l’acqua
Può essere sensibile all’esposizione prolungata all’aria e alla luce. Insolubile in acqua.
Profilo di reattività
La trans-cinnamaldeide è incompatibile con forti agenti ossidanti e basi forti. La trans-cinnamaldeide può anche reagire con l’idrossido di sodio.
Rischio di incendio
la trans-cinnamaldeide è combustibile.
Potenziale esposizione
Fungicida e insetticida botanico. Usato come agente antifungino, attrattore di diabrotica del mais e repellente per cani e gatti. Può essere usato sull’involucro del terreno per funghi, colture in fila, tappeto erboso e tutti i prodotti alimentari. Non elencato per l’uso nei paesi dell’UE.
Spedizione
UN1989 Aldeidi, n.a.s., Classe di pericolo: 3; Etichette: 3-Liquido infiammabile
Incompatibilità
Le aldeidi sono spesso coinvolte in reazioni di autocondensazione o polimerizzazione. Queste reazioni sono esotermiche; sono spesso catalizzate da un acido. Le aldeidi sono facilmente ossidate per dare acidi carbossilici. Gas infiammabili e/o tossici sono generati dalla combinazione di aldeidi con azo, composti diazo, ditiocarbammati, nitruri e forti agenti riducenti. Le aldeidi possono reagire con l’aria per dare dapprima acidi perossi e infine acidi carbossilici. Queste reazioni di autossidazione sono attivate dalla luce, catalizzate da sali di metalli di transizione, e sono autocatalitiche (catalizzate dai prodotti della reazione). L’aggiunta di stabilizzatori (antiossidanti) alle spedizioni di aldeidi ritarda l’autossidazione. Incompatibile con gli ossidanti (clorati, nitrati, perossidi, permanganati, perclorati, cloro, bromo, fluoro, ecc.); il contatto può causare incendi o esplosioni. Tenere lontano da materiali alcalini, basi forti, acidi forti, ossiacidi, epossidi, chetoni, coloranti azoici, caustici, borani, idrazine
Smaltimento dei rifiuti
Incenerimento. In conformità con 40CFR165, seguire le raccomandazioni per lo smaltimento di pesticidi e contenitori di pesticidi.