Tra la Neisseria umana e le specie correlate, tre specie – N. mucosa, M. catarrhalis, e K. denitrificans riducono il nitrato. Il test di riduzione del nitrato è un test critico per differenziare tra N. gonorrhoeae e K. denitrificans, in particolare quando i ceppi di K. denitrificans sembrano essere diplococchi gram-negativi in strisci colorati.
Principio
Le specie batteriche possono essere differenziate sulla base della loro capacità di ridurre il nitrato a nitrito o gas azotato. Tra le Neisseriaceae di origine umana, i ceppi di Neisseria mucosa, Moraxella catarrhalis e Kingella denitrificans riducono il nitrato. Ceppi di M. catarrhalis e K. denitrificans sono stati erroneamente identificati come N. gonorrhoeae. Il test di riduzione del nitrato permette la differenziazione tra queste specie che sono nitrato positive e N. gonorrhoeae (nitrato-negativo). La riduzione del nitrato può essere accoppiata alla respirazione anaerobica in alcune specie.
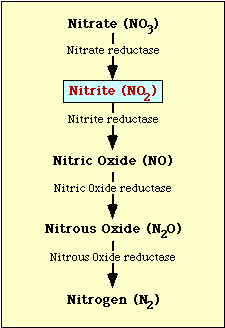
Il percorso biochimico coinvolto nella riduzione del nitrato è mostrato nella Figura 1. Il nitrato viene ridotto a nitrito che può poi essere ridotto a ossido nitrico, ossido nitroso o azoto (Figura 1).
Figura l. Percorso di riduzione del nitrato.
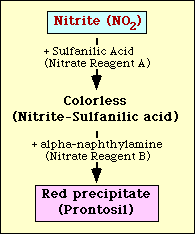
Il test di riduzione del nitrato si basa sul rilevamento di nitrito nel terreno dopo l’incubazione con un organismo. Se presente nel mezzo, il nitrito reagirà con l’acido sulfanilico (reagente nitrato A) per formare un complesso incolore (nitrito-acido sulfanilico). Questo complesso produrrà poi un precipitato rosso (prontosil) quando il reagente B del nitrato (alfa-naftilammina) viene aggiunto al test come mostrato nella figura 2.
Figura 2. Rappresentazione schematica del rilevamento del nitrito nel mezzo.
Un colore rosso sarà prodotto nel mezzo solo quando il nitrito è presente nel mezzo. La mancanza di un colore rosso nel mezzo dopo l’aggiunta di acido sulfanilico e alfa-naftilamina significa solo che il nitrito non è presente nel mezzo. Ci possono essere due spiegazioni per questa osservazione.
- Il nitrato può non essere stato ridotto; il ceppo è nitrato-negativo.
- Il nitrato può essere stato ridotto a nitrito che è stato poi completamente ridotto a ossido nitrico, ossido nitroso, o azoto che non reagisce con i reagenti che reagiscono con il nitrito; il ceppo è nitrato-positivo.
Qualunque terreno di prova che dia un risultato negativo dopo l’aggiunta dei reagenti di nitrato deve essere ulteriormente testato per determinare quale delle due interpretazioni è accurata.
Un test di riduzione dei nitrati di successo dipende dall’esecuzione del test nelle condizioni corrette.
- La reazione avverrà meglio se il terreno di base supporta la crescita dell’organismo. Tuttavia, anche se alcune specie di Neisseria non crescono bene in brodo, il test di riduzione del nitrato può essere eseguito con successo in un mezzo che non supporta la crescita inoculando il mezzo pesantemente per fornire sufficiente enzima preformato per la reazione a verificarsi.
- La reazione del nitrato si verifica solo in condizioni anaerobiche. Il mezzo contenente nitrato è dispensato in tubi per dare un basso rapporto superficie:profondità che limita la diffusione dell’ossigeno nel mezzo, per esempio, 5 ml di mezzo sono dispensati in un tubo di 13 mm di diametro. La Neisseria e le specie affini utilizzano l’ossigeno nel mezzo e producono rapidamente condizioni anaerobiche ideali per la riduzione del nitrato.
Il test di riduzione del nitrato viene eseguito in un mezzo contenente lo 0,2% di nitrato di potassio. Il mezzo viene inoculato pesantemente con una coltura pura dell’organismo sospetto e incubato a 35C a 36,5C per 48 ore in un incubatore con o senza supplemento di anidride carbonica.
La riduzione del nitrato viene rilevata con i reagenti Griess Llosvay, l’acido sulfanilico e l’alfa-naftilammina. L’acido solfanilico (reagente nitrati A) viene aggiunto alla miscela di incubazione e forma un complesso (nitrito-acido solfanilico) con qualsiasi nitrito presente nel mezzo. Quando l’alfa-naftilammina (reagente nitrico B) viene aggiunta al mezzo incubato, si formerà un precipitato rosso (prontosil) con qualsiasi complesso nitrito-acido solfanilico presente nel mezzo.
Un organismo può essere segnalato come nitrato-positivo se un colore rosso si sviluppa nel mezzo dopo i reagenti di nitrato A e B vengono aggiunti al mezzo, indicando che l’organismo ha ridotto il nitrato a nitrito.
L’assenza di un colore rosso dopo l’aggiunta di entrambi i reagenti non significa automaticamente che l’organismo non è in grado di ridurre il nitrato. I ceppi possono aver ridotto il nitrato a nitrito, e poi ridurre il nitrito completamente a gas azotati che non vengono rilevati quando i reagenti di nitrato A e B vengono aggiunti al mezzo. Se il mezzo non cambia colore dopo l’aggiunta di acido sulfanilico e alfa-naftilammina, una piccola quantità (“punta di coltello”) di polvere di zinco viene aggiunta al mezzo incubato. La polvere di zinco catalizzerà chimicamente la riduzione del nitrato a nitrito. Quindi, se il nitrato non è stato ridotto dagli organismi, cioè sono nitrato-negativi, sarà ridotto dalla polvere di zinco e si svilupperà un colore rosso nel mezzo incubato entro 15 minuti. Se non si sviluppa alcun colore nel mezzo incubato dopo l’aggiunta della polvere di zinco, gli organismi non solo hanno ridotto il nitrato a nitrito, ma hanno ridotto il nitrito a gas azotati; questi organismi sono anche nitrato-positivi.
Anche se il mezzo di nitrato viene fornito con tubi Durham invertiti per rilevare la produzione di gas, la produzione di gas non viene registrata per le specie Neisseria. Anche se alcune specie possono ridurre il nitrato oltre il nitrito a gas azotati, il gas può non accumularsi nella provetta. L’accumulo di gas dipende dalla velocità con cui viene prodotto. Quando il gas viene prodotto molto lentamente, può dissolversi nel mezzo e non accumularsi nella provetta Durham.
Requisiti del campione
Campione ottimale: Una coltura pura di un sospetto diplococco gram negativo, ossidasi-positivo (Neisseria spp. o M. catarrhalis) su agar cioccolato incubato in un’atmosfera arricchita di anidride carbonica a 35C – 36.5C per 18-24 h.
Campione non accettabile: Colture di isolati su agar cioccolato incubate in un’atmosfera arricchita di anidride carbonica a 35C a 36.5C per più di 24 ore.
Fattori compromettenti che influenzano i risultati del test:
- Il terreno di prova deve essere inoculato in modo abbastanza pesante da permettere la reazione con enzimi preformati. Un inoculo insufficiente può non permettere agli organismi di consumare ossigeno per produrre condizioni anaerobiche in cui la riduzione del nitrato può avvenire.
- Una quantità eccessiva di polvere di zinco aggiunta alla provetta incubata può provocare una riduzione molto rapida del nitrato oltre il nitrito ai gas azotati in modo che il nitrito non venga rilevato.
Stabilità del campione: Il rilevamento della riduzione del nitrato per Neisseria e specie correlate dipende dalla presenza di enzimi preformati.
- I test dovrebbero essere eseguiti solo con inoculo raccolto da colture di 24 ore.
- Il mezzo di nitrato deve essere inoculato entro 30 minuti dalla rimozione della coltura dall’incubatore; l’esposizione prolungata della coltura a temperatura ambiente può provocare una diminuzione dell’attività enzimatica.
Mezzo/Reagenti
Medio: Nitrate broth (brodo di infusione di cuore contenente lo 0,2% di nitrato di potassio)
Heart infusion broth (Difco), 25,0 g
Nitrato di potassio, 2,0 g
Acqua distillata, 1000,0 ml
- Dissolvere gli ingredienti in acqua distillata; regolare la soluzione a pH 7.0.
- Dispensare aliquote di 5 ml di brodo in provette da 16 mm x 100 mm con inserti di gas (provette Durham, 6 mm x 50 mm).
- Autoclave per 15 minuti a 121C.
Conservare il terreno a 4C a 10C (refrigerato) fino all’utilizzo. Preriscaldare il mezzo a temperatura ambiente prima dell’inoculazione.
Reagenti: Soluzione di acido solfanilico (reagente nitrico A): 0,8% in acido acetico 5N
Nome chimico: 4-aminobenzene acido solfonico
Conservare il reagente nitrato A a 15C a 30C (temperatura ambiente) per un massimo di 3 mesi, al buio. I reagenti possono essere conservati in contenitori di vetro marrone scuro; le bottiglie possono essere avvolte in un foglio di alluminio per assicurare l’oscurità.
Soluzione di alfa-naftilammina (reagente B del nitrato): 0,6% in acido acetico 5N
Nome chimico: N,N-dimetil-1 naftilammina
Conserva il reagente B del nitrato a 2C a 8C (refrigerato) fino a 3 mesi, al buio. I reagenti possono essere conservati in contenitori di vetro marrone scuro; le bottiglie possono essere avvolte in un foglio di alluminio per garantire l’oscurità.
Polvere di zinco, grado Reagente: Conservare a temperatura ambiente (15C a 30C)
Attenzione: L’acido acetico è corrosivo. Il contatto con la pelle può causare vesciche e ustioni. In caso di contatto, sciacquare immediatamente gli occhi e la pelle con abbondante acqua (per almeno 15 min.)
Controllo di qualità/procedura di prova
Cercini di qualità:
- Controllo positivo alla nitrato-reduttasi: Kingella denitrificans, CDC 10.236
- Controllo nitrato reduttasi-negativo: Neisseria gonorrhoeae, ATCC 43069
I ceppi di controllo sono conservati a -70°C in una soluzione di brodo di soia tryptic contenente il 20% di glicerolo. Le reazioni dei ceppi di controllo devono essere confermate al momento della preparazione degli stock congelati. I ceppi QC possono essere conservati a -70C per un massimo di 2 anni.
Procedura:
I ceppi QC sono testati nello stesso modo degli isolati clinici. I ceppi QC devono essere sottoposti a subcoltura almeno una volta dopo la coltura iniziale dal campione congelato prima di eseguire il test. Gli isolati clinici possono essere subcoltivati da un terreno selettivo o da subcolture purificate. Assicurarsi che le colture siano pure.
- Scongelare le fiale di ceppi di controllo conservate a -70C.
- Stampare su piastre di agar cioccolato o agar GC integrato per l’isolamento. Incubare a 35C a 36.5C in un’atmosfera arricchita di anidride carbonica per 18 a 24 h.
-
Con un tampone sterile, preparare una sospensione pesante di colonie ben isolate da una coltura pura dell’isolato incubato su mezzo di cioccolato a 35C a 36.5 C in un’atmosfera arricchita di anidride carbonica per 18 a 24 h. Inoculare il terreno di prova per dare forte torbidità.
Nota: ceppi di N. gonorrhoeae e alcuni altri Neisseria spp. possono non crescere in questo mezzo. Pertanto, la reazione può dipendere dall’enzima preformato.
- Incubare i mezzi inoculati e una provetta di controllo del mezzo non inoculato a 35C a 36,5 C in un’atmosfera arricchita di anidride carbonica per 48 ore.
-
Dopo 48 ore di incubazione aggiungere, con pipette Pasteur, 5 gocce di reagente #A, seguito da 5 gocce di reagente #B in ogni provetta. Agitare bene la provetta per mescolare i reagenti con il mezzo.
Esaminare la sospensione per un colore rosa-rosso che dovrebbe svilupparsi entro pochi minuti se il mezzo è ancora caldo. La reazione può richiedere un po’ più di tempo se il mezzo è freddo quando vengono aggiunti i reagenti.
Se la sospensione diventa rosa-rosso prima dell’aggiunta della polvere di Zn, la ricatione è positiva e il test è completato. Non eseguire il passo 4.
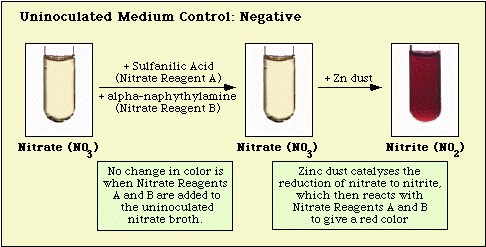
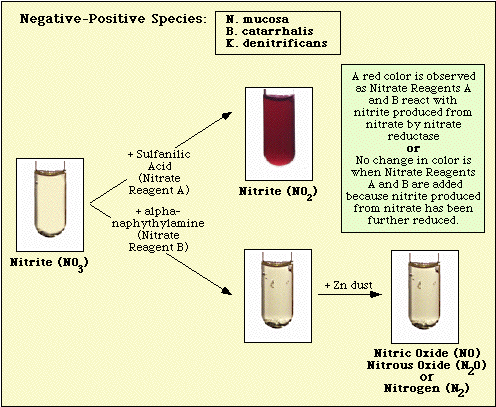
Le reazioni osservate con il controllo del mezzo non inoculato e gli isolati nitrato-negativi e nitrato-positivi sono illustrati nella Figura 3, Figura 4 e Figura 5, rispettivamente.
-
Se la sospensione è incolore dopo l’aggiunta dei reagenti A e B, aggiungere una piccola quantità (da 4 a 5 mg; “punta di coltello affilata”) di polvere di zinco al mezzo. Agitare vigorosamente la provetta e lasciarla riposare a temperatura ambiente per 10-15 minuti.
Se il mezzo rimane incolore dopo l’aggiunta della polvere di Zn, il risultato del test è positivo.
Se il mezzo diventa rosa dopo l’aggiunta della polvere di Zn, il risultato è negativo. - Leggi e registra i risultati.
Figura 3. Reazione osservata con terreno nitrato non inoculato.
Figura 4. Reazione osservata con specie nitrato-negative.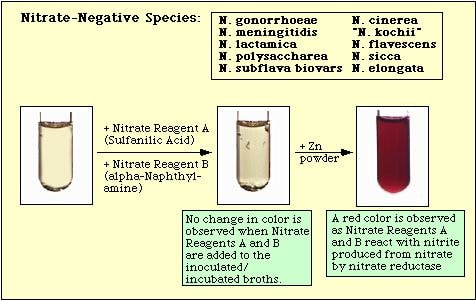
Figura 5. Figura 5. Reazioni osservate con specie positive ai nitrati.
Schema di controllo di qualità:
- Un test QC sulla nitrato reduttasi viene eseguito ogni giorno in cui vengono testati isolati clinici.
Problemi & Soluzioni
Il test di riduzione dei nitrati può dare risultati falsi negativi o falsi positivi se il mezzo non è prodotto accuratamente o il test non è eseguito accuratamente. La reazione in questo test dipende da una serie di fattori.
- Il mancato rilevamento del colore rosa nella provetta di controllo del terreno non inoculato dopo l’aggiunta di polvere di Zn può essere dovuto (1) al fatto che il terreno non contiene nitrato o (2) all’aggiunta di troppa polvere di zinco che ha catalizzato la riduzione del nitrato oltre il nitrito ai gas azotati. La soluzione più semplice è quella di ottenere più terreno nitrato assicurandosi che il nitrato sia stato aggiunto al terreno di base. In alternativa, inoculare il terreno con un ceppo di controllo positivo, ma verificare la reazione dopo un tempo di incubazione più breve; i ceppi di N. mucosa produrranno una reazione positiva al nitrito dopo poche ore di incubazione. Se è confermato che il terreno contiene nitrato, ripeti il test fino a quando non hai determinato la giusta quantità di polvere di zinco da aggiungere. È fondamentale sapere quanta polvere di zinco aggiungere al test. L’aggiunta di troppa polvere di zinco può portare a un risultato falso-positivo.
- Se viene rilevato un colore rosa nel controllo del terreno non inoculato dopo che i reagenti di nitrato A e B sono stati aggiunti al terreno, il terreno è contaminato da nitrito. L’unica soluzione è quella di ottenere un nuovo lotto di terreno che non sia contaminato da nitrito.
- Nel terreno contenente nitrato, il fallimento del ceppo di controllo positivo, Kingella denitrificans, per dare una reazione positiva si verificherebbe solo se il ceppo non è K. denitrificans. Ricontrolla l’identità del ceppo di controllo positivo. Seleziona una nuova coltura del ceppo di controllo e ripeti il test. Allo stesso modo, se si ottiene un test positivo della nitrato reduttasi con il ceppo di controllo negativo, N. gonorrhoeae, o il ceppo di controllo negativo non è N. gonorrhoeae o la cultura è contaminata da un organismo nitrato-positivo. Ricontrollare la purezza e l’identità del ceppo gonococcico di riferimento. Ripetere il test con una coltura pura di una coltura confermata di N. gonorrhoeae.
- La reazione di riduzione del nitrato indica la capacità degli organismi di ridurre il nitrato, una reazione che si verifica solo in condizioni anaerobiche; la reazione non si verifica se gli organismi ricevono una fornitura continua di ossigeno. Pertanto, la reazione può non verificarsi in colture fisse (in particolare di specie a crescita lenta) in cui il mezzo è distribuito in strati poco profondi che permettono all’ossigeno di diffondersi nel mezzo. Un test per determinare se l’ossigeno è presente nel mezzo può essere fatto aggiungendo una goccia di reagente ossidasi al mezzo. Se il mezzo diventa viola, il mezzo contiene ossigeno e la reazione di riduzione dei nitrati potrebbe non avvenire. Se il mezzo rimane incolore, il mezzo non contiene ossigeno e il test di riduzione dei nitrati può avvenire. È stato notato che le cellule di N. gonorrhoeae consumano rapidamente l’ossigeno se viene inoculato un numero sufficiente di cellule nel mezzo. Se il reagente ossidasi viene aggiunto dopo circa 1 o 2 ore di incubazione, il terreno rimarrà chiaro. Poiché il reagente ossidasi uccide i gonococchi presenti nel terreno, il terreno diventerà gradualmente viola, a partire dalla parte superiore della provetta, man mano che l’ossigeno si diffonde nel terreno. Se il mezzo viene dispensato in provette di dimensioni diverse da quelle suggerite sopra, assicurarsi che il rapporto superficie/profondità sia almeno uguale o inferiore a quello suggerito sopra. Se il diametro della provetta in cui viene dispensato il mezzo è più grande di quello descritto sopra, utilizzare un volume maggiore di mezzo per mantenere lo stesso rapporto superficie/profondità.
-
La reazione di riduzione dei nitrati può non verificarsi se il mezzo in cui viene eseguito il test non consente la normale crescita dell’organismo. Tuttavia, il test può essere eseguito in un mezzo che non supporta la crescita degli organismi se l’inoculo è sufficientemente denso che gli enzimi preformati possono esaurire la fornitura di ossigeno esistente e ridurre il nitrato ad una velocità superiore a quella con cui l’ossigeno si diffonde nel mezzo.
Nota: Per controllare che l’ossigeno sia stato rimosso dal mezzo, aggiungere 2 o 3 gocce di reagente ossidasi ad un duplicato del mezzo inoculato. Se l’ossigeno è stato adeguatamente rimosso dal mezzo, il reagente dell’ossidasi non diventerà immediatamente viola. Se il mezzo contiene ossigeno disciolto, il reagente dell’ossidasi diventerà viola. Si noti inoltre che il test di riduzione dei nitrati può essere eseguito in un mezzo a cui è stato aggiunto il reagente ossidasi.
- Quando il reagente A viene aggiunto al mezzo di prova, il nitrito prodotto come risultato della riduzione del nitrato formerà un complesso con l’acido sulfanilico che produce un precipitato rosso con l’alfa-naftilamina nel reagente B. La presenza di un colore rosso nel mezzo di prova indica che il nitrito è presente come risultato della riduzione del nitrato. Tuttavia, l’assenza di un colore rosso dopo l’aggiunta dei reagenti A e B non significa necessariamente che il nitrato non è stato ridotto. Il mancato sviluppo di un colore rosso può significare (1) che il nitrato non è stato ridotto, o (2) che il nitrito, prodotto come risultato della riduzione del nitrato, è stato esso stesso ridotto a gas azotati. Per determinare se il nitrito è stato ridotto, metti una piccola quantità di polvere di zinco nella miscela di incubazione se è incolore dopo l’aggiunta dei reagenti A e B. La polvere di zinco catalizza la riduzione del nitrato a nitrito; un colore rosso dovrebbe svilupparsi nel mezzo che contiene ancora nitrato non ridotto. È importante, tuttavia, non aggiungere troppa polvere di zinco; la polvere di zinco in eccesso catalizzerà la riduzione del nitrito prodotto da quel nitrato, con conseguente mezzo incolore e l’errata interpretazione del test come positivo (un risultato falso positivo).
- Un test positivo della nitrato reduttasi ottenuto con il ceppo di controllo negativo, N. gonorrhoeae, dopo l’aggiunta della polvere di zinco indica che il nitrato è stato ridotto a nitrito, probabilmente a causa dell’aggiunta di troppa polvere di zinco al test. Ripetere il test assicurandosi di aggiungere pochissima polvere di zinco. Il colore rosa, che indica che l’organismo non ha ridotto il nitrato, può richiedere da 10 a 15 minuti per svilupparsi. Non aggiungere altra polvere di zinco! Aspettare che il colore si sviluppi. Se nessun colore si è sviluppato in 30 minuti, interpretare il test come positivo.
Limitazioni del test
Se il test viene eseguito correttamente e i ceppi di controllo qualità danno risultati appropriati, non dovrebbero esserci limitazioni a questo test. Si deve prestare attenzione a garantire che tutti i componenti del test siano eseguiti correttamente.
Nessuna identificazione di genere o specie può essere fatta sulla base del solo test di riduzione dei nitrati.
Risultati, interpretazione e segnalazione
Gli isolati possono essere riportati come nitrato-positivi se il nitrito (colore rosa) viene rilevato nel terreno inoculato dopo l’aggiunta dei reagenti A e B o se nessun colore viene rilevato nel terreno dopo l’aggiunta di polvere di zinco.
Isolati possono essere riportati come Nitrato-negativi se il nitrito non viene rilevato (nessun cambiamento di colore) dopo l’aggiunta dei reagenti A e B, o se si sviluppa un colore rosa dopo l’aggiunta di polvere di zinco al mezzo inoculato.
Bibliografia
Knapp JS, Clark VL. Crescita anaerobica di Neisseria gonorrhoeae accoppiata alla riduzione dei nitriti. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Una guida all’identificazione dei generi di batteri. The Williams & Wilkins Co., Baltimora, MD.