Guanosina trifosfato (Guanosina-5′-trifosfato per essere precisi o anche comunemente abbreviato GTP per semplicità) è un nucleotide ad alta energia (da non confondere con il nucleoside) presente nel citoplasma o polimerizzato per formare la base guanina.
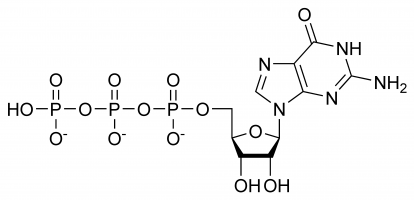
GTP ha ruoli selettivi nella formazione di filamenti di RNA, funzionando come molecola portatrice di energia per la sintesi proteica, un coenzima, un predecessore del cGMP – una molecola messaggera secondaria o come molecola effettrice. Le ultime due sono comunemente dimostrate dalla modulazione della proteina G. Tutti questi sono il risultato della sua complessa struttura tridimensionale e della varietà di diversi gruppi chimici che la compongono. Per semplicità si può quindi pensare a una moltitudine di diversi gruppi funzionali che praticamente svolgono diverse funzioni in modo isolato (anche se a volte la struttura sarà coinvolta, ad esempio quando interagisce con un enzima e un altro substrato), ad esempio solo il trifosfato è coinvolto nel rilascio di energia per la polimerizzazione mentre solo la base guanina è coinvolta nella sua deaminazione. E’ importante notare che l’elenco dato all’inizio non mostra le sue interazioni chimiche ma è solo una dimostrazione delle sue varie capacità.
Nel GTP lo zucchero ribosio è centrale nella disposizione tridimensionale delle molecole di guanina e trifosfato legate covalentemente. Questo monosaccaride fornisce gruppi idrossilici per le reazioni di condensazione e gli attacchi nucleofili, quest’ultimo importante per la distruzione delle molecole di RNA e quindi la regolazione dell’espressione genica. La molecola di guanina e il trifosfato formano legami covalenti rispettivamente agli atomi di C’1 e C’5, ma è anche possibile che utilizzino altri gruppi ossidrilici, purché la struttura risultante non provochi scontri. Dal punto di vista della purina è legata come risultato di una reazione di condensazione al suo 9’N, che precedentemente era stato legato covalentemente a un atomo di idrogeno. Poiché la guanina è una base purinica, è classificata come un trifosfato di purina insieme all’adenina trifosfato (ATP) e si forma attraverso la modifica dell’inosina monofosfato.
Contenuti
- 1 Errore: GTP, un mattone di base
- 2 Uno dei molti predecessori di basi RNA
- 3 GTP; un cugino dell’ATP universale
- 4 Una risorsa per la segnalazione
- 5 Riferimenti
Errore: GTP, un mattone di base
Il fegato è l’organo principale che sintetizza i nucleotidi purinici e piramidinici. I nucleotidi purinici (GTP e ATP) sono sintetizzati creando prima inosina monofosfato da ATP, glutammina, glicina, CO2, aspartato e formiato. L’IMP
può quindi essere modificato per produrre una delle due molecole.
Nel caso della formazione di GTP, l’IMP viene prima convertito in XMP dall’IMP deidrogenasi. Il cambiamento chimico e strutturale che ne risulta permette l’azione della GTP sintasi che converte rapidamente l’XMP in GMP. Tuttavia, il GMP non è una molecola ad alta energia perché non possiede un trifosfato, quindi viene fosforilato dalla nucleoside fosfato chinasi per produrre prima un difosfato e poi un trifosfato.
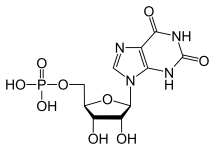
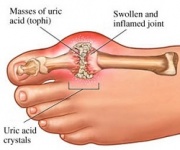
GTP è normalmente catabolizzato in acido urico insolubile che può poi presentarsi nelle urine come cristalli di urato di sodio. Questo processo è considerato anormale se avviene nelle articolazioni sinoviali, dando luogo ad acido urico che viene poi convertito in dannoso urato monosodico o pirofosfato di calcio diidrato. La presenza di tali sostanze chimiche permette lo sviluppo dell’infiammazione e dell’artrite e i sintomi combinati portano alla classificazione della malattia come gotta. Un altro esempio dell’importanza di un appropriato catabolismo dei nucleotidi purinici è la Malattia da Immunodeficienza Combinata Grave che si traduce nella distruzione dei linfociti B e T essenziali
Uno dei molti predecessori di basi di RNA
Ci sono diverse differenze tra RNA e DNA, ma la distinzione principale è nella struttura delle nucleobasi che costruiscono ogni polimero. Le nucleobasi dell’RNA contengono un gruppo 2’OH sul loro zucchero ribosio che permette loro di essere molto più chimicamente reattivi, catalitici e instabili. È importante notare che il guanosina trifosfato riguarda solo la produzione della base guanina nell’RNA. L’analogo del GTP per la formazione di una base guanina nel DNA è la desossiguanosina trifosfato. Questo trifosfato contiene uno zucchero deossiribosio senza un
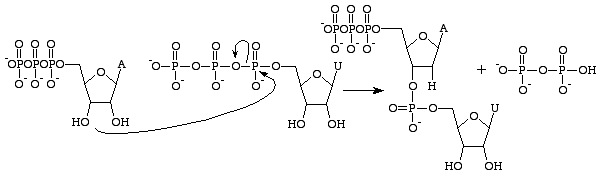
2’OH gruppo che lo rende significativamente più stabile – impedendo attacchi nucleofili che scinderebbero i legami fosfodiesteri tra le nucleobasi. Questo è l’ideale perché l’RNA dovrebbe essere disintegrato dopo essere stato tradotto in una proteina, mentre il DNA deve rimanere intatto per il passaggio delle informazioni genetiche nella cellula figlia.
La guanosina trifosfato porterà alla formazione di una base guanina come risultato della scissione di un legame anidro e del rilascio di fosfati alfa e gamma come fosfati liberi. Il GMP formerà poi un legame fosfodiestere con la vicina base contenente il gruppo 3’OH e fornirà un gruppo 3’OH per la prossima base dell’RNA. Questa reazione avviene solo se la base opposta al GMP è la citosina con cui può formare legami idrogeno e la sua velocità è aumentata dalla RNA polimerasi. La RNA polimerasi non allinea i trifosfati. Si limita a catalizzare la reazione che avviene dopo che questa è avvenuta in modo indipendente. Dopo la catalisi, la molecola fa parte di una catena polinucleotidica e non è più conosciuta come GTP, ma come base guanina.
GTP; un cugino dell’ATP universale
Il meccanismo sottostante alla produzione di energia dalla scissione del legame anidro è lo stesso in tutti i trifosfati. Lo stato di alta energia dei trifosfati si ottiene attraverso tre meccanismi distinti. Il primo è dovuto alle forze repulsive
su ciascuno dei gruppi fosfato. Questo contribuisce a un’alta instabilità dei trifosfati legati e a un alto “desiderio” di raggiungere uno stato energetico inferiore. Il secondo è dovuto alla stabilizzazione della risonanza. Quando il GTP è
convertito in GDP la quantità di posizioni possibili per le coppie di elettroni esistenti aumenta, prestando una maggiore stabilità. Questo argomento è confermato anche con la conversione del PIL in GMP. Il terzo è dovuto all’effetto entropico sfavorevole che una maggiore quantità di fosfati ha sulla conformazione delle molecole d’acqua che circondano la molecola.
Siccome la concentrazione di GTP nel citoplasma è significativamente inferiore a quella dell’ATP, viene utilizzato per funzioni specifiche nei processi metabolici delle cellule.
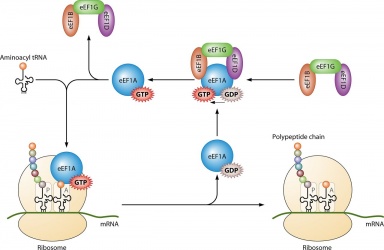
Il suo uso principale è nella sintesi proteica quando è accoppiato con IF2 durante l’iniziazione ribosomiale, Ef-Tu e Ef-G durante l’allungamento e ;RF3 durante la terminazione. Tutte le molecole di GTP che si legano con le proteine citate vengono defosforilate, ottenendo GDP e un fosfato libero
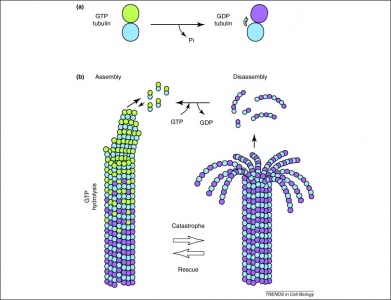
Inoltre, il GTP viene utilizzato anche dai dimeri di tubulina nella loro formazione di microtubuli. I dimeri di tubulina sono composti da tubulina alfa e beta, ognuna delle quali possiede siti di legame al GTP. Poiché la tubulina beta esiste all’estremità più del filamento, il GTP viene sempre idrolizzato qui quando un altro dimero viene aggiunto al polimero di allungamento. È importante notare che l’idrolisi del GTP indebolisce le interazioni non covalenti tra i dimeri di tubulina e facilita la capacità di sciogliere i microtubuli quando necessario. Si noti che la proteina GTP dell’alfa tubulina non è defosforilata, quindi può essere considerata coerente attraverso la struttura del microtubulo.
Una risorsa per la segnalazione
L’uso della chimica specifica e della conformazione spaziale del GTP è efficacemente dimostrato dal suo uso nella trasmissione dei segnali. In primo luogo, è in grado di legare e regolare l’attività di diverse proteine della via di segnalazione che sono classificate in due gruppi diversi. Il primo sono le proteine leganti GTP eterotrimeriche (note anche come proteine G eterotrimeriche) che utilizzano GTP all’attivazione di recettori accoppiati a proteine G per modificare l’attività di altre proteine nel percorso. Le seconde sono proteine monomeriche che legano il GTP (note anche come proteine G monomeriche). Queste rispondono a recettori diversi da quelli accoppiati alle proteine G. Un tipico esempio citato durante la loro spiegazione è la proteina Ras. Si noti che sono in grado di legare selettivamente il GTP non solo grazie alla sua chimica specifica, ma anche grazie al fenomeno dell’adattamento indotto. Il GTP legato sarà poi idrolizzato dopo un certo periodo di tempo e quindi risulterà in un’auto-inattivazione della proteina e nella prevenzione di un’eccessiva stimolazione di una via di segnalazione. Dopo che il GTP è stato idrolizzato, il PIL rimarrà legato poiché il cambiamento conformazionale provocherà uno spostamento di affinità verso la molecola del GTP e la molecola del PIL. Tuttavia, questo è un cambiamento imperniato e può essere invertito da una successiva attivazione da parte del recettore accoppiato alla proteina G.
GTP può anche essere usato come reagente per produrre cGMP che è una molecola di segnalazione secondaria relativamente comune. La catalisi è innescata dal rilascio di NO che attiva la guanilato ciclasi, un enzima che produce cGMP sotto forma di GTP. cGMP può quindi agire come un effettore verso le protein chinasi che fosforilano e modificano l’azione di proteine specifiche.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell e P A Weil. Biochimica illustrata di Harper. 28a edizione. Pechino, Cina. 2009.
- J Dow, G Lindsay e J Morrison, Biochemistry: Molecole, cellule e il corpo. 1a edizione. Wokingham, Inghilterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Biochimica: Molecole, cellule e corpo. 1a edizione. Wokingham, Inghilterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Biochimica: Molecole, cellule e corpo. 1a edizione. Wokingham, Inghilterra. Addison-Wesley. 1996.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3a edizione, Stoccarda, Germania. Thieme 2013.
- M W King. La pagina di biochimica medica. Settembre 2016. Citato: 11:31. 03.12.2016. Disponibile da: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell e P A Weil. Biochimica illustrata di Harper. 28a edizione. Pechino, Cina. 2009.
- M W King. La pagina di biochimica medica. Settembre 2016. Citato: 11:31. 03.12.2016. Disponibile da: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La pagina di biochimica medica. Settembre 2016. Citato: 11:31. 03.12.2016. Disponibile da: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La pagina di biochimica medica. Settembre 2016. Citato: 11:31. 03.12.2016. Disponibile da: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La pagina di biochimica medica. Settembre 2016. Citato: 11:31. 03.12.2016. Disponibile da: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay e J Morrison, Biochemistry: Molecole, cellule e il corpo. 1a edizione. Wokingham, Inghilterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Biochimica: Molecole, cellule e corpo. 1a edizione. Wokingham, Inghilterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Biochimica: Molecole, cellule e corpo. 1a edizione. Wokingham, Inghilterra. Addison-Wesley. 1996.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto e R Stryer. Biochimica. Ottava edizione. Città e paese non identificati. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto e R Stryer. Biochimica. Ottava edizione. Città e paese non identificati. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto e R Stryer. Biochimica. Ottava edizione. Città e paese non identificati. Freeman and Co. 2015.
- T E Dever e R Green. Le fasi di allungamento, terminazione e riciclaggio negli eucarioti. CSHPB. Luglio 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. 6a edizione. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6a edizione. New York, USA. Garland Science. 2015.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3a edizione, Stuttgart, Germany. Thieme 2013.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3a edizione, Stoccarda, Germania. Thieme 2013.
- J Koolman e KH Roehm, Color Atlas of Biochemistry, 3a edizione, Stoccarda, Germania. Thieme 2013.