Introduzione: Clinica dell’emicrania
L’emicrania consiste in una cefalea unilaterale accompagnata da un cluster di altri sintomi sensoriali, autonomici e cognitivi ed è stata identificata dal Global burden of disease (GBD) study 2016 come il sesto disturbo più prevalente e una delle principali cause di disabilità in tutto il mondo, spesso si verifica in età lavorativa e nelle donne giovani adulte e di mezza età (Collaborators, 2018). Quindi, l’emicrania rappresenta un problema sociale molto serio in termini di anni di vita vissuti con disabilità (YLD) e la più importante causa di YLD entro i 15-49 anni di età (vedi Steiner et al., 2018). Il peso di tale malattia non è stato identificato fino a poco tempo fa perché: l’emicrania non è una causa di disabilità permanente o di morte; la cefalea si presenta occasionalmente nella popolazione generale (Collaboratori, 2018). Anche se una patogenesi definita per l’emicrania non è nota, la circolazione extracranica è coinvolta (Drummond e Lance, 1983). Il decorso clinico dell’emicrania si articola in diverse fasi successive o concomitanti: premonitoria, aura, cefalea e postdrome (simile alla fase premonitoria) (Goadsby et al., 2017a). La fase premonitoria include irritabilità, desiderio di cibo, torcicollo e può verificarsi da 2 a 72 ore prima dell’attacco e continua sulle altre fasi. Secondo le definizioni dell’International Classification of Headache Disorders terza edizione (ICHD-3):
– l’aura è caratterizzata da uno o più deficit neurologici transitori e reversibili, di cui almeno uno deve avere una localizzazione unilaterale, che si sviluppano su 5 min o più e di cui ogni deficit dura tra 5 e 60 min;
– l’emicrania consiste in attacchi di mal di testa della durata di 4-72 h accompagnati da nausea, fotofobia e fonofobia, o entrambe (vedi Goadsby et al., 2017a).
L’allodinia cutanea, definita come la percezione del dolore in seguito a stimoli non dolorosi, si verifica in più del 70% dei pazienti (Lambru et al., 2018). La cefalea grave si attenua fino a cessare durante la fase postdromica, mentre altri sintomi come astenia, sonnolenza e fotofobia continuano a colpire il paziente, mostrando così la complessa base neurale alla base dell’emicrania (Lambru et al., 2018). A seconda dei giorni al mese interessati, l’emicrania viene classificata come episodica (meno di 15 giorni di emicrania o mal di testa) o cronica (almeno 15 giorni, di cui 8 o più sono giorni di emicrania) (vedi Goadsby et al., 2017b). Questo aspetto influenza notevolmente l’impatto della malattia e le opzioni terapeutiche (Giamberardino et al., 2017). Con 1 a 3 attacchi al mese è possibile utilizzare solo farmaci sintomatici abortivi, mentre se si verificano da 4 a 14 attacchi al mese è obbligatorio aggiungere trattamenti preventivi; questi ultimi trattamenti sono necessari per evitare la cronicizzazione della malattia (Giamberardino e Martelletti, 2015; Giamberardino et al, 2017) e per ridurre il rischio di cefalea da uso eccessivo di farmaci e di emicrania refrattaria (Martelletti, 2017).
Patofisiologia dell’emicrania e del Calcitonin Gene-Related Peptide (CGRP)
L’esatta causa degli attacchi di emicrania non è ancora ben conosciuta, ma le ricerche attuali stanno evidenziando l’importanza dei processi di sensibilizzazione all’interno del sistema trigeminovascolare e dell’intero tronco encefalico, così come l’osservazione della ridotta materia grigia nelle aree di elaborazione del dolore (vedi Goadsby et al, 2017a). Dal ganglio trigemino contenente il corpo cellulare afferenze primarie pseudo-unipolari sinapsi sui vasi sanguigni e sul complesso trigeminocervicale da cui fibre di secondo ordine sinapsi su neuroni talamocorticali di terzo ordine e su locus coeruleus, grigio periaqueduttale e ipotalamo (Goadsby et al., 2017a). Le fibre nocicettive del ganglio del trigemino e dei gangli della radice dorsale cervicale innervano i vasi della dura madre e i loro terminali rilasciano neuropeptidi vasoattivi come il peptide correlato al gene della calcitonina (CGRP) che inducono la vasodilatazione. L’espressione di CGRP, CLR e RAMP1 nei vasi della dura madre umana è mostrata nelle figure 1A-C. Infatti, le fibre nervose autonome che innervano i vasi extracerebrali contengono diverse molecole neurotrasmettitori vasoattive: noradrenalina, serotonina, acetilcolina, neuropeptide Y (NPY), polipeptide intestinale vasoattivo (VIP), sostanza P (SP), neurochinina A (NU), e CGRP (Goadsby et al., 1990). Gli antagonisti del recettore CGRP agiscono bloccando l’informazione nocicettiva dalla dura madre: essa viene elaborata nei nuclei talamici da cui raggiunge le regioni corticali superiori. Questi input dal sistema trigeminovascolare sono soggetti alla modulazione della via discendente del tronco encefalico: gli agonisti del recettore della 5-idrossitriptamina (5HT)1B/1D, cioè i triptani, si pensa che agiscano attraverso questo sistema e che contrastino la vasodilatazione avvenuta. Mentre il propranololo e il topiramato come trattamento preventivo, questi ultimi farmaci sono utilizzati negli episodi acuti di emicrania. In particolare, oltre alla loro attività vasocostrittrice, i triptani che agiscono direttamente sui recettori presinaptici 5HT1B/D inibiscono il rilascio di mediatori come il CGRP coinvolti nella nocicezione. Inoltre, è stato dimostrato sperimentalmente che il sumatriptan inibisce la corrente in entrata mediata dal recettore transitorio potenziale vanilloide 1 (TRPV1) nei gangli trigeminali (Evans et al., 2012). Il CGRP viene rilasciato durante gli attacchi di emicrania e mostra diversi ruoli come il neuropeptide più vasoattivo i cui livelli craniovascolari aumentano nel corso del disturbo (Goadsby et al., 1990). È stato dimostrato che il CGRP subisce alterazioni anche nel liquido cerebrospinale (van Dongen et al., 2017). I fattori scatenanti l’alterazione dell’eccitabilità centrale e la successiva rottura degli episodi di dolore emicranico sono stati a lungo studiati. La stimolazione delle fibre nervose può favorire potenziali d’azione sia ortodromici che antidromici e, in particolare, l’attivazione delle afferenze sensoriali primarie peptidergiche durali che esprimono il potenziale recettoriale transitorio (TRP) può indurre il rilascio di diverse molecole tra cui il CGRP che innescano reazioni infiammatorie tissutali note come infiammazione neurogenica (Xanthos e Sandkuhler, 2014). In particolare, il CGRP è coinvolto nella nocicezione cranica e nell’epifenomeno della vasodilatazione che lega i suoi recettori ai vasi sanguigni meningei e cerebrali (Deen et al., 2017). Questi processi promuovono la sensibilizzazione delle fibre trigeminali di secondo ordine portando gli stimoli dolorosi amplificati a regioni superiori come talamo, ipotalamo e corteccia, dando così origine all’emicrania (Dussor et al., 2014). Le TRPs sono soggette ad attivazione in risposta a diversi stimoli irritanti ambientali come variazioni di temperatura e pH che in individui predisposti possono scatenare il dolore emicranico. Il CGRP è prodotto dallo splicing alternativo tessuto-specifico del gene della calcitonina CALC I sul cromosoma 11, che codifica anche per la calcitonina. Al contrario, il β CGRP è prodotto dal gene CALC II situato in un sito diverso del cromosoma 11. Il neuropeptide α CGRP è presente nel sistema nervoso centrale come isoforma α di 37 aminoacidi e la sua trasduzione del segnale è mediata da due recettori.
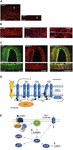
Figura 1. Presenza di CGRP e percorso nell’emicrania. Espressione di CGRP, CLR, e RAMP1 in vasi sanguigni umani: (A) L’immunoreattività del CGRP si trova nelle fibre sottili nell’avventizia; (B) sezioni trasversali e longitudinali che mostrano l’espressione di RAMP1 nel citoplasma delle cellule muscolari lisce; (C) coespressione di CLR e RAMP1 nello strato delle cellule muscolari lisce. (D) componenti del recettore CGRP e residui importanti per la segnalazione e l’internalizzazione del recettore. Il recettore CGRP è formato da CLR (blu), RAMP1 (giallo) e RCP (arancione). Residui funzionalmente importanti sono mostrati come abbreviazioni di una sola lettera. I residui di aminoacidi sono numerati dall’inizio del peptide di segnale N-terminale previsto (Swiss-Prot Q16602). Diversi aminoacidi all’interno del C-terminale del CLR (∼N400-C436) e I312 alla giunzione ICL3/TM5 sono necessari per un’efficace internalizzazione mediata dal CGRP. Sono illustrate importanti caratteristiche del recettore CGRP, tra cui la “piega” TM6 (P343) e l’ottava elica putativa (∼G388-W399) in CLR. C′, C-terminale; ECL, loop extracellulare; ICL, loop intracellulare; N′, N-terminale; TM, transmembrana. (E) segnalazione intracellulare mediata dal recettore CGRP: La segnalazione Gαs aumenta l’attività AC (verde), elevando il cAMP intracellulare, attivando PKA e successivamente molti potenziali effettori a valle. I pannelli (A-C) sono adattati da Eftekhari et al. (2013) e il pannello (D,E) da Walker et al. (2010), rispettivamente, con il permesso.
Il primo è noto come recettore canonico CGRP ed è un recettore accoppiato alla proteina Gαs che richiede la proteina modificante l’attività del recettore (RAMP) 1 per essere funzionale (Goadsby et al., 2017a). Il secondo è il recettore umano dell’amilina sottotipo 1 (AMY1): l’amilina appartiene alla famiglia dei geni della calcitonina e ha attività ormonale. Quando il CGRP si lega al suo recettore, è sottoposto all’internalizzazione dipendente dalla dinamina/clatrina dopo essere stato complessato con la β-arrestina (vedi Walker et al., 2010). Si verificano cambiamenti conformazionali che inducono l’attivazione dell’adenilato ciclasi (AC), l’aumento del cAMP e l’attivazione della protein chinasi A (PKA) che può promuovere la vasodilatazione attraverso l’attivazione diretta dell’ossido nitrico sintasi endoteliale e le risposte al dolore. Quest’ultimo recettore può essere accoppiato a Gαq/11 con l’attivazione della fosfolipasi C (PLC), alla proteina chinasi attivata da mitogeno (MAPK) e al rilascio di NO (vedi Walker et al., 2010) (vedi Figure 1D,E per una rappresentazione schematica della segnalazione intracellulare mediata dal recettore CGRP). La somministrazione di CGRP a emicranici scatena attacchi e questa evidenza sostiene il suo ruolo centrale nella patogenesi dell’emicrania (Lassen et al., 2002). Un sistema di terminazione del segnale non è stato ancora identificato: Il CGRP è metabolizzato dalla neprilysina, dall’enzima di degradazione dell’insulina e dall’enzima di conversione dell’endotelina-1 ed è stato ipotizzato un sistema di trasporto attivo di ricaptazione (vedi Russell et al., 2014). Inoltre, quando il recettore viene attivato transitoriamente da CGRP viene internalizzato in endosomi e rapidamente riciclato di nuovo alla membrana cellulare, mentre la stimolazione cronica del recettore induce desensibilizzazione e degradazione lisosomiale (vedi Russell et al, 2014).
Interventi farmacologici sul CGRP Pathway
L’emicrania è un disturbo neurovascolare invalidante dalle molteplici sfaccettature e l’attuale terapia con triptani orali è efficace negli attacchi acuti, anche se circa il 40% dei pazienti è resistente al trattamento (Ferrari et al., 2001; Edvinsson, 2015). Questi agonisti selettivi 5-HT1B/1D, di cui il più usato è il sumatriptan attivo soprattutto per via sottocutanea, esercitano la loro azione terapeutica attraverso la vasocostrizione dei vasi cranici, e l’inibizione del sistema trigemino e trigeminocervicale (vedi Ferrari et al., 2001). Tuttavia, la vasocostrizione rappresenta un limite per gli effetti collaterali cardiovascolari di questi farmaci. Inoltre, il trattamento con i triptani non può durare più di 9 giorni al mese a causa del rischio di cefalea farmaco-indotta. Nel 2010 la tossina botulinica di tipo A (BoNT-A) è stata approvata dalla Food and Drug Administration (FDA) nella prevenzione dell’emicrania negli emicranici cronici non responsivi e la sua complessa somministrazione (richiede l’iniezione in 31 siti) limita la compliance dei pazienti. A causa del ruolo centrale svolto dal CGRP nella fisiopatologia dell’emicrania, sono stati sviluppati antagonisti del suo recettore. Questi farmaci appartengono alla classe dei gepant. Telgecepant, il primo gepant orale, è risultato ben tollerato negli emicranici affetti da coronaropatia (ClinicalTrials.gov NCT00662818, Ho et al., 2012), ma ha presentato epatotossicità, quindi, nonostante la continua ricerca su queste piccole molecole, è stato proposto un nuovo approccio che consiste nello sviluppo di anticorpi monoclonali (mAbs) verso la CGRP (nezumabs) o il recettore della CGRP (numabs). Si ritiene che questi farmaci inibiscano l’azione delle molecole di CGRP circolanti per prevenire gli attacchi di emicrania e, poiché non attraversano la barriera emato-encefalica (BBB) a causa delle loro dimensioni, i siti di azione dovrebbero essere nel sistema trigemino (Edvinsson, 2015). In particolare, i vasi durali non sono inclusi nella BBB. Inoltre, il CGRP probabilmente non attraversa la BBB e agisce come modulatore paracrino poiché è espresso da metà dei neuroni del ganglio trigemino che non presentano il recettore CGRP, espresso dalle cellule gliali satellite e dal 30% del soma neuronale del ganglio trigemino (vedi Yuan et al., 2017). Attualmente, ci sono quattro mAbs, eptinezumab, fremanezumab, galcanezumab ed erenumab studiati in studi clinici per l’emicrania episodica e cronica. I primi tre mAbs sono anticorpi umanizzati diretti verso il CGRP, mentre erenumab è un anticorpo umano verso il suo recettore canonico. L’emivita di questi farmaci è piuttosto lunga, consentendo così non più di una somministrazione al mese e questo è un aspetto interessante poiché i mAbs devono essere somministrati per via endovenosa o sottocutanea. In particolare, eptinezumab viene somministrato solo per via endovenosa (Israel et al., 2018). Lo studio di fase III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) ha valutato l’efficacia di eptinezumab sulla prevenzione dell’emicrania episodica frequente. I risultati hanno mostrato una riduzione significativa dell’endpoint primario consistente nella diminuzione dei giorni mensili di emicrania (MMD) dal basale medio di 8,5 giorni nelle settimane 1-12 a 4,3 MMD con la dose di 300 mg, 3,9 con 100 mg, e 4,0 con 30 mg rispetto ai 3,2 giorni del placebo (Saper et al., 2018). Per la valutazione di eptinezumab nella prevenzione dell’emicrania cronica sono stati arruolati 1121 partecipanti nel PROMISE 2 (ClinicalTrials.gov NCT02974153). Galcanezumab è stato valutato per l’efficacia nella prevenzione dell’emicrania episodica nello studio EVOLVE-1 di fase 3 in doppio cieco, randomizzato, controllato con placebo (ClinicalTrials.gov NCT02614183) sezionato in 4 periodi e nello studio EVOLVE-2 di fase 3 randomizzato controllato in doppio cieco di 6 mesi (ClinicalTrials.gov NCT02614196). Nell’EVOLVE-1 entrambe le dosi di galcanezumab (120 e 240 mg) hanno soddisfatto l’esito primario di riduzione significativa dei giorni mensili di emicrania rispettivamente di 4,7 giorni e 4,6 giorni rispetto ai 2,8 giorni del placebo (Stauffer et al., 2018). Nell’EVOLVE-2 i pazienti hanno ricevuto un’iniezione mensile di 120 o 240 mg di galcanezumab. I giorni medi mensili di emicrania sono stati ridotti di 4,3 e 4,2 giorni, rispettivamente, rispetto alla riduzione di 2,3 giorni ottenuta con il placebo (p < 0,001) (Skljarevski et al., 2018). Anche gli endpoint secondari di riduzione della compromissione funzionale valutata attraverso il punteggio del dominio Role Function-Restrictive (R-FR) del Migraine-Specific Quality of Life Questionnaire (MSQ) e miglioramento del punteggio del Patient Global Impression of Severity (PGI-S) e del Migraine Disability Assessment (MIDAS; time point = mese 6) sono stati soddisfatti (Skljarevski et al., 2018). 147 (65,0%) e 163 (71,5%) dei pazienti trattati con galcanezumab, 120 e 240 mg, rispettivamente, e 287 (62,3%) con placebo hanno presentato eventi avversi, tra cui infarto miocardico acuto e attacco ischemico transitorio in un gruppo di sette pazienti in trattamento con galcanezumab 240 mg (Skljarevski et al., 2018). Non ci sono state differenze statisticamente significative nel cambiamento medio dal basale per la pressione sanguigna sistolica/diastolica. I 19 (8,6%), 11 (5,1%), e 2 (0,5%) pazienti nei gruppi galcanezumab 120 mg, galcanezumab 240 mg, e placebo, rispettivamente, hanno mostrato anticorpi antidroga (ADA) emergenti dal trattamento. Nello studio REGAIN di fase III che ha valutato galcanezumab contro l’emicrania cronica i MMD sono stati ridotti di 4,8 giorni con 120 mg e di 4,6 giorni con la dose di 240 mg rispetto ai 2,7 del placebo (vedi Yuan et al., 2017). Inoltre, il trattamento con galcanezumab si è dimostrato dotato di una persistenza statisticamente significativa dell’effetto (Forderreuther et al., 2018). Fremanezumab è stato studiato nel trial HALO di fase III per il trattamento preventivo dell’emicrania (ClinicalTrials.gov NCT02638103). Ha ridotto i MMD dell’emicrania episodica a 12 settimane di 3,7 giorni a 225 mg mensili per 3 mesi e di 3,4 giorni a 675 mg una volta in regime di dosaggio trimestrale rispetto alla diminuzione di 2,2 giorni del placebo (vedi Yuan et al., 2017). L’efficacia di erenumab nella prevenzione dell’emicrania episodica è stata studiata nello studio di fase 3, randomizzato, in doppio cieco, controllato con placebo ARISE (ClinicalTrials.gov NCT02483585). I MMD sono stati ridotti da 70 mg mensili di erenumab sottocutaneo di 2,9 giorni rispetto a 1,8 giorni di placebo (p < 0,001) ed è stato efficace negli endpoint secondari di almeno una riduzione del 50% dei MMD e del cambiamento dei giorni mensili di trattamento con farmaci specifici per l’emicrania (MSMD) (Dodick et al., 2018). La percentuale di pazienti che ha presentato eventi avversi è stata simile tra il gruppo trattato con il mAb e il placebo; il 4,3% è risultato positivo agli anticorpi leganti anti-erenumab fino alla settimana 12, uno dei quali transitoriamente positivo agli anticorpi neutralizzanti ma solo alla settimana 4 (Dodick et al., 2018). Anche lo studio clinico di fase III STRIVE (ClinicalTrials.gov NCT02456740) ha valutato l’efficacia di erenumab per la prevenzione dell’emicrania episodica. Erenumab è stato somministrato a 70 o 140 mg al mese per 6 mesi (Goadsby et al., 2017b). Il numero medio di MMD al basale era 8,3 e le dosi di 70 mg e 140 mg lo hanno ridotto rispettivamente di 3,2 e 3,7, rispetto a 1,8 giorni di placebo (con p < 0,001 per ogni dose vs. placebo) (Goadsby et al., 2017b). Anche negli ultimi 3 mesi di trattamento ogni dose di erenumab ha soddisfatto gli endpoint secondari di almeno una riduzione del 50% dal basale nel numero medio di giorni di emicrania al mese e la riduzione dal basale sia nel Migraine Physical Function Impact Diary (MPFID) everyday-activities (MPFID-EA) e physical-impairment (MPFID-PI) (Goadsby et al., 2017b). Nei pazienti con anticorpi anti-erenumab solo uno del gruppo trattato con 70 mg è risultato positivo agli anticorpi neutralizzanti e il mAb è stato complessivamente ben tollerato in termini di livelli di creatinina, tossicità epatica, conta dei neutrofili totali e funzione elettrocardiografica (Goadsby et al., 2017b). Secondo gli autori uno dei limiti di questo studio è che sono stati esclusi i pazienti che non avevano mostrato risposta terapeutica a più di due classi di farmaci per la prevenzione dell’emicrania (Goadsby et al., 2017b). Inoltre, esistono studi clinici che indagano l’efficacia di fremanezumab (NCT02945046 e NCT02964338) e galcanezumab (NCT 02397473 e NCT02438826) nella prevenzione della cefalea a grappolo (vedi Israel et al., 2018), ovvero la cefalea primaria caratterizzata da forte dolore unilaterale nell’area periorbitale accompagnato da lacrimazione, arrossamento congiuntivale e rinorrea (Vollesen et al., 2018). Infatti, è stato dimostrato che l’infusione endovenosa continua tramite pompa di infusione di 1,5 μg/min di CGRP per 20 min (in 2 giorni separati da almeno 7 giorni) a pazienti con cefalea a grappolo episodica (fase attiva o di remissione) o cronica ha elicitato attacchi di tipo cluster in pazienti in fase attiva o con cefalea a grappolo cronica, ma non in fase di remissione (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). I principali vantaggi PK dei mAbs sono rappresentati dalla lunga emivita di eliminazione che limita la necessità di un dosaggio giornaliero e dalla clearance per proteolisi. A causa degli effetti dei gepanti sul fegato e a causa delle proprietà vasodilatatorie del CGRP, i rischi più temuti dell’inibizione della segnalazione del CGRP consistono nell’ipotizzata epatotossicità e nel rischio teorico cardiovascolare (Yuan et al., 2017). La European Headache Federation (EHF) ha prodotto delle linee guida sull’uso dei mAbs anti-CGRP applicando il metodo Grading of Recommendation, Assessment, Development and Evaluation (GRADE) e, quando non possibile, affidandosi al parere di un panel di esperti (Sacco et al., 2019).
Rapporto Farmacocinetica (PK)/Farmacodinamica (PD) dei mAbs anti emicrania
Lo sviluppo dei mAbs ha rappresentato un approccio completamente nuovo per inibire la via del CGRP. Il principale miglioramento della PD ottenuto utilizzando i mAbs invece delle piccole molecole è che è più facile mirare all’ampio sito di legame recettore-ligando del CGRP (Taylor, 2018). I principali vantaggi di PK dei mAbs sono rappresentati dalla lunga emivita di eliminazione senza necessità di dosaggio giornaliero e dalla clearance per proteolisi e i rischi più temuti dell’inibizione della segnalazione del CGRP consistono nell’ipotizzata epatotossicità, per gli effetti dei gepanti sul fegato, e nel rischio teorico cardiovascolare, per le proprietà vasodilatatorie del CGRP. Tuttavia, seguendo il viaggio di questi mAbs dalla loro produzione al bersaglio, il primo ostacolo che queste molecole incontrano è la loro somministrazione a causa della loro scarsa biodisponibilità orale. Pertanto, è necessaria una via di somministrazione parenterale e, per favorire l’aderenza al trattamento, l’emivita deve essere lunga (Taylor, 2018). Le immunoglobuline (Ig)G1, 2, o 4 sono le possibilità (Wang et al., 2008; Taylor, 2018). Oltre all’origine delle IgG, l’eventuale cross-reattività e le modifiche individuali del catabolismo possono influenzare l’emivita (Bonilla, 2008; Taylor, 2018). La tecnologia utilizzata per produrre mAbs si basa sull’uso di ibridomi composti da cellule in divisione continua che producono cloni determinati di un unico tipo di anticorpo, con variabilità nulla o bassa (Taylor, 2018). In base all’origine degli amminoacidi che compongono il mAb, è possibile distinguere tra mAb chimerici (immunizzazione da roditori; mantenimento della regione Fab legante l’antigene del roditore Fragment, ma introduzione della regione cristallizzabile Fc del Fragment umano), umanizzati (zumabs, con Complementarity Determining Regions, CDRs, del topo innestate su regioni Fab umane) e umani (introduzione dell’intera sequenza del gene dell’anticorpo umano nel topo che diventa umanizzato, come per esempio lo XenoMouse) (vedi Taylor, 2018). I CDR influenzano l’adattamento al bersaglio. Tra i 4 mAbs anti emicrania solo erenumab è umano, mentre i CDR innestati sono di topo per fremanezumab, di coniglio per eptinezumab e probabilmente di topo per galcanezumab (vedi Taylor, 2018). In particolare, l’unico mAb anti recettore CGRP è erenumab, che è un IgG2λ umano, e gli altri tre mAb diretti contro i siti di CGRP sono: eptinezumab, un IgG1k umanizzato geneticamente ingegnerizzato; fremanezumab, un IgG2k umanizzato; galcanezumab, un IgG4 umanizzato (Edvinsson et al., 2018). Erenumab (Tmax 3-14 giorni) richiede una somministrazione sottocutanea mensile, così come fremanezumab (Tmax 3-20 giorni) e galcanezumab (Tmax 7-14 giorni) (Taylor, 2018). Al contrario, eptinezumab (Tmax 4,8 h) viene somministrato per via endovenosa una volta ogni 3 mesi; si associa più rapidamente e si dissocia più lentamente di fremanezumab e galcanezumab. Poiché i mAbs sono proteine di grandi dimensioni, non possono facilmente attraversare la BBB. Alcuni recettori CGRP sono al di fuori della BBB, permettendo così l’azione dei mAbs anti-CGRP (Edvinsson, 2018). Prima di legarsi, l’anticorpo entra nelle cellule endoteliali vascolari attraverso la pinocitosi. I grandi volumi di distribuzione apparente potrebbero dipendere dal tessuto e dalla relativa capacità di legame del mAb (Lobo et al., 2004; Taylor, 2018). Erenumab è l’approccio più innovativo, in quanto è l’unico a puntare una proteina di fusione dei domini extracellulari del recettore umano accoppiato alla proteina G calcitonin receptor-like CALCRL (richiesto nei recettori per CGRP e adrenomedullina) e RAMP1, compresa la tasca di legame per CGRP (Edvinsson et al., 2018). È stato dimostrato che inibisce competitivamente il legame di -CGRP al recettore CGRP umano in cellule di neuroblastoma umano (SK-N-MC) con un Ki di 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab ha esercitato un antagonismo potente e completo dell’accumulo di cAMP stimolato da CGRP con un IC50 di 2,3 ± 0,9 nM in saggi funzionali eseguiti in SK-N-MC (Shi et al., 2016). Inoltre, è risultato 5000 volte più selettivo per il recettore CGRP non mostrando alcun effetto agonista/antagonista su altri recettori umani della famiglia della calcitonina tra cui adrenomedullina, calcitonina e recettori dell’amilina fino alla massima concentrazione testata di 10 μM (Shi et al., 2016). Fremanezumab potrebbe esercitare il suo effetto su diversi vasi; infatti, provoca un’inibizione dipendente dalla concentrazione della vasodilatazione indotta da CGRP in arterie cerebrali umane precontratte, meningee e periferiche addominali (Ohlsson et al., 2018). Inoltre, il CGRP può agire anche su neuroni e cellule gliali e sul glymphatic (simil-linfatico), quest’ultimo implicato nell’espressione dell’aura (vedi Messlinger, 2018). La probabile assenza di metabolismo da parte degli enzimi epatici potrebbe evitare interazioni farmaco-farmaco. L’eliminazione avviene attraverso la proteolisi renale degli aminoacidi. Anche se gli studi clinici riportano che questi anticorpi sono complessivamente ben tollerati, a parte l’evidenziato dolore al sito di iniezione, c’è preoccupazione per la loro immunogenicità attraverso la produzione di ADA (Taylor, 2018). Durante uno studio clinico in doppio cieco, randomizzato, controllato con placebo (ClinicalTrials.gov NCT 01337596) che valutava il trattamento con diversi regimi di dosi singole e multiple di galcanezumab, 11 dei pazienti trattati (26%) hanno presentato titoli bassi (1:10 – 1:80) di ADA emergenti dal trattamento (in 3 pazienti gli anticorpi preesistenti sono aumentati di titolo), senza effetti dose-risposta e rilevati su PK e PD (Monteith et al., 2017). Lo studio dell’immunogenicità è essenziale perché la presenza di ADA può accelerare la rimozione del farmaco o, peggio, favorire il danno agli organi finali (Taylor, 2018). Le principali caratteristiche dei mAbs anti-migranina sono riassunte nella tabella 1.

Tabella 1. Principali caratteristiche di fremanezumab, eptinezumab, galcanezumab ed erenumab.
Conclusione
L’emicrania è una condizione dolorosa neurovascolare invalidante e debilitante che rappresenta più del 90% dei casi di mal di testa ricorrente e verso la quale la tendenza può essere ereditata (MacGregor, 2017). Divalproex sodio, valproato di sodio, topiramato, metoprololo, propranololo e timololo hanno dimostrato una forte, livello A, evidenza per la prevenzione dell’emicrania (American Academy of Neurology e American Headache Society, 2015). Tuttavia, tutti i classici trattamenti preventivi orali tra cui antidepressivi triciclici, betabloccanti, ergotici antagonisti 5-HT2 e farmaci antiepilettici non sono stati sviluppati per l’emicrania e forniscono una riduzione del 50% del numero di giorni mensili di dolore emicranico solo fino al 45% degli emicranici (D’Amico e Tepper, 2008), anche a causa della bassa aderenza dovuta alla scarsa tollerabilità. La persistenza e l’interruzione dei farmaci è stata esaminata in un’analisi retrospettiva dei sinistri negli Stati Uniti (Hepp et al., 2017) e i risultati suggeriscono una bassa persistenza al farmaco iniziale utilizzato e un’elevata quantità di interruzioni entro i 6 mesi indipendentemente dalla classe del farmaco. A causa del ruolo fondamentale del CGRP nel sostenere la neuroinfiammazione e la sensibilizzazione centrale nel percorso dal ganglio trigemino e dal tronco cerebrale alle regioni superiori coinvolte nella fisiopatologia dell’emicrania, sono stati sviluppati nuovi mAbs verso il CGRP e il suo recettore. Le prime piccole molecole antagoniste del CGRP hanno mostrato di indurre tossicità epatica, ma i mAbs non hanno prodotto né metaboliti tossici né reazioni collaterali cardiovascolari a causa dell’inibizione della vasodilatazione (vedi Deen et al., 2017). Anche gli effetti collaterali centrali non sono stati evidenziati. I potenziali effetti a lungo termine del blocco del CGRP devono ancora essere studiati ma, un vantaggio fondamentale di questi anticorpi deriva dalla loro lunga emivita che permette iniezioni mensili o meno frequenti, il che può migliorare notevolmente l’aderenza al trattamento e la sua successiva efficacia (Deen et al., 2017). Pertanto, i mAbs anti-CGRP potrebbero rappresentare strumenti efficaci nell’arsenale terapeutico contro l’emicrania non responsiva; tuttavia, è obbligatorio un monitoraggio approfondito dell’efficacia e della sicurezza (cioè, produzione di metaboliti tossici, immunogenicità con ADA, anticorpi neutralizzanti e cross-reattività tissutale ed effetti collaterali) (Taylor, 2018). Infatti, le evidenze di vecchi prodotti biotecnologici mostrano che le terapie con mAbs anti-tumor necrosis factor α (TNFα) possono essere soggette a fallimenti secondari (in contrasto con i non-responders primari) della risposta terapeutica iniziale perché questi farmaci inducono la produzione di anticorpi che possono degradare il mAb ma possono anche neutralizzare la sua azione prima di legarsi al target (vedi Prado et al., 2017). L’immunogenicità può essere influenzata dalla glicosilazione, dal tipo di mAb, dal numero di epitopi e dalle impurità nella formulazione (vedi Prado et al., 2017). Inoltre, diversi effetti collaterali gravi apparentemente inspiegabili sono associati all’immunogenicità degli anti-TNFα. Sono state evidenziate reazioni di ipersensibilità locale e sistemica, immunodeficienza con aumento della suscettibilità alle infezioni e formazione di immunocomplessi che possono portare anche alla morte (vedi Prado et al., 2017). Pertanto, l’uso della diagnostica terapeutica (theranostics) può migliorare la conoscenza e la corretta gestione di questi dispositivi farmacologici (Bendtzen, 2013; Prado et al., 2017).
Contributi degli autori
MTC, LAM, PT, e GB hanno concepito lo studio. DS ha raccolto i risultati dello studio, ha analizzato la letteratura e ha scritto il manoscritto. AA, LR, e MN hanno partecipato all’indagine della letteratura. Tutti gli autori hanno letto e approvato il manoscritto finale.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
American Academy of Neurology and American Headache Society (2015). Appendice a: riassunto della linea guida basata sull’evidenza per i clinici, aggiornamento: trattamento farmacologico per la prevenzione dell’emicrania episodica negli adulti. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Medicina personalizzata: theranostics (diagnostica terapeutica) essenziale per l’uso razionale di antagonisti del fattore di necrosi tumorale-alfa. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmacocinetica di immunoglobuline somministrate per via endovenosa o sottocutanea. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaboratori, G. B. D. H. (2018). Carico globale, regionale e nazionale dell’emicrania e della cefalea di tipo tensivo, 1990-2016: un’analisi sistematica per il global burden of disease study 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., e Tepper, S. J. (2008). Profilassi dell’emicrania: principi generali e l’accettazione del paziente. Neuropsichiatr. Dis. Trattare. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Bloccare CGRP in pazienti con emicrania – una revisione dei pro e dei contro. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: uno studio randomizzato di fase 3 di erenumab per l’emicrania episodica. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Cambiamenti vascolari extracranici e la fonte del dolore nell’emicrania. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., e Porreca, F. (2014). Targeting canali TRP per i nuovi terapeutici emicrania. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). Antagonisti del recettore CGRP e anticorpi contro CGRP e il suo recettore nel trattamento dell’emicrania. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). Il percorso CGRP nell’emicrania come un bersaglio valido per le terapie. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). CGRP come bersaglio di nuove terapie per l’emicrania – traduzione di successo dal banco alla clinica. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., and Edvinsson, L. (2013). Differenziazione delle fibre nervose che memorizzano CGRP e recettori CGRP nel sistema trigeminovascolare periferico. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., e Premkumar, L. S. (2012). Sumatriptan inibisce i canali TRPV1 nei neuroni trigeminali. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., and Goadsby, P. J. (2001). Triptani orali (agonisti della serotonina 5-HT(1B/1D)) nel trattamento dell’emicrania acuta: una meta-analisi di 53 studi. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Gli effetti preventivi di galcanezumab in pazienti adulti con emicrania episodica o cronica sono persistenti: dati dagli studi di fase 3, randomizzati, in doppio cieco, controllati con placebo EVOLVE-1, EVOLVE-2, e REGAIN. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). Calcitonin gene-related peptide receptor come nuovo target per la gestione delle persone con emicrania episodica: evidenze attuali e profilo di sicurezza di erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). Farmaci emergenti per il trattamento dell’emicrania. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Vasoactive rilascio di peptidi nella circolazione extracerebrale degli esseri umani durante l’emicrania. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). Fisiopatologia dell’emicrania: un disturbo dell’elaborazione sensoriale. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Uno studio controllato di erenumab per l’emicrania episodica. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistenza e modelli di commutazione di farmaci orali profilattici per l’emicrania tra i pazienti con emicrania cronica: un’analisi retrospettiva delle richieste. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomizzato, studio controllato di telcagepant in pazienti con emicrania e malattia coronarica. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). Anticorpi monoclonali CGRP per il trattamento preventivo dell’emicrania. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., e Martelletti, P. (2018). Farmaci emergenti per il trattamento dell’emicrania: un aggiornamento. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002). CGRP può svolgere un ruolo causale nell’emicrania. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Farmacocinetica e farmacodinamica degli anticorpi. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Emicrania. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). L’applicazione degli anticorpi monoclonali CGRP(r) nello spettro dell’emicrania: necessità e priorità. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Il grande diluvio CGRP – fonti, lavandini e siti di segnalazione nel sistema trigeminovascolare. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Sicurezza, tollerabilità, farmacocinetica e farmacodinamica dell’anticorpo monoclonale legante CGRP LY2951742 (Galcanezumab) in volontari sani. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., e Edvinsson, L. (2018). Fremanezumab blocca la dilatazione indotta da CGRP nelle arterie cerebrali, meningee medie e addominali umane. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., e Andrade, L. E. C. (2017). Farmaci biologici anti-TNF: immunogenicità alla base del fallimento del trattamento ed eventi avversi. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Calcitonin gene-related peptide: fisiologia e fisiopatologia. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primary results of PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) trial: a phase 3, randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of eptinezumab for prevention of frequent episodic migraines (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Caratterizzazione farmacologica di AMG 334, un anticorpo monoclonale umano potente e selettivo contro il recettore del peptide legato al gene della calcitonina. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). Efficacia e sicurezza di galcanezumab per la prevenzione dell’emicrania episodica: risultati dello studio clinico controllato randomizzato di fase 3 EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., e Conley, R. R. (2018). Valutazione di galcanezumab per la prevenzione dell’emicrania episodica: lo studio clinico randomizzato EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., e Katsarava, Z. (2018). L’emicrania è la prima causa di disabilità in under 50s: i politici della salute ora prenderanno nota? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amilina, immunologia e medicina delle cefalee. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Biomarcatori di emicrania nel liquido cerebrospinale: una revisione sistematica e meta-analisi. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Effetto dell’infusione di peptide legato al gene della calcitonina sugli attacchi di cefalea a grappolo: uno studio clinico randomizzato. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). Regolazione della trasduzione del segnale da parte dei recettori del peptide legato al gene della calcitonina. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Farmacocinetica e farmacodinamica degli anticorpi monoclonali. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neuroinfiammazione neurogenica: reazioni infiammatorie CNS in risposta all’attività neuronale. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., e Silberstein, S. D. (2017). Anticorpi monoclonali CGRP per l’emicrania: razionale e progressi. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar