Le complicazioni meccaniche dell’infarto miocardico acuto (IMA) sono il difetto del setto ventricolare (VSD), la rottura o disfunzione del muscolo papillare, la rottura della parete libera del cuore, l’aneurisma ventricolare, l’ostruzione dinamica del tratto di efflusso del ventricolo sinistro (LV) e l’insufficienza ventricolare destra (RV). Tutte queste condizioni potrebbero potenzialmente portare all’insufficienza ventricolare sinistra con shock cardiogeno.
Una comprensione approfondita delle complicazioni meccaniche dell’IMA e dei loro fattori di rischio può aiutare i medici a fare una diagnosi precoce. Per i risultati favorevoli del paziente, è necessaria una diagnosi tempestiva con una terapia medica appropriata e un intervento chirurgico tempestivo. Fattori importanti per la mortalità in ospedale da complicazioni meccaniche di MI includono età avanzata, shock cardiogeno e insufficienza cardiorespiratoria.
Rottura della parete libera ventricolare
La VFWR è la complicazione più grave dell’IMA. La VFWR è di solito associata a grandi infarti transmurali e all’espansione antecedente dell’infarto. È la causa più comune di morte, seconda solo all’insufficienza ventricolare, e rappresenta il 15-30% dei decessi associati all’IMA. Incontrovertibilmente il più catastrofico delle complicazioni meccaniche, VFWR porta a emopericardio acuto e morte per tamponamento cardiaco.
L’incidenza complessiva di VFWR varia da 0,8-6,2%. L’incidenza di questa complicazione è diminuita nel corso degli anni con un migliore controllo della pressione sanguigna sistolica nelle 24 ore, un maggiore uso della terapia di riperfusione, beta-bloccanti e ACE-inibitori e un minore uso dell’eparina.
I dati del National Registry of Myocardial Infarction (NRMI) hanno mostrato un’elevata incidenza di mortalità in ospedale tra i pazienti che hanno ricevuto la terapia trombolitica (12,1%) rispetto ai pazienti che non l’hanno ricevuta (6,1%). Nello studio Thrombolysis in Myocardial Infarction Phase II (TIMI II), il 16% dei pazienti è morto per rottura cardiaca entro 18 ore dalla terapia. I pazienti sottoposti ad angioplastica coronarica percutanea transluminale (PTCA) avevano un’incidenza di rottura della parete libera inferiore a quella dei pazienti sottoposti a terapia trombolitica.
I fattori di rischio per la VFWR includono età avanzata superiore a 70 anni, sesso femminile, nessun precedente MI, onde Q sull’ECG, ipertensione durante la fase iniziale dello STEMI, uso di corticosteroidi o FANS e terapia fibrinolitica più di 14 ore dopo l’inizio dello STEMI. I pazienti con una storia di angina pectoris, precedente AMI, malattia coronarica multivaso e insufficienza cardiaca cronica hanno meno probabilità degli altri di sviluppare VFWR del LV perché sviluppano collaterali e precondizionamento ischemico.
Presentazione clinica della VFWR
Le VFWR sono drammatiche; si presentano acutamente o occasionalmente subacutamente come pseudoaneurismi; e più spesso coinvolgono la parete anteriore o laterale del LV. La maggior parte dei VFWRs si verificano entro la prima settimana dopo AMI.
Becker et al ha classificato i seguenti 3 tipi di VFWRs:
-
Tipo I – una brusca lacerazione simile a una fessura che è frequentemente associata a infarti anteriori e che si verifica presto (entro 24 ore)
-
Tipo II – un’erosione del miocardio infartuato al confine tra il miocardio infartuato e quello vitale
-
Tipo III – una formazione precoce di un aneurisma correlato a infarti più vecchi e gravemente espansi
Il tipo III di solito si verifica dopo le rotture di tipo I o II. La terapia trombolitica accelera il verificarsi della rottura cardiaca in Becker tipo I e tipo II VFWRs. Negli infarti gravemente espansi (tipo III), la terapia trombolitica diminuisce l’incidenza della rottura cardiaca.
Uno pseudoaneurisma si forma quando il pericardio adiacente e l’ematoma sigillano una rottura o perforazione miocardica. La parete di uno pseudoaneurisma è più spesso visualizzato come un outpouching aneurismatico che comunica con la cavità LV per mezzo di un collo stretto. Questa parete è composta da pericardio e trombo organizzato e/o ematoma. È privo di elementi miocardici, mentre un vero aneurisma ha tutti gli elementi della parete miocardica originale e una base relativamente ampia. Lo pseudoaneurisma può variare in dimensioni ed è ad alto rischio di rottura.
Le presentazioni cliniche della VFWR variano a seconda dell’acuità, della posizione e delle dimensioni della rottura. I pazienti con VFWR acuta presentano un forte dolore toracico, una brusca dissociazione elettromeccanica o asistolia, un collasso emodinamico e possibilmente la morte. In circa un terzo dei pazienti, il decorso è subacuto, e presentano sintomi come sincope, ipotensione, shock, aritmia e dolore toracico prolungato e ricorrente.
Diagnosi della VFWR
La diagnosi precoce delle VFWR e l’intervento sono fondamentali per la sopravvivenza del paziente. Un alto indice di sospetto è richiesto quando i pazienti con AMI si presentano con grave dolore toracico, shock o aritmie, e sviluppo improvviso di dissociazione elettromeccanica. I segni ECG di VFWR imminente hanno una specificità limitata ma includono tachicardia sinusale, difetto di conduzione intraventricolare, e persistente o ricorrente elevazione del segmento ST.
L’ecocardiografia è lo strumento diagnostico di scelta. Il risultato diagnostico chiave è un versamento pericardico da moderato a grande con segni clinici ed ecocardiografici di imminente tamponamento pericardico. Nei pazienti con tamponamento cardiaco e dissociazione elettromeccanica, il versamento pericardico da moderato a grave aumenta il rischio di mortalità. Quei pazienti senza tamponamento cardiaco iniziale, pur avendo un tasso di mortalità più basso, dovrebbero comunque essere seguiti, poiché la rottura tardiva può ancora verificarsi. L’assenza di versamento pericardico all’ecocardiografia ha un alto valore predittivo negativo. Se la capacità di ottenere ecocardiogrammi transtoracici è limitata nei pazienti che ricevono la ventilazione meccanica, l’ecocardiografia transesofagea può aiutare a confermare la VFWR.
La risonanza magnetica fornisce una qualità d’immagine superiore e permette di identificare il sito e l’anatomia di uno pseudoaneurisma ventricolare (cioè, la rottura del LV trattenuto dal pericardio con coagulo incluso). Tuttavia, la risonanza magnetica è di uso limitato nell’impostazione acuta a causa del tempo coinvolto e la non portabilità delle unità di imaging.
Trattamento della VFWR
La strategia di prevenzione più importante è la terapia di riperfusione precoce, con intervento coronarico percutaneo (PCI) è la modalità preferita. La terapia fibrinolitica è associata a una diminuzione generale del rischio di VFWR; tuttavia, il suo uso più di 14 ore dopo l’inizio dello STEMI può aumentare il rischio di rottura precoce.
Il trattamento standard per la VFWR è la riparazione chirurgica di emergenza dopo aver raggiunto la stabilità emodinamica. I pazienti possono prima aver bisogno di fluidi per via endovenosa, agenti inotropi e pericardiocentesi di emergenza.
Pifarré e soci hanno raccomandato l’impiego di una pompa a palloncino intra-aortica per diminuire il postcarico sistolico e migliorare la perfusione miocardica diastolica.
Sono state applicate diverse tecniche chirurgiche, tra cui l’infarctomia, l’adesione con cerotti di colla biologica in fibra di poliestere polietilene tereftalato (Dacron; DuPont, Wilmington, DE) o resina di politetrafluoroetilene fluoropolimero (Teflon; DuPont); e uso di suture pledgeted senza infarctomia.
Il tasso di mortalità è significativamente alto e dipende in gran parte dallo stato emodinamico preoperatorio del paziente. La diagnosi precoce, la rapida istituzione delle misure sopra descritte per raggiungere la stabilità emodinamica e la pronta riparazione chirurgica possono migliorare i tassi di sopravvivenza. Un follow-up dello studio randomizzato Acorn ha dimostrato un miglioramento a lungo termine della struttura e della funzione ventricolare sinistra dopo la chirurgia della valvola mitrale fino a 5 anni. Questi dati forniscono prove a sostegno della riparazione della valvola mitrale in combinazione con il dispositivo Acorn CorCap per i pazienti con insufficienza cardiaca non ischemica con grave disfunzione ventricolare sinistra che sono stati ottimizzati dal punto di vista medico ma rimangono sintomatici con un significativo rigurgito mitrale.
Rottura del setto ventricolare
VSR è una complicazione infrequente ma pericolosa per la vita di AMI. Nonostante il trattamento medico e chirurgico ottimale, i pazienti con VSR hanno un alto tasso di mortalità in ospedale. Durante l’era prethrombolytic, VSRs si è presentato in 1-3% degli individui con i MIs. L’incidenza è diminuita con la terapia trombolitica (a 0.2-0.34%) a causa dei miglioramenti nella riperfusione e nel salvataggio miocardico. La distribuzione bimodale di VSR è caratterizzata da un’alta incidenza nelle prime 24 ore, con un altro picco nei giorni 3-5 e raramente più di 2 settimane dopo AMI.
Nei pazienti che ricevono trombolitici, il tempo mediano dall’insorgenza dei sintomi dell’IMA alla rottura del setto era di 1 giorno nello studio Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) e di 16 ore nello studio Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK).
I fattori di rischio per la rottura del setto includono l’età avanzata (>65 anni), il sesso femminile, la malattia monovascolare, il MI esteso e la scarsa circolazione collaterale del setto. Prima dell’avvento dei trombolitici, l’ipertensione e l’assenza di una storia di angina erano fattori di rischio per VSR. Dimensioni estese dell’infarto e coinvolgimento della RV sono altri fattori di rischio noti per la rottura del setto.
Nei pazienti con IMA senza riperfusione, la necrosi della coagulazione si sviluppa entro 3-5 giorni dopo l’infarto. I neutrofili migrano nella zona necrotica e subiscono l’apoptosi, rilasciano enzimi litici e accelerano la disintegrazione del miocardio necrotico. Alcuni pazienti hanno infarti con grandi ematomi intramurali, che si dissecano nel tessuto e provocano la rottura precoce del setto. La dimensione della rottura settale varia da pochi millimetri a diversi centimetri.
VSR è classificato come semplice o complesso a seconda della sua lunghezza, corso e posizione. Nella rottura del setto semplice, la perforazione è allo stesso livello su entrambi i lati del setto, e una comunicazione diretta attraverso il setto è presente. Una rottura settale complessa è caratterizzata da una vasta emorragia con irregolare, tratti serpiginosi nel tessuto necrotico.
Le rotture settali sono più comuni nei pazienti con grandi MI anteriore a causa di occlusione dell’arteria LAD causando estesi infarti settali. Questi infarti sono associati con ST-segmento elevazioni e onde Q in porta inferiore (II, III, aVF) e questi cambiamenti ECG sono quindi più comunemente visto in rotture settali. Queste rotture sono generalmente apicale e semplice.
Rotture settali in pazienti con MI inferiore si verificano relativamente raramente. Queste rotture coinvolgono il setto basale inferoposteriore e sono spesso complesse.
Presentazione clinica del VSR
I sintomi del VSR che complica l’IMA includono dolore toracico, mancanza di respiro, ipotensione, insufficienza biventricolare e shock entro ore o giorni. I pazienti spesso si presentano con un nuovo, forte e duro murmure olosistolico. Questo soffio è più forte lungo il bordo sternale sinistro inferiore ed è associato a un brivido sistolico parasternale palpabile. RV e LV S3 galoppi sono comuni.
In pazienti con shock cardiogeno complicando la rottura del setto, il soffio e il brivido può essere difficile da identificare. Al contrario, i pazienti con risonanza magnetica acuta hanno spesso un soffio sistolico morbido all’apice senza un brivido.
Diagnosi del VSR
L’ecocardiografia con color flow Doppler imaging è lo strumento diagnostico di scelta per identificare un VSR. (La sua sensibilità e specificità sono state riportate fino al 100%. Inoltre, può essere utilizzato per quanto segue:
-
Definire la sede e le dimensioni della rottura del setto
-
Valutare la funzione di LV e RV funzione
-
Stimare la pressione sistolica di RV
-
Quantificare lo shunt
Il cateterismo cardiaco è solitamente necessario per confermare la diagnosi, quantificare il grado di shunt da sinistra a destra, differenziare la VSR da altre condizioni (ad esempio, rigurgito mitrale), oltre a visualizzare le arterie coronarie.
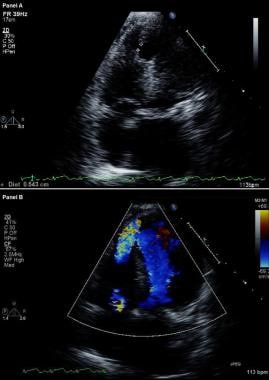 Complicazioni dell’infarto miocardico. Ecocardiogramma bidimensionale modificato (in alto) e immagine color-flow Doppler (in basso). Vista apicale a quattro camere mostra una breccia nel setto interventricolare e comunicazione libera tra i ventricoli attraverso un grande difetto del setto ventricolare del setto apicale in un paziente che recentemente ha avuto un infarto miocardico anteriore.
Complicazioni dell’infarto miocardico. Ecocardiogramma bidimensionale modificato (in alto) e immagine color-flow Doppler (in basso). Vista apicale a quattro camere mostra una breccia nel setto interventricolare e comunicazione libera tra i ventricoli attraverso un grande difetto del setto ventricolare del setto apicale in un paziente che recentemente ha avuto un infarto miocardico anteriore. Nei pazienti con VSR, il cateterismo del cuore destro mostra uno step-up nella saturazione di ossigeno dall’atrio destro al RV; al contrario, nessun step-up nella saturazione di ossigeno si verifica tra i pazienti con MR. La presenza di grandi onde V nel tracciato del cuneo capillare polmonare supporta la diagnosi di MR acuta grave.
La ventricolografia sinistra può anche essere usata per identificare il sito della rottura ventricolare (vedi Cateterismo cardiaco). Tuttavia, questo studio di solito non è necessario dopo un esame ecocardiografico e Doppler di buona qualità è condotto.
Trattamento della VSR
La chiave per la gestione della VSR è la diagnosi rapida e un approccio aggressivo alla stabilizzazione emodinamica, angiografia e chirurgia. L’approccio ottimale comprende la stabilizzazione emodinamica con la somministrazione di ossigeno e supporto meccanico con l’uso di una pompa a palloncino intra-aortica, così come la somministrazione di vasodilatatori (per ridurre il postcarico e quindi la pressione del LV e lo shunt sinistra-destra), diuretici e agenti inotropi.
Cateterismo cardiaco è necessario per definire l’anatomia coronarica; questo è seguito dalla riparazione chirurgica urgente.
In uno studio di 52 pazienti consecutivi con rottura del setto ventricolare postinfarto che è stato riparato chirurgicamente, i ricercatori hanno trovato che il tasso di mortalità di 30 giorni era 36% (n = 19). La maggior parte dei pazienti che sono sopravvissuti per meno di 30 giorni aveva uno stato di shock preoperatorio. I ricercatori concludono che per i pazienti con rottura del setto ventricolare sono necessari un miglioramento preoperatorio dello stato di shock e una rivascolarizzazione coronarica aggressiva.
La terapia medica è intesa solo per la stabilizzazione temporanea prima dell’intervento chirurgico, poiché le condizioni della maggior parte dei pazienti si deteriorano rapidamente e muoiono in assenza di un intervento chirurgico. Nello studio GUSTO-I, il tasso di mortalità a 30 giorni era inferiore nei pazienti con VSR sottoposti a riparazione chirurgica rispetto ai pazienti trattati medicalmente (47% vs 94%), così come il tasso di mortalità a 1 anno (53% vs 97%). Lemery et al hanno riportato un tasso di sopravvivenza a 30 giorni del 24% nei pazienti trattati medicalmente rispetto al 47% in quelli trattati chirurgicamente.
Le linee guida dell’American College of Cardiology/American Heart Association (ACC/AHA) per il trattamento dei pazienti con rottura del setto complicante l’IMA evidenziano un intervento chirurgico urgente, indipendentemente dal loro stato clinico. La gestione chirurgica della rottura del setto include i seguenti elementi:
-
Stabilimento rapido del bypass cardiopolmonare ipotermico
-
Un approccio alla rottura del setto attraverso l’area dell’infarto e l’escissione di tutti i margini necrotici e friabili del setto e delle pareti ventricolari per evitare emorragie post-operatorie, difetti residui del setto, o entrambi
-
Ricostruzione del setto e delle pareti ventricolari utilizzando materiale protesico e conservazione della configurazione geometrica dei ventricoli e della funzione cardiaca
La chiusura percutanea della rottura del setto è un approccio relativamente nuovo, utilizzato in pazienti selezionati come alternativa alla riparazione chirurgica o per la stabilizzazione acuta di pazienti critici. Tuttavia, la chiusura percutanea non è attualmente disponibile in molte istituzioni, e non sono disponibili dati sui risultati a lungo termine.
Diversi studi non sono riusciti a mostrare una relazione tra la mortalità perioperatoria e la rivascolarizzazione coronarica concomitante (innesto di bypass coronarico). I pazienti con shock cardiogeno dovuto alla rottura del setto hanno l’esito peggiore. Nello studio SHOCK, il tasso di mortalità in ospedale era più alto nei pazienti con shock cardiogeno dovuto alla rottura del setto (87,3%) rispetto ai pazienti con shock cardiogeno per tutte le altre cause (59,2% con insufficienza cardiaca pura e 55,1% con MR acuta).
Nei pazienti che sopravvivono alla riparazione chirurgica, il tasso di difetto settale ricorrente o residuo è riportato come circa il 28%, e il tasso di mortalità associato è alto.
L’intervento chirurgico ripetuto è indicato nei pazienti che hanno insufficienza cardiaca clinica o una frazione polmonare-sistemica maggiore di 2.
Rigurgito mitralico acuto
La MR è una complicazione comune dell’IMA che risulta dal rimodellamento locale e globale del LV e che è un predittore indipendente di insufficienza cardiaca e morte. MR in genere si verifica 7-10 giorni dopo un IMA, anche se questo inizio può variare a seconda del meccanismo di MR. Rottura del muscolo papillare con conseguente MR si verifica entro 1-14 giorni (mediana, 1 d).
Mild-to-moderate MR è spesso clinicamente silenzioso e rilevato su ecocardiografia Doppler eseguita durante la fase iniziale di AMI. In tali casi, MR raramente causa compromissione emodinamica.
Speckle tracking ed ecocardiografia tridimensionale ha dimostrato di essere importanti strumenti di imaging nella valutazione del rimodellamento inverso LV dopo chirurgia degenerativa rigurgito della valvola mitrale. Sottili cambiamenti regionali preoperatori nella funzione diastolica del setto e della parete laterale potrebbero essere identificati preoperatoriamente, aiutando a ottimizzare i tempi di rinvio e riconoscere i potenziali colpevoli come indicatori di recidiva della malattia dopo la riparazione mitrale.
La MR acuta grave che deriva dalla rottura dei muscoli papillari o delle corde tendinee comporta un brusco deterioramento emodinamico con shock cardiogeno. Diagnosi rapida, stabilizzazione emodinamica e pronto intervento chirurgico sono necessari perché acuta grave MR è associato ad un alto tasso di mortalità.
L’incidenza riportata di MR può variare a causa di diversi fattori, compresi i metodi diagnostici utilizzati, la presenza o l’assenza di insufficienza cardiaca, il grado di MR riportato, il tipo di terapia resa, e il tempo dall’insorgenza dell’infarto al test.
Durante lo studio GUSTO-I, l’incidenza di MR in pazienti che ricevono la terapia trombolitica era 1,73%. Lo studio SHOCK, che includeva pazienti con MI che presentavano shock cardiogeno, ha notato un’incidenza del 39,1% di MR da moderata a grave. Kinn et al hanno riferito che la riperfusione con angioplastica ha portato a una diminuzione dell’82% del tasso di MR acuta, rispetto alla terapia trombolitica (0,31% vs 1,73%).
I fattori di rischio per MR sono l’età avanzata, il sesso femminile, l’infarto di grandi dimensioni, l’IMA precedente, l’ischemia ricorrente, la coronaropatia multivasale e l’insufficienza cardiaca.
Diversi meccanismi possono causare MR dopo AMI. Rottura del muscolo papillare è il meccanismo più comunemente segnalato.
Tale rottura si verifica nell’1% dei pazienti con IMA e frequentemente coinvolge il muscolo papillare posteromediale piuttosto che il muscolo papillare anterolaterale, come il primo ha un unico rifornimento di sangue contro la doppia alimentazione per il secondo. La rottura del muscolo papillare può portare al flailing o al prolasso dei foglietti, con conseguente grave MR. La disfunzione del muscolo papillare dovuta alla cicatrizzazione o all’ischemia ricorrente può anche portare a MR nelle fasi subacute e croniche dopo il MI; questa condizione può risolversi spontaneamente.
Grandi infarti posteriori producono MR acuta a causa della dilatazione anulare asimmetrica e della funzione e geometria alterata del muscolo papillare.
Presentazione clinica di MR
I pazienti con MR funzionale lieve o moderata sono spesso asintomatici. La gravità dei sintomi varia a seconda della funzione ventricolare. Le caratteristiche cliniche della MR acuta grave includono mancanza di respiro, affaticamento, un nuovo soffio apicale olosistolico, edema polmonare lampeggiante e shock.
Il nuovo soffio sistolico può essere solo precocemente o mediamente sistolico, non olosistolico. Può essere morbido o addirittura assente a causa del brusco aumento della pressione atriale sinistra, che riduce il gradiente di pressione tra l’atrio sinistro e il LV, rispetto alla MR cronica. Il murmure si sente meglio all’apice piuttosto che al bordo sternale sinistro inferiore ed è raramente associato a un brivido. I galoppi S3 e S4 sono attesi.
Diagnosi della MR
Il clinico non può basarsi su un nuovo soffio olosistolico per diagnosticare la MR o valutarne la gravità a causa dello stato emodinamico variabile. In un paziente con AMI che si presenta con un nuovo soffio sistolico apicale, edema polmonare acuto e shock cardiogeno, un alto indice di sospetto clinico per MR grave è la chiave per la diagnosi.
La radiografia del torace può mostrare evidenza di edema polmonare in ambiente acuto senza ingrandimento cardiaco clinicamente significativo.
L’ecocardiografia con color flow Doppler è lo strumento diagnostico standard per rilevare MR. L’ecocardiografia transtoracica è lo strumento di screening iniziale preferito, ma l’ecocardiografia transesofagea è preziosa per definire la gravità e l’esatto meccanismo della MR acuta, soprattutto quando il sospetto di rottura del muscolo papillare è alto. Il cateterismo cardiaco dovrebbe essere eseguito in tutti i pazienti per determinare l’estensione e la gravità della malattia coronarica.
Trattamento della MR
La determinazione della stabilità emodinamica, la chiarificazione dell’esatto meccanismo della MR acuta e una terapia rapida sono tutti necessari per un esito favorevole. La gestione medica comprende la riduzione del postcarico con l’uso di diuretici, nitroprussiato di sodio e nitrati in pazienti che non sono ipotensivi.
In pazienti che hanno compromissione emodinamica, contropulsazione con palloncino intra-aortico dovrebbe essere distribuito rapidamente. Questo intervento di solito riduce sostanzialmente il postcarico e il volume del rigurgito, migliorando la portata cardiaca in preparazione della riparazione chirurgica. Senza riparazione chirurgica, la sola terapia medica nei pazienti con rottura del muscolo papillare comporta un miglioramento emodinamico inadeguato e una prognosi a breve termine scadente.
L’intervento chirurgico d’urgenza è il trattamento di scelta per la rottura del muscolo papillare. Gli approcci chirurgici possono includere la riparazione o la sostituzione della valvola mitrale. In assenza di necrosi del muscolo papillare, la riparazione della valvola mitrale migliora il tasso di sopravvivenza più della sostituzione della valvola mitrale. Questa differenza è dovuta al fatto che l’apparato subvalvolare è solitamente conservato. La riparazione della valvola mitrale elimina anche le complicazioni legate al malfunzionamento della protesi.
In pazienti con necrosi estesa del muscolo papillare e/o della parete libera ventricolare, la sostituzione della valvola mitrale è la modalità preferita. L’innesto di bypass coronarico (CABG) eseguito al momento dell’intervento ha dimostrato in uno studio di migliorare la sopravvivenza a breve e lungo termine.
L’unica situazione in cui l’intervento chirurgico di emergenza può essere tranquillamente evitato è in caso di MR intermittente dovuta a ischemia ricorrente. In questi pazienti, una rivascolarizzazione miocardica di successo può essere efficace. Questa procedura è realizzata mediante angioplastica o innesto di bypass coronarico.
LVOTO dinamico
Originariamente pensato per essere presente solo nella cardiomiopatia ipertrofica, vari ricercatori hanno segnalato la presenza di LVOTO dinamico come complicazione del MI anteriore acuto. La presenza di LVOTO dinamico è stato anche postulato per essere una delle eziologie per la rottura miocardica.
Dynamic LVOTO è meccanicamente causata da hyperkinesis compensatoria del basale e mezzeria del LV in pazienti con infarti LAD distale. Predittori di movimento della parete regionale migliorata in zone non infartuati sono l’assenza di malattia multivaso, il sesso femminile, e più alto flusso nel vaso infartuato-correlato. L’aumento della forza contrattile del miocardio basale provoca rigurgito mitrale attraverso l’effetto Venturi. Questo si traduce in OTO aumentata, portando ad un’ulteriore riduzione della produzione di LV nell’impostazione di ipoperfusione sistemica già presente.
Questo aumento LVOTO nell’impostazione del miocardio transmurale danneggiato forma un ambiente perfetto in cui vi è un aumento della pressione intraventricolare end-sistolica, che induce un aumento dello stress di parete della zona infartuale indebolita e necrotica. Questa complicazione, spesso fatale, si verifica più spesso nelle donne, nei pazienti più anziani (>70 anni) e in quelli senza precedente MI.
Presentazione clinica della LVOTO
I pazienti colpiti possono avere i soliti sintomi di un complesso di sintomi autonomici aumentati, come distress respiratorio, diaforesi ed estremità fredde e umide, oltre ai segni e sintomi tipici dell’AMI.
Questi pazienti possono progredire rapidamente verso lo shock cardiogeno con grave ortopnea, dispnea e oliguria, e possono avere uno stato mentale alterato da ipoperfusione cerebrale. I pazienti possono presentare un nuovo murmure sistolico di eiezione, un nuovo murmure olosistolico che si irradia all’ascella come risultato del movimento sistolico anteriore (SAM) del foglietto mitrale. Possono essere presenti anche un galoppo S3, rantoli polmonari, ipotensione e tachicardia; questi ultimi segni fisici possono essere del tutto assenti nella fase acuta.
L’ecocardiografia transtoracica o transesofagea (TTE/TEE) è il test diagnostico di scelta e può caratterizzare accuratamente il segmento ipercinetico, la LVOTO e la SAM del foglietto mitrale.
Trattamento della LVOTO
Considerare la riduzione dell’ipercontrattilità del miocardio utilizzando un’attenta aggiunta di beta-blocco. Anche la rianimazione lenta del volume con l’aumento del postcarico (fenileferina) può aumentare il precarico e diminuire LVOTO e SAM. Sarebbe meglio evitare i farmaci che aumentano il postcarico. Vasodilatatori, inotropi e pompe a palloncino dovrebbero anche essere evitati perché possono aumentare la LVOTO.
L’insufficienza del RV
Spesso visto nel contesto del MI inferiore, la lieve disfunzione del RV post-MI è comune; tuttavia, nella maggior parte dei casi l’effetto sul LV è minimo.
Significativa ipocinesi del RV si verifica quando vi è occlusione prossimale dell’arteria corinaria destra con poco collaterale dalla circolazione sul lato sinistro. Si postula che, poiché la RV è a parete sottile e ha una minore richiesta di ossigeno, c’è perfusione coronarica durante l’intero ciclo cardiaco; pertanto, l’infarto irreversibile diffuso è raro.
L’insufficienza tipica della RV può presentarsi con ipotensione (a causa della mancanza di precarico LV) e distensione venosa giugulare con un campo polmonare chiaro. Anche se classicamente descritto nel contesto di insufficienza RV, questa triade è raramente visto nella sua forma pura nel contesto clinico. La maggior parte dei pazienti si presenta con shock cardiogeno a bassa potenza o insufficienza ventricolare con sintomi autonomici associati.
La presenza di pressione venosa giugulare superiore a 8 cm H2O e il segno di Kussmaul sono altamente sensibili e specifici per una grave insufficienza della RV.
Occasione, lo shunting da destra a sinistra attraverso un forame ovale pervio causa un’ipossiemia persistente. Tenere a mente questa complicazione peculiare.
Elettrocardiograficamente, i pazienti si presentano con elevazione ST inferiore in combinazione con elevazione ST nella traccia V4R. La radiografia del torace di solito appare blanda, senza distensione venosa del lobo superiore.
Diagnosi dell’insufficienza RV
L’ecocardiografia bidimensionale (2D) e la risonanza magnetica (MRI) sono molto utili. La maggior parte delle volte, l’ecocardiografia aiuterà a confermare la diagnosi.
I risultati del cateterismo di Swan-Ganz sono solitamente suggestivi di alte pressioni RA con una bassa PCWP.
Trattamento dell’insufficienza RV
La rianimazione volumetrica per mantenere la PCWP a o intorno a 15 mmHg potrebbe aiutare a temporizzare aumentando transitoriamente il precarico RV. Anche se il trattamento definitivo comporta il ripristino della circolazione coronarica. In rari casi di grave insufficienza della RV, si dovrebbe prendere in considerazione un supporto circolatorio meccanico utilizzando dispositivi di assistenza RV (AD) temporaneamente o come terapia ponte nel contesto di un esteso coinvolgimento biventricolare.