Proprietà fisiche dei composti ionici e covalenti
In generale, i composti ionici e covalenti hanno diverse proprietà fisiche. I composti ionici formano solidi cristallini duri che si fondono ad alte temperature e sono resistenti all’evaporazione. Queste proprietà derivano dalla caratteristica struttura interna di un solido ionico, illustrata schematicamente nella parte (a) della Figura 2.7.4 che mostra la serie tridimensionale di ioni positivi e negativi alternati tenuti insieme da forti attrazioni elettrostatiche. Al contrario, come mostrato nella parte (b) della Figura 9.5.1, la maggior parte dei composti covalenti consiste di molecole discrete tenute insieme da forze intermolecolari relativamente deboli (le forze tra le molecole), anche se gli atomi all’interno di ogni molecola sono tenuti insieme da forti legami covalenti intramolecolari (le forze all’interno della molecola). Le sostanze covalenti possono essere gas, liquidi o solidi a temperatura e pressione ambiente, a seconda della forza delle interazioni intermolecolari. I solidi molecolari covalenti tendono a formare cristalli morbidi che fondono a basse temperature ed evaporano facilmente.
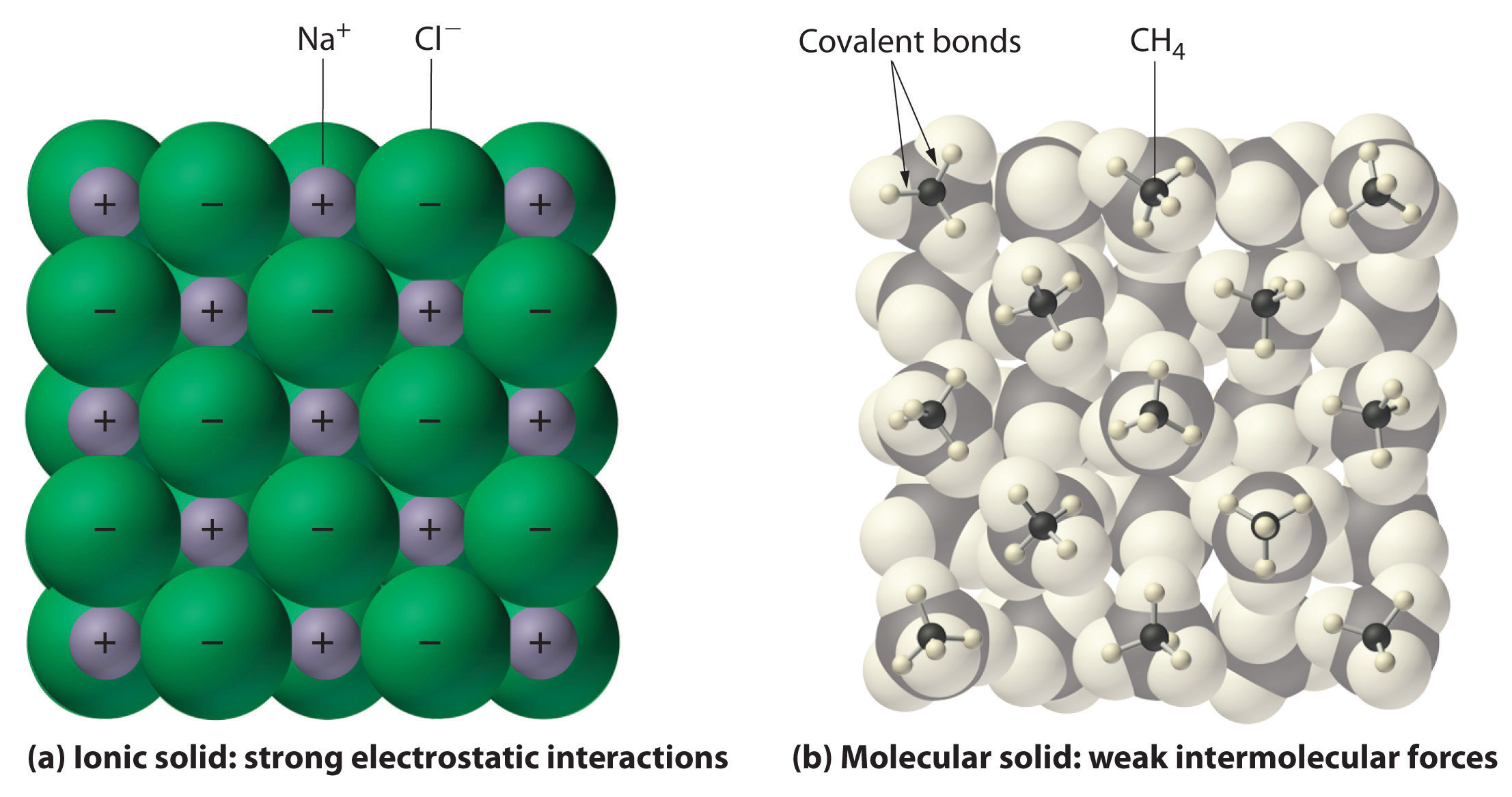
Figura 9.5.1: Interazioni nei solidi ionici e covalenti. (a) Gli ioni caricati positivamente e negativamente in un solido ionico come il cloruro di sodio (NaCl) sono tenuti insieme da forti interazioni elettrostatiche. (b) In questa rappresentazione dell’impacchettamento delle molecole di metano (\(CH_4\)) nel metano solido, un prototipo di solido molecolare, le molecole di metano sono tenute insieme nel solido solo da forze intermolecolari relativamente deboli, anche se gli atomi di ogni molecola di metano sono tenuti insieme da forti legami covalenti.
Idrocarburi
I solidi molecolari sono costituiti da atomi o molecole tenuti insieme da interazioni dipolo-dipolo, da forze di dispersione di Londra, da legami idrogeno o da qualsiasi combinazione di queste. La disposizione delle molecole nel benzene solido è la seguente:

Figura 9.5.2: La struttura del benzene solido. Nel benzene solido, le molecole non sono disposte con i loro piani paralleli tra loro, ma ad angoli di 90°.
Perché le interazioni intermolecolari in un solido molecolare sono relativamente deboli rispetto ai legami ionici e covalenti, i solidi molecolari tendono ad essere morbidi, a bassa fusione, e facilmente vaporizzabili (\(ΔH_fus}\ e \(ΔH_vap}\ sono bassi). Per sostanze simili, la forza delle forze di dispersione di Londra aumenta dolcemente con l’aumentare della massa molecolare. Per esempio, i punti di fusione di benzene (C6H6), naftalene (C10H8) e antracene (C14H10), con uno, due e tre anelli aromatici fusi, sono rispettivamente 5,5°C, 80,2°C e 215°C. Anche le entalpie di fusione aumentano dolcemente all’interno della serie: benzene (9,95 kJ/mol) < naftalene (19,1 kJ/mol) < antracene (28,8 kJ/mol). Se le molecole hanno forme che non possono impacchettarsi efficientemente nel cristallo, tuttavia, allora i punti di fusione e le entalpie di fusione tendono ad essere inaspettatamente bassi perché le molecole non sono in grado di organizzarsi per ottimizzare le interazioni intermolecolari. Così il toluene (C6H5CH3) e l’m-xilene hanno punti di fusione di -95°C e -48°C, rispettivamente, che sono significativamente più bassi del punto di fusione dell’analogo più leggero ma più simmetrico, il benzene.
La gomma autorigenerante è un esempio di un solido molecolare con il potenziale per applicazioni commerciali significative. Il materiale può allungarsi, ma quando si rompe in pezzi può legarsi di nuovo insieme attraverso il ristabilimento della sua rete di legami a idrogeno senza mostrare alcun segno di debolezza. Tra le altre applicazioni, è stato studiato per il suo uso in adesivi e pneumatici per biciclette che si autorigenerano.

Figura 9.5.3: Toluene e m-xilene. I gruppi metilici attaccati all’anello fenilico nel toluene e nell’m-xilene impediscono agli anelli di impacchettare insieme come nel benzene solido.