24-6C Reazioni dei composti nitro
I composti nitro sono abbastanza instabili in senso termodinamico; per esempio, il calore di decomposizione del nitrometano, secondo la seguente stechiometria, è \(67.4 \testo{kcal mol}^{-1}}).
Si approfitta delle notevoli energie e della rapidità di reazioni come questa nell’uso commerciale dei composti di nitro come esplosivi. Con alcuni composti nitro, come il TNT, c’è un ulteriore vantaggio della bassa sensibilità agli urti.
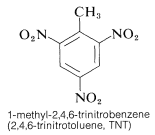
Il TNT non viene fatto esplodere facilmente da un semplice impatto e brucia anche senza esplodere. Tuttavia, una volta iniziata la detonazione, la decomposizione si propaga rapidamente. Le caratteristiche di ragionevole stabilità di manipolazione e di alto potenziale termodinamico rendono i composti nitro particolarmente utili. Altri composti polinitro che sono utili come esplosivi includono il PETN (sezione 17-3C), la ciclonite (sezione 16-4C), l’acido picrico e il tetrile:
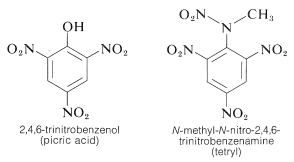
Una caratteristica importante dei composti polinitro aromatici è la loro capacità di formare complessi di “trasferimento di carica” con idrocarburi aromatici, specialmente quelli che sono sostituiti con gruppi alchilici. I complessi di 2,4,6-trinitrobenzenolo (acido picrico) e idrocarburi aromatici sono spesso solidi cristallini, che sono utili per la separazione, purificazione e identificazione degli idrocarburi aromatici. Queste sostanze sono chiamate “idrocarburi picrati”, ma il nome è fuorviante perché non sono in realtà sali. Inoltre, complessi simili si formano tra idrocarburi aromatici e trinitrobenzene, il che dimostra che i gruppi nitro piuttosto che il gruppo idrossile sono essenziali per la formazione del complesso. Il legame in questi complessi assomiglia a quello dei complessi \(\pi\) di alogeni con alcheni e benzene (sezioni 22-4D e 10-3C) e risulta da forze attrattive tra sostanze ricche di elettroni e povere di elettroni. Il nome descrittivo – complesso di trasferimento di carica – suggerisce che il complesso ha strutture VB che coinvolgono il trasferimento di un elettrone dalla molecola donatrice (ricca di elettroni) alla molecola accettore (povera di elettroni). Si usa anche il nome di complesso \(\pi\) perché, di solito, almeno un componente del complesso ha un sistema \(\pi\) di elettroni. Complessi di trasferimento di carica o \più complessi tra polinitro composti e idrocarburi aromatici sembrano dare strutture a sandwich con gli anelli aromatici in piani paralleli, anche se non necessariamente centrati esattamente l’uno sull’altro:
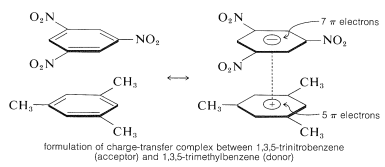
I complessi di trasferimento di carica sono quasi sempre più altamente colorati dei loro singoli componenti. Un esempio spettacolare è il benzene e il tetracianoetene, ognuno dei quali separatamente è incolore, ma che danno un complesso arancione brillante quando sono mescolati. Uno spostamento verso lunghezze d’onda di assorbimento più lunghe, rispetto ai loro componenti, è da aspettarsi per i complessi di trasferimento di carica a causa della maggiore possibilità di stabilizzazione dello stato eccitato attraverso la delocalizzazione degli elettroni che coinvolge entrambi i componenti.
La riduzione dei composti nitro si verifica facilmente con una varietà di agenti riducenti e tali riduzioni permettono una sintesi particolarmente utile delle ammine aromatiche (Sezione 23-12B):
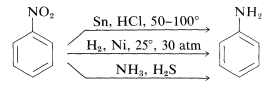
La riduzione di un composto nitro a un’ammina richiede sei equivalenti di agente riducente:
Non ci si aspetta che tale riduzione avvenga in un unico passaggio. Infatti, la riduzione è graduale e procede attraverso una serie di intermedi, che, con forti agenti riducenti in soluzione acida, hanno al massimo un’esistenza transitoria. Gli intermedi formati successivamente da \(\ce{RNO_2}}) con incrementi di due equivalenti di agente riducente sono composti nitrosi, \(\ce{R-N=O}), e azanoli sostituiti (idrossilammine), \(\ce{N}), \(\RNHOH}):
}{longrightarrow}} \ce{RN=O} \overset{2 \overset{2 \overset{2 \overset{2 \overset{2 \overset{2 \overset{2} \RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}]
Quindi gli azanoli \(\ce{N})-aril-sostituiti possono essere ottenuti direttamente dai corrispondenti nitrocomposti con soluzione di zinco e cloruro di ammonio. Tuttavia, lo zinco e l’acido cloridrico danno l’ammina:
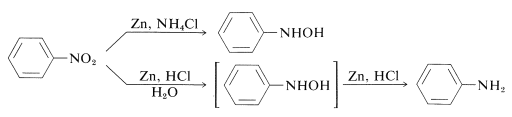
La differenza tra queste reazioni sta nei tassi di riduzione associati all’acidità della soluzione. Il cloruro di ammonio è un acido molto più debole del \ce{HCl}; il pH delle soluzioni di cloruro di ammonio è circa 6.
L’ossidazione dei \ce{N})-arilazanoli in condizioni controllate produce composti nitrosi. Questa reazione non è diversa dall’ossidazione degli alcoli a chetoni (Sezione 15-6B):
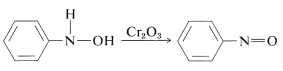
La riduzione dei nitrocomposti arilici con agenti riducenti meno potenti, specialmente in mezzi alcalini, dà quello che può sembrare un misterioso conglomerato di prodotti di riduzione bimolecolare. Per esempio, con il nitrobenzene,
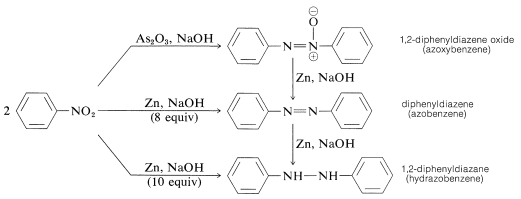
Tutte queste sostanze possono essere ridotte a benzenamina con stagno e acido cloridrico. Di conseguenza, ognuna potrebbe essere, ma non necessariamente è, un intermedio nella riduzione dei composti nitro alle ammine. La formazione dei prodotti di riduzione bimolecolare è il risultato di reazioni indotte dalla base tra i nitrocomposti e gli azanoli o le ammine ed eventualmente un’ulteriore riduzione delle sostanze inizialmente prodotte.
Diversi derivati del polinitrobenzene hanno importanti usi erbicidi. Esempi sono \(\ce{N}^3\), \(\ce{N}^3\)-dietil-6-trifluorometil-2,4-dinitro-1,3-benzendiammina e \(\ce{N})-dipropil-4-trifluorometil-2,6-dinitrobenzenamina:
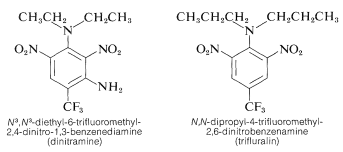
Queste sostanze, se mescolate al terreno, uccidono le piantine di erbacce ma non le piante coltivate come cotone, soia e arachidi. L’attività è alta; normalmente solo circa \(0,08 \testo{g m}^{-2}} è richiesto per un buon controllo delle erbacce.
Le reazioni più importanti dei nitroalcani sono quelle che coinvolgono gli idrogeni \(\alfa\) dei composti primari e secondari. Per esempio, il nitrometano è sufficientemente acido da dissolversi in soluzioni acquose di idrossido. L’anione così prodotto ha una struttura elettronica analoga all’anione nitrato:
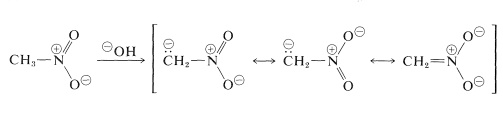
Una proprietà interessante di questo ione è che quando le soluzioni di esso sono acidificate, si produce un isomero instabile, piuttosto fortemente acido del nitrometano (chiamato forma aci), che lentamente ritorna alla forma nitro più stabile:
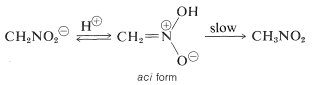
Cambiamenti simili avvengono nell’acidificazione del sale enolico di un composto carbonilico, la principale differenza è la vita molto più lunga del composto aci-nitro rispetto a quella di un enolo di un chetone semplice (vedi sezione 17-1B).
I composti nitro primari e secondari subiscono aggiunte aldol e aggiunte di Michael con composti carbonilici adatti e catalizzatori basici:
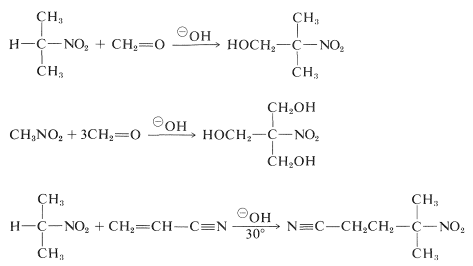
Purtroppo, le reazioni di alchilazione analoghe all’alchilazione catalizzata da basi di composti carbonilici generalmente non sono utili per la sintesi di composti nitro superiori, perché l’alchilazione \(\ce{C})- delle basi coniugate dei composti nitro primari è più lenta dell’alchilazione \(\ce{O})-.