Obiettivi di apprendimento
- Per definire e dare esempi dei principali tipi di radioattività.
Gli atomi sono composti da particelle subatomiche: protoni, neutroni ed elettroni. Protoni e neutroni si trovano nel nucleo e forniscono la maggior parte della massa dell’atomo, mentre gli elettroni circondano il nucleo in gusci e sottogusci e rappresentano la dimensione dell’atomo. Ricorda, la notazione per rappresentare succintamente un isotopo di un particolare atomo:
L’elemento in questo esempio, rappresentato dal simbolo C, è il carbonio. Il suo numero atomico, 6, è il pedice in basso a sinistra del simbolo ed è il numero di protoni nell’atomo. Il numero di massa, l’apice in alto a sinistra del simbolo, è la somma del numero di protoni e neutroni nel nucleo di questo particolare isotopo. In questo caso, il numero di massa è 12, il che significa che il numero di neutroni nell’atomo è 12 – 6 = 6 (cioè, il numero di massa dell’atomo meno il numero di protoni nel nucleo è uguale al numero di neutroni). Occasionalmente, il numero atomico è omesso in questa notazione perché il simbolo dell’elemento stesso trasmette il suo numero atomico caratteristico. I due isotopi dell’idrogeno, 2H e 3H, hanno un nome proprio: deuterio (D) e trizio (T), rispettivamente. Un altro modo di esprimere un particolare isotopo è quello di elencare il numero di massa dopo il nome dell’elemento, come carbonio-12 o idrogeno-3.
La teoria atomica nel XIX secolo presumeva che i nuclei avessero composizioni fisse. Ma nel 1896, lo scienziato francese Henri Becquerel scoprì che un composto di uranio posto vicino a una lastra fotografica produceva un’immagine sulla lastra, anche se il composto era avvolto in un panno nero. Egli ragionò sul fatto che il composto di uranio emetteva un qualche tipo di radiazione che passava attraverso il panno per esporre la lastra fotografica. Ulteriori indagini dimostrarono che la radiazione era una combinazione di particelle e raggi elettromagnetici, con la sua fonte ultima come il nucleo atomico. Queste emanazioni furono infine chiamate, collettivamente, radioattività.
Ci sono tre forme principali di emissioni radioattive. La prima è chiamata particella alfa, che è simboleggiata dalla lettera greca α. Una particella alfa è composta da due protoni e due neutroni, e quindi è la stessa di un nucleo di elio. (Usiamo spesso \ce{^{4}{2}He}} per rappresentare una particella alfa). Ha una carica 2+. Quando un atomo radioattivo emette una particella alfa, il numero atomico dell’atomo originale diminuisce di due (a causa della perdita di due protoni), e il suo numero di massa diminuisce di quattro (a causa della perdita di quattro particelle nucleari). Possiamo rappresentare l’emissione di una particella alfa con un’equazione chimica – per esempio, l’emissione di particelle alfa dell’uranio-235 è la seguente:
\
Come facciamo a sapere che un prodotto della reazione è \(\ce{^{231}_{90}Th})? Usiamo la legge della conservazione della materia, che dice che la materia non può essere creata o distrutta. Questo significa che dobbiamo avere lo stesso numero di protoni e neutroni su entrambi i lati dell’equazione chimica. Se il nostro nucleo di uranio perde 2 protoni, rimangono 90 protoni, identificando l’elemento come torio. Inoltre, se perdiamo 4 particelle nucleari del 235 originale, ne rimangono 231. Così, usiamo la sottrazione per identificare l’isotopo dell’atomo di torio – in questo caso, \ce(^{231}_{90}Th}\).
I chimici spesso usano i nomi isotopo padre e isotopo figlia per rappresentare l’atomo originale e il prodotto diverso dalla particella alfa. Nell’esempio precedente, \ce(^{235}_{92}U}) è l’isotopo padre, e \ce(^{231}_{90}Th}) è l’isotopo figlio. Quando un elemento si trasforma in un altro in questo modo, subisce un decadimento radioattivo.
Esempio \(\PageIndex{1}): Radon-222
Scrivi l’equazione nucleare che rappresenta il decadimento radioattivo del radon-222 per emissione di particelle alfa e identifica l’isotopo figlio.
Soluzione
Il radon ha un numero atomico di 86, quindi l’isotopo padre è rappresentato come \(\ce^{222}_{86}Rn}\). Rappresentiamo la particella alfa come \(\ce{^{4}_{2}He}) e usiamo la sottrazione (222 – 4 = 218 e 86 – 2 = 84) per identificare l’isotopo figlio come un isotopo del polonio, \(\mathrm{^{218}_{84}Po}):
(\ce{86}^{222}Rn\rightarrow \, _2^4He + \, _{84}^{218}Po})
Esercizio \(\PageIndex{1}): Polonio-209
Scrivi l’equazione nucleare che rappresenta il decadimento radioattivo del polonio-209 per emissione di particelle alfa e identifica l’isotopo figlio.
Risposta
(\ce{84}^{209}Po\rightarrow \, _2^4He + \, _{82}^{205}Pb})
Il secondo tipo principale di emissione radioattiva è chiamato particella beta, simboleggiata dalla lettera greca β. Una particella beta è un elettrone espulso dal nucleo (non dai gusci di elettroni intorno al nucleo) e ha una carica 1-. Possiamo anche rappresentare una particella beta come \ce{^0_{-1}e} o β-. L’effetto netto dell’emissione di particelle beta su un nucleo è che un neutrone viene convertito in un protone. Il numero di massa complessivo rimane lo stesso, ma poiché il numero di protoni aumenta di uno, il numero atomico sale di uno. Il carbonio-14 decade emettendo una particella beta:
\
Ancora una volta, la somma dei numeri atomici è la stessa su entrambi i lati dell’equazione, così come la somma dei numeri di massa. (Si noti che all’elettrone è assegnato un “numero atomico” di 1-, uguale alla sua carica.)
Il terzo tipo principale di emissione radioattiva non è una particella, ma piuttosto una forma molto energetica di radiazione elettromagnetica chiamata raggi gamma, simboleggiata dalla lettera greca γ. I raggi gamma non portano di per sé una carica elettrica complessiva, ma possono spingere gli elettroni fuori dagli atomi in un campione di materia e renderlo elettricamente carico (per cui i raggi gamma sono chiamati radiazione ionizzante). Per esempio, nel decadimento radioattivo del radon-222, vengono emesse sia radiazioni alfa che gamma, con queste ultime che hanno un’energia di 8,2 × 10-14 J per nucleo decaduto:
\
Questa può sembrare poca energia, ma se 1 mole di atomi di radon dovesse decadere, l’energia dei raggi gamma sarebbe di 49 milioni di kJ!
Esempio \(\PageIndex{2}}): Boro-12
Scrivi l’equazione nucleare che rappresenta il decadimento radioattivo del boro-12 per emissione di particelle beta e identifica l’isotopo figlio. Un raggio gamma viene emesso simultaneamente alla particella beta.
Soluzione
L’isotopo genitore è \(\ce{12}_{5}B}) mentre uno dei prodotti è un elettrone, \(\ce{0}_{-1}e}\. Affinché i numeri di massa e atomici abbiano lo stesso valore da entrambe le parti, il numero di massa dell’isotopo figlio deve essere 12, e il suo numero atomico deve essere 6. L’elemento che ha un numero atomico di 6 è il carbonio. Quindi, l’equazione nucleare completa è la seguente:
\
L’isotopo figlio è \(\ce{^{12}_6 C}\).
Esercizio \(\PageIndex{2}\: Iodio-131
Scrivi l’equazione nucleare che rappresenta il decadimento radioattivo dello iodio-131 per emissione di particelle beta e identifica l’isotopo figlio. Un raggio gamma viene emesso simultaneamente alla particella beta.
Risposta
\
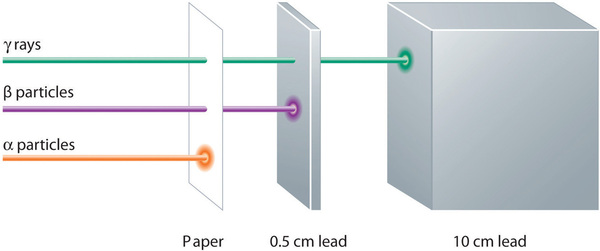
Le emissioni alfa, beta e gamma hanno diverse capacità di penetrare la materia. La particella alfa, relativamente grande, viene facilmente fermata dalla materia (anche se può imprimere una quantità significativa di energia alla materia con cui entra in contatto). Le particelle beta penetrano leggermente nella materia, forse qualche centimetro al massimo. I raggi gamma possono penetrare profondamente nella materia e possono imprimere una grande quantità di energia nella materia circostante. La tabella \(\PageIndex{1}}) riassume le proprietà dei tre principali tipi di emissioni radioattive.
| caratteristiche | particelle alfa | particelle beta | raggi gamma |
|---|---|---|---|
| simboli | α, \(\mathrm{_{2}^{4}He}\) | β, \ce(^{0}_{-1} e}) | γ |
| identità | nucleo di elio | elettrone | elettromagnetico |
| carica | 2+ | 1- | nessuna |
| numero di massa | 4 | 0 | 0 |
| potere penetrante | minimo (non penetra la pelle) | breve (penetra leggermente la pelle e alcuni tessuti) | profondo (penetra profondamente i tessuti) |
Occasione, un nucleo atomico si rompe in pezzi più piccoli in un processo radioattivo chiamato fissione spontanea (o fissione). Tipicamente, gli isotopi figli prodotti dalla fissione sono una miscela varia di prodotti, piuttosto che un isotopo specifico come nell’emissione di particelle alfa e beta. Spesso, la fissione produce neutroni in eccesso che a volte saranno catturati da altri nuclei, inducendo eventualmente ulteriori eventi radioattivi. L’uranio-235 subisce una piccola fissione spontanea. Una reazione tipica è
dove \(\ce{_0^1n}}) è un neutrone. Come per qualsiasi processo nucleare, le somme dei numeri atomici e dei numeri di massa devono essere gli stessi su entrambi i lati dell’equazione. La fissione spontanea si trova solo in nuclei grandi. Il nucleo più piccolo che mostra la fissione spontanea è il piombo-208.
La fissione è il processo radioattivo usato nelle centrali nucleari e in un tipo di bomba nucleare.
Presa di coscienza
I principali tipi di radioattività includono particelle alfa, particelle beta e raggi gamma.
Esercizio di revisione del concetto
-
Quali sono i principali tipi di radioattività? Scrivi equazioni chimiche che dimostrino ogni tipo.
Risposta
-
I principali tipi di radioattività sono il decadimento alfa, il decadimento beta e l’emissione di raggi gamma; decadimento alfa con emissione gamma: \(\mathrm{86}^{222}Rn \rightarrow \, _{84}^{218}Po + \, ^4_2He + \gamma}\); decadimento beta: \ce_6^{14}C \rightarrow _7^{14}N + ^0_{-1}e}\ (le risposte possono variare)