La plupart des traitements médicaux sont conçus pour le « patient moyen », comme une approche unique, qui peut réussir pour certains patients mais pas pour d’autres. La médecine de précision, parfois appelée « médecine personnalisée », est une approche novatrice de la prévention et du traitement des maladies qui tient compte des différences entre les gènes, les environnements et les modes de vie des individus. L’objectif de la médecine de précision est de cibler les bons traitements sur les bons patients au bon moment.
Les progrès de la médecine de précision ont déjà permis de faire de nouvelles découvertes puissantes et de mettre au point des traitements approuvés par la FDA qui sont adaptés à des caractéristiques spécifiques des individus, comme la constitution génétique d’une personne ou le profil génétique de la tumeur d’un individu. Les patients atteints de divers cancers subissent régulièrement des tests moléculaires dans le cadre de leur prise en charge, ce qui permet aux médecins de sélectionner des traitements qui améliorent les chances de survie et réduisent l’exposition aux effets indésirables.
- Tests de séquençage de nouvelle génération (NGS)
- Le rôle de la FDA dans l’avancement de la médecine de précision
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Directives sur les bases de données cliniques
- Guide de validation analytique
- Plateforme bioinformatique de la FDA
- Questions?
- Ce que disent les responsables de la FDA
- NGS Final Guidances
- Rapports et documents de travail
- Réunions antérieures
Tests de séquençage de nouvelle génération (NGS)
Les soins de précision ne seront aussi bons que les tests qui guident le diagnostic et le traitement. Les tests de séquençage de nouvelle génération (NGS) sont capables d’identifier ou de « séquencer » rapidement de grandes sections du génome d’une personne et constituent des avancées importantes dans les applications cliniques de la médecine de précision.
Les patients, les médecins et les chercheurs peuvent utiliser ces tests pour trouver des variantes génétiques qui les aident à diagnostiquer, à traiter et à mieux comprendre les maladies humaines.
Le rôle de la FDA dans l’avancement de la médecine de précision
La FDA s’efforce de garantir l’exactitude des tests NGS, afin que les patients et les cliniciens puissent recevoir des résultats de test précis et cliniquement significatifs.
La grande quantité d’informations générées par le NGS pose de nouveaux problèmes réglementaires à la FDA. Alors que les approches réglementaires actuelles sont appropriées pour les diagnostics conventionnels qui détectent une seule maladie ou condition (comme la glycémie ou le taux de cholestérol), ces nouvelles techniques de séquençage contiennent l’équivalent de millions de tests en un. C’est pourquoi la FDA a travaillé avec les parties prenantes de l’industrie, des laboratoires, des universités, des associations de patients et des associations professionnelles pour mettre au point une approche réglementaire souple afin de s’adapter à cette technologie en évolution rapide, qui s’appuie sur des normes consensuelles, des données provenant de sources multiples et une technologie informatique de pointe à code source ouvert pour soutenir le développement des tests NGS. Cette approche permettra l’innovation dans les tests et la recherche, et accélérera l’accès à des tests génétiques précis et fiables.
Streamlining FDA’s Regulatory Oversight of NGS Tests
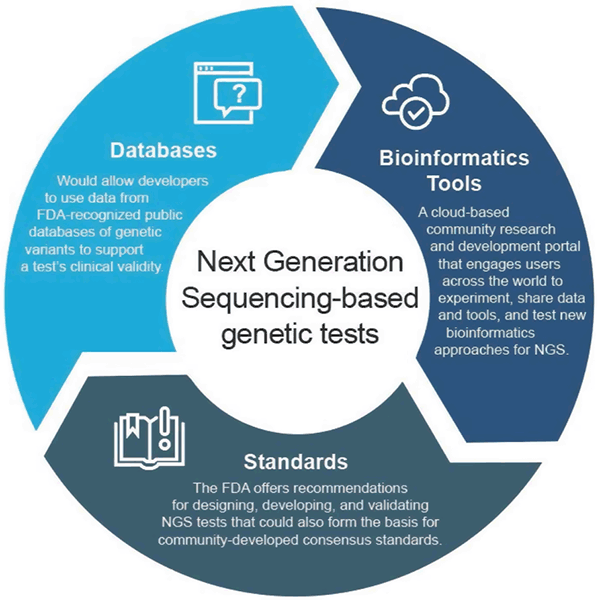
En avril 2018, la FDA a publié deux directives finales qui recommandent des approches pour rationaliser la soumission et l’examen des données soutenant la validité clinique et analytique des tests basés sur le NGS. Ces recommandations visent à fournir une approche de surveillance réglementaire efficace et flexible : à mesure que la technologie progresse, les normes peuvent rapidement évoluer et être utilisées pour définir des paramètres appropriés pour les domaines à croissance rapide tels que le NGS. De même, à mesure que les preuves cliniques s’améliorent, de nouvelles assertions pourraient être soutenues. Cette approche adaptative favoriserait en fin de compte l’innovation parmi les développeurs de tests et améliorerait l’accès des patients à ces nouvelles technologies.
Directives sur les bases de données cliniques
La directive finale « Utilisation de bases de données publiques de variants génétiques humains pour soutenir la validité clinique des diagnostics in vitro génétiques et génomiques » permet aux développeurs d’utiliser des données provenant de bases de données publiques de variants génétiques reconnues par la FDA pour aider à soutenir la validité clinique d’un test et décrit comment les administrateurs de bases de données peuvent demander la reconnaissance de leurs bases de données si elles répondent à certaines recommandations de qualité. Cette approche incite au partage des données et fournit un chemin plus efficace vers le marché.
Plus d’informations sur la reconnaissance des bases de données sont disponibles sur la page web de la FDA consacrée à la reconnaissance des bases de données publiques de variants génétiques humains.
Guide de validation analytique
La guidance finale « Considérations pour la conception, le développement et la validation analytique des diagnostics in vitro (DIV) basés sur le séquençage de nouvelle génération (NGS) – destinés à aider au diagnostic de maladies germinales suspectées » offre des recommandations pour la conception, le développement et la validation des tests NGS. Les orientations encouragent également l’engagement de la communauté dans l’élaboration de normes liées au NGS par les organismes de normalisation (SDO), car les normes peuvent évoluer plus rapidement avec les changements de technologie et de connaissances et peuvent donc être utilisées pour fixer des paramètres appropriés tels que des seuils de performance spécifiques pour des domaines à croissance rapide comme le NGS.
Plateforme bioinformatique de la FDA
La FDA a créé precisionFDA, un portail de recherche et de développement communautaire basé sur le cloud qui engage les utilisateurs du monde entier à partager des données et des outils pour tester, piloter et valider les approches bioinformatiques existantes et nouvelles du traitement NGS. Les individus et les organisations de la communauté génomique peuvent trouver plus d’informations et s’inscrire pour participer à http://precision.fda.gov.
Questions?
Veuillez nous contacter pour toute question sur les efforts de la FDA en matière de médecine de précision à [email protected].
Ce que disent les responsables de la FDA
- La FDA finalise des directives pour accélérer le développement de tests fiables, bénéfiques de tests basés sur le séquençage de nouvelle génération
NGS Final Guidances
- Utilisation de bases de données publiques de variantes génétiques humaines pour soutenir la validité clinique des diagnostics in vitro génétiques et génomiques – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 444KB)
- Considerations for Design, le développement, et la validation analytique des diagnostics in vitro (DIV) basés sur le séquençage de nouvelle génération (NGS) – destinés à aider au diagnostic des maladies germinales suspectées – Guide pour les parties prenantes et le personnel de la Food and Drug Administration (PDF – 869KB)
Rapports et documents de travail
- Optimiser la surveillance réglementaire de la FDA des tests de diagnostic par séquençage de nouvelle génération (PDF – 424KB)
- Rapport : Ouvrir la voie à la médecine personnalisée (Archivé)
Réunions antérieures
- 07/27/16 : Webinaire – Projets de directives sur le séquençage de prochaine génération (NGS) : Implications pour les patients et les fournisseurs
- 07/27/16 : Webinaire – Projet de lignes directrices sur le séquençage de nouvelle génération (NGS) : Aspects techniques et réglementaires
- 11/13/2015 : Atelier public – Utilisation des bases de données pour établir la pertinence clinique des variants génétiques humains
- 11/12/2015 : Approche fondée sur des normes pour l’évaluation des performances analytiques des tests de diagnostic in vitro de séquençage de nouvelle génération
- 20/02/2015 : Optimisation de la surveillance réglementaire par la FDA des tests diagnostiques de séquençage de nouvelle génération Atelier public
.