- trans-Cinnamaldehyde Propriétés chimiques,utilisations,production
- Overview
- Pharmacocinétique
- Applications
- Toxicité
- Propriétés chimiques
- Propriétés chimiques
- Propriétés chimiques
- Définition
- Référence(s) à la synthèse
- Description générale
- Réactions à l’air &à l’eau
- Profil de réactivité
- Danger d’incendie
- Exposition potentielle
- Envoi
- Incompatibilités
- Élimination des déchets
trans-Cinnamaldehyde Propriétés chimiques,utilisations,production
Overview
Le cinnamaldehyde, un ancien aromate dérivé du cannelier et d’autres espèces du genre Cinnamomum, suscite aujourd’hui un intérêt croissant pour sa capacité à prévenir le développement du diabète et de ses complications. Liquide jaune et visqueux, le cinnamaldéhyde constitue 98 % de l’huile essentielle de l’écorce de cannelle. Il a été isolé pour la première fois par Dumas et Péligot, puis synthétisé en laboratoire par le chimiste italien Luigi Chiozza (1828-1889) en 1854. En 2007, Subash et al. ont rapporté pour la première fois un effet hypoglycémique et hypolipidémique du cinnamaldéhyde sur des rats Wistar mâles diabétiques induits par la streptozotocine (STZ). Le cinnamaldéhyde a depuis été largement étudié dans des modèles animaux de diabète et d’obésité.
La casse ou cannelle chinoise est une épice largement utilisée extraite de l’écorce interne du cannelier. Le Cassia est utilisé depuis des milliers d’années à des fins médicinales et est considéré comme l’une des 50 herbes fondamentales de la médecine traditionnelle chinoise. Plusieurs parties de la plante Cassia sont utilisées à des fins médicinales, notamment la racine, l’écorce, les feuilles et les fleurs. Les extraits de cannelle ont été signalés comme ayant divers effets bénéfiques, notamment des effets antiallergiques, antimicrobiens, antiviraux, antioxydants, gastroprotecteurs, antiangiogéniques et anti-Alzheimer, ainsi que des activités biologiques de type insulinique. Les extraits de cannelle contiennent plusieurs composés actifs, notamment des huiles essentielles (cinnamaldéhyde et cinnamyl aldéhyde), des tanins, du mucus et des glucides. Il est intéressant de noter que le cinnamaldéhyde, également connu sous le nom d’aldéhyde cinnamique, présente des effets anti-obésité en réduisant l’accumulation de lipides et en régulant à la baisse le récepteur-γ activé par les proliférateurs de peroxysomes, la protéine de liaison CCAAT/enhancer α et la protéine 1 de liaison à l’élément régulateur des stérols. En outre, le cinnamaldéhyde inhibe l’activation microgliale induite par le lipopolysaccharide en ciblant la protéine-1 liée au récepteur des lipoprotéines de basse densité. Il a également été signalé que le cinnamaldéhyde a des effets antimutagènes sur les cellules cancéreuses.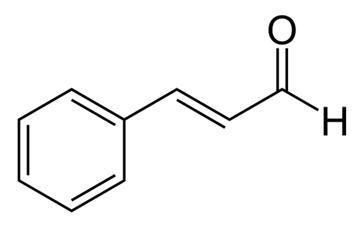
Figure 1 la structure chimique du cinnamaldéhyde ;
Pharmacocinétique
Le cinnamaldéhyde existe naturellement sous la forme trans-cinnamaldéhyde. Dans une expérience réalisée par Zhao et al. évalue la pharmacocinétique du cinnamaldéhyde chez les rats en utilisant l’approche sensible relative de la chromatographie en phase gazeuse-spectrométrie de masse (GC-MS) par administration orale (500 mg/kg) et par injection intraveineuse (i.v.,20 mg/kg). Les résultats révèlent que l’ASC0-t du cinnamaldéhyde par administration orale et par administration i.v. est de 1984 ± 531 et 355 ± 53 ng h/ml, respectivement. Le T1/2 et le Tmax du cinnamaldéhyde sont plus longs pour l’administration orale (6,7 ± 1,5 h et 1,6 ± 0,5 h) que pour l’administration i.v. (1,7 ± 0,3 h et 0,033 h). La Cmax est de 249±36 ng/ml pour l’administration orale, et de 547±142 ng/ml pour l’administration i.v., respectivement. Les résultats indiquent que la biodisponibilité du cinnamaldéhyde est mieux améliorée par l’administration i.v. que par l’administration orale.
De plus, les auteurs démontrent que la Cmax et l’AUC0-t sont proportionnelles à la dose (de 125 à 500 mg), alors que le Tmax et le temps de séjour moyen ne changent pas en réponse à l’augmentation de la dose. Étant donné que le cinnamaldéhyde et l’alcool cinnamylique peuvent se transformer l’un en l’autre chez les rats, les auteurs analysent également les propriétés pharmacocinétiques de l’alcool cinnamylique dans le plasma des rats. Les données pharmacocinétiques de l’alcool cinnamylique sont 1105±337 ng-h/ml pour l’AUC0-t, 6,7±2,8 h pour la T1/2, 1,5±0,7 h pour le Tmax, et 221±66 ng/ml pour le Cmax, à la dose orale de 500 mg/kg. De manière intéressante, le cinnamate de méthyle a également été découvert dans les métabolites. Pour les propriétés pharmacocinétiques du cinnamate de méthyle, les lecteurs intéressés sont invités à consulter l’article de Zhao et al. En bref, le cinnamaldéhyde est bien distribué dans tout le corps après absorption. Le cinnamaldéhyde a la possibilité de se transformer en alcool cinnamylique et peut également être oxydé en acide cinnamique après avoir pénétré dans l’organisme. Afin de bien comprendre les propriétés pharmacocinétiques du cinnamaldéhyde, le cinnamate de méthyle et l’alcool cinnamylique doivent également être déterminés dans le plasma. Cependant, l’instabilité du cinnamaldéhyde remet en question le fait que la bioactivité du cinnamaldéhyde soit probablement due à la somme de ses métabolites. Par conséquent, d’autres tentatives sont attendues pour répondre à ces préoccupations potentielles. En outre, le SME-cinnamaldéhyde nouvellement développé avec une biodisponibilité améliorée doit également faire l’objet d’une étude plus approfondie de l’effet antidiabétique.
Applications
Les extraits de cannelle ont divers effets bénéfiques, notamment des effets antiallergiques, antimicrobiens, antiviraux, antioxydants, gastroprotecteurs, antiangiogéniques et anti-Alzheimer, ainsi que des activités biologiques de type insulinique. Le cinnamaldéhyde présente des effets anti-obésité en réduisant l’accumulation de lipides et en régulant à la baisse le récepteur-γ activé par les proliférateurs de peroxysomes, la protéine de liaison CCAAT/enhancer α et la protéine 1 de liaison à l’élément régulateur des stérols. En outre, le cinnamaldéhyde inhibe l’activation microgliale induite par le lipopolysaccharide en ciblant la protéine 1 liée au récepteur des lipoprotéines de basse densité. Il a également été signalé que le cinnamaldéhyde a des effets antimutagènes sur les cellules cancéreuses. L’effet de l’aldéhyde cinnamique sur le traitement du cancer et du diabète est souligné ci-dessous :
Anticancer
Kwon et al. ont rapporté pour la première fois que les extraits de cannelle induisent la mort des cellules de mélanome in vitro et in vivo par l’inhibition de NF-κB et AP-1. Une étude ultérieure a montré que le HCA est le principal composé antitumorigène présent dans les extraits de cannelle, exerçant ses effets inhibiteurs de croissance sur 29 types de cellules cancéreuses humaines in vitro et sur les xénogreffes de tumeurs humaines SW620 in vivo.
D’autres équipes de recherche ont également rapporté des effets antitumorigènes des extraits de cannelle. Ils inhibent les cellules cancéreuses de mélanome en induisant l’expression de facteurs pro-angiogéniques ; ils ont également amélioré les activités antitumorigènes des cellules T CD8 en augmentant leur activité cytolytique. Les extraits de cannelle inhibent également le facteur de croissance endothélial vasculaire, ce qui a été découvert en criblant les composés pour leur activité inhibitrice contre le VEGFR2. La plupart des effets antitumoraux des extraits de cannelle peuvent être attribués aux cinnamaldéhydes, le principal composant de l’huile essentielle, responsable de la saveur et de l’arôme de la cannelle entière. Il a été signalé que les cinnamaldéhydes inhibaient la prolifération des cellules cancéreuses en inhibant la cycline D1 dans plusieurs types de tumeurs. Les cinnamaldéhydes induisent également l’apoptose en générant des espèces d’oxygène réactif dans les cellules de leucémie HL-60 et par l’activation des protéines pro-apoptotiques de la famille Bcl-2 et de la voie de signalisation MAPK dans les cellules d’hépatome humain. En outre, les cinnamaldéhydes dimères dérivés du HCA ont montré des effets antitumoraux plus importants que les cinnamaldéhydes monomères en induisant l’apoptose et l’arrêt du cycle cellulaire. En outre, un certain nombre d’études ont révélé que les effets antitumoraux du HCA et de ses dérivés sont médiés par plusieurs mécanismes moléculaires. Une étude récente a montré que les polyphénols portant un échafaudage de cinnamaldéhyde déclenchaient l’arrêt du cycle cellulaire à la phase G2/M et la mort cellulaire apoptotique dans les cellules cancéreuses ovariennes humaines résistantes au cisplatine, ce qui suggère que les composés de cinnamaldéhyde pourraient être efficaces dans les chimiothérapies combinées pour les patients cancéreux. Dans l’ensemble, les mécanismes moléculaires qui sous-tendent les effets anticancéreux et antimétastatiques des cinnamaldéhydes sont divers, ce qui suggère que le cinnamaldéhyde est un composé à cibles multiples. La réactivité différentielle de divers cancers aux différents dérivés du cinnamaldéhyde doit être évaluée pour permettre la sélection du composé le plus efficace pour chaque type de cancer.
Anti-diabète
Des études émergentes ont été réalisées au cours des dernières décennies pour évaluer son rôle bénéfique dans la gestion du diabète et de ses complications. Il est démontré que l’administration orale de cinnamaldéhyde allant de 20 mg/kg de poids corporel à 40 mg/kg-PC par jour pendant une durée allant de 21 à 60 jours a entraîné une amélioration significative des taux de glucose sanguin et d’hémoglobine glycosylée ainsi que de la sensibilité à l’insuline chez des rats diabétiques induits par le STZ. Et 20 mg/kg-PC est supposé être la dose efficace pour prévenir le développement du diabète chez les animaux. En outre, le traitement au cinnamaldéhyde pendant 4 semaines augmente les taux d’insuline plasmatique et la teneur en glycogène du foie, et diminue les taux de triglycérides et de cholestérol à lipoprotéines de basse densité chez des rats Wistar mâles insultés par le STZ et/ou le HFD. En outre, Camacho et al. ont constaté que l’administration de cinnamaldéhyde pendant 5 semaines à des souris C57BL/6J nourries au HFD entraînait une réduction significative de la prise de masse graisseuse. Cependant, ils ont affirmé que le traitement à l’aldéhyde cinnamique ne modifiait pas les taux plasmatiques d’insuline à jeun ni la consommation alimentaire. La raison de cette incohérence concernant la régulation de l’insuline pourrait être attribuée au fait que les fonds génétiques des souris C57BL/6J sont modifiés dans certaines installations de production. Les différentes sous-souches de souris peuvent présenter des différences significatives dans les phénotypes. En outre, le cinnamaldéhyde peut présenter un effet hypoglycémiant par l’amélioration de la sensibilité à l’insuline dans la périphérie dans l’étude de Camacho.
La cinnamaldéhyde a la capacité d’améliorer les tissus adipeux diabétiques en réduisant le dépôt de graisse viscérale, et en favorisant la lipolyse et l’oxydation des acides gras et la thermogenèse, ce qui est associé à une régulation positive des gènes de la dépense énergétique, une inhibition de PPARγ/CEBP-α et de SREBP1, une régulation positive de HSL et de PNPLA2 et MGL, une induction de la phosphorylation de l’AMPK, et une augmentation de Cpt1a dans WAT et d’Acsl4 dans BAT, ainsi qu’une stimulation du système nerveux sympathique. En outre, le cinnamaldéhyde prévient l’expression des gènes inflammatoires et améliore l’expression des GLUTs chez les animaux diabétiques. Le cinnamaldéhyde peut protéger contre le diabète en améliorant la sensibilité à l’insuline et l’absorption du glucose par la régulation de la voie PI3K/IRS-1 et RBP4-GLUT4 dans le tissu musculaire squelettique, ainsi que la régulation du métabolisme des mitochondries par la voie PGC-1α/MEF2/GLUT4 dans les cellules C2C12. Le cinnamaldéhyde a également des effets positifs sur le foie diabétique par l’amélioration des synthèses de glycogène en régulant les activités de PK et PEPCK et en diminuant le niveau de RBP4 ainsi qu’en normalisant les enzymes hépatiques aberrantes, suggérant un rôle bénéfique de ce composé dans le métabolisme du glucose et la sensibilité à l’insuline dans le foie diabétique.
Effets antimicrobiens
Des études ont confirmé l’activité antimicrobienne du cinnamaldéhyde, du clou de girofle, du thym et du romarin contre E. coli O157:H7 et Salmonella. Wendakoon et Sakaguchi ont signalé que le groupe carbonyle du cinnamaldéhyde se lie aux protéines, empêchant l’activité de la décarboxylase des acides aminés chez Enterobacter aerogenes. Smid et al. ont observé que la membrane cytoplasmique de Saccharomyces cerevisiae était endommagée lorsqu’elle était traitée avec du cinnamaldéhyde, ce qui entraînait une fuite excessive de métabolites et d’enzymes de la cellule, et finalement une perte de viabilité. La plupart des études ont suggéré que les modes d’action des huiles essentielles dépendent du type de micro-organismes, principalement de la structure de leur paroi cellulaire et de la disposition de leur membrane externe. Elles ont observé des dommages dus aux différences importantes entre les membranes externes des bactéries gram-négatives et gram-positives.
Toxicité
Même aujourd’hui, le cinnamaldéhyde est toujours supposé être un agent ingrédient naturel sûr et bien toléré chez les humains et les animaux. Le concept est également bien accepté par la FDA et le conseil de l’Europe avec la suggestion de la dose journalière acceptable de 1,25 mg/kg.
Toxicité aiguë
Le cinnamaldéhyde est signalé comme ayant la marge de sécurité élevée, et administré 20 fois la dose efficace(20 mg/kg) de ce composé n’a pas provoqué de signes comportementaux anormaux et de valeurs chimiques sériques perturbées tout au long de l’étude. La toxicité aiguë du cinnamaldéhyde est faible, avec des valeurs de dose létale médiane orale(LD50) allant de 0,6 g/kg de poids corporel à 3,4 g/kg de poids corporel chez différentes espèces.
Toxicité à long terme
Les résultats d’une étude de trois mois montrent que le poids corporel est réduit chez les rats femelles exposés à 16 500 ou 33 000 ppm et chez les souris femelles exposées à 8200 ppm ou plus. En outre, la consommation d’aliments est réduite dans tous les groupes de rats exposés et dans le groupe de souris ayant reçu la dose la plus élevée. De plus, l’exposition au cinnamaldéhyde augmente l’incidence de l’hyperplasie de l’épithélium squameux du pré-estomac. En outre, les souris exposées au cinnamaldéhyde présentent également une incidence accrue de dégénérescence de l’épithélium olfactif de la cavité nasale. Tous les rats ont survécu tout au long de l’étude de trois mois.
Autres
Le cinnamaldéhyde peut également présenter des effets de cytotoxicité sur les hépatocytes de rat F344 mis en évidence par la déplétion des niveaux de glutathion, et sur les cellules HepG2 mis en évidence par l’augmentation du nombre de micronoyaux. Behar et al. ont étudié la toxicité potentielle de ce produit sur des cellules embryonnaires et pulmonaires humaines. Les résultats démontrent que le traitement au cinnamaldéhyde dépolymérise les microtubules dans les fibroblastes pulmonaires humains. Le cinnamaldéhyde diminue également la prolifération et la différenciation cellulaires en inhibant la croissance et la différenciation des cellules, en altérant la morphologie et la motilité des cellules ainsi qu’en augmentant les ruptures de brins d’ADN et la mort cellulaire. Une étude réalisée par Olsen et al. révèle que le cinnamaldéhyde provoque une irritation de la peau en augmentant le seuil de douleur au froid et en diminuant le seuil de douleur mécanique ainsi qu’en augmentant la température et la perfusion de la peau chez l’homme.
- Zhou M, Chen Z, Shen S. Recent advanceson cinnamaldehyde. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. La supplémentation en cinnamaldéhyde prévient l’hyperphagie, l’accumulation de lipides et l’inflammation induites par le jeûne chez les souris nourries avec un régime riche en graisses. BioFactors 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Ostéoporose diabétique : A review of its traditional chinese medicinal use and clinical and preclinical research. Evidence-based complementary and alternative medicine : eCAM 2016;2016:3218313.
- Dumas JP, E. Recherche en chimie organique – sur l’huile de cannelle, l’acide hippurique et l’acide sébacique. Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l’essence de cannelle ». Comptes rendus 1856;42:222-227.
- Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldehyde–un agent antidiabétique potentiel. Phytomedicine : journal international de phytothérapie et de phytopharmacologie 2007;14:15-22.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013. Un extrait de cannelle inhibe la dégranulation et la synthèse de novo des médiateurs inflammatoires dans les mastocytes. Allergy 68 : 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006. Activité antimicrobienne des huiles de cannelle et de girofle dans des conditions d’atmosphère modifiée. Int J Food Microbiol 107 : 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. Inhibiteurs d’entrée du VIH de type 1 avec un nouveau mode d’action. Antivir Chemother 19 : 243-255.
- Yang CH, Li RX, Chuang LY. 2012. Activité antioxydante de diverses parties de Cinnamomum cassia extraites avec différentes méthodes d’extraction. Molecules 17 : 7294-7304.
- Peterson DW et al. 2009. L’extrait de cannelle inhibe l’agrégation tau associée à la maladie d’Alzheimer in vitro. J Alzheimers Dis 17 : 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012. Effets antidiabétiques in vivo et in vitro d’un extrait aqueux de cannelle et d’une matrice alimentaire enrichie en polyphénols de cannelle. Food Chem 135 : 2994-3002.
- Kim JE et al. 2015a. Un nouveau produit naturel lié à la cannelle avec une activité inhibitrice de Pim-1 inhibe la leucémie et le cancer de la peau. Cancer Res 75 : 2716-2728.
- Hwang H et al. 2011. Le 2′-Hydroxycinnamaldéhyde cible la protéine-1 liée au récepteur des lipoprotéines de basse densité pour inhiber l’activation microgliale induite par le lipopolysaccharide. J Neuroimmunol2011 230 : 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. L’effet antimutagène de la vanilline et du cinnamaldéhyde sur la mutation spontanée chez Salmonella TA104 est dû à une réduction des mutations sur les sites GC mais pas AT. Mutat Res 480 : 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. Progrès de la recherche sur les effets pharmacologiques du trans-cinnamaldéhyde. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Étude pharmacocinétique du cinnamaldéhyde chez le rat par gc-ms après administration orale et intraveineuse. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al. 1998. Synthèse et cytotoxicité in vitro des cinnamaldéhydes sur les cellules tumorales solides humaines. Arch Pharm Res 21 : 147-152.
- Lee CW et al. 1999. Inhibition de la croissance des tumeurs humaines par les 2′-hydroxyet 2′-benzoyloxycinnamaldéhydes. Planta Med 65 : 263-266
- Kwon HK et al. 2009. L’extrait de cannelle supprime la progression tumorale en modulant l’angiogenèse et la fonction effectrice des cellules T CD8+. Cancer Lett 278 : 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. Une nouvelle activité inhibitrice de l’angiogenèse dans un extrait de cannelle bloque la kinase VEGFR2 et la signalisation en aval. Carcinogenesis 31 : 481-488.
- Jeong HW et al. 2000. Les cinnamaldéhydes inhibent la kinase dépendante de la cycline 4/cycline D1. Bioorg Med Chem Lett 10 : 1819-1822.
- Ka H et al. 2003. Cinnamaldehyde induit l’apoptose par ROSmediated transition de perméabilité mitochondriale dans les cellules de leucémie promyélocytaire humaine HL-60. Cancer Lett 196 : 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. Cinnamaldehyde-induced apoptosis in human PLC/PRF/5 cells through activation of the proapoptotic Bcl-2 family proteins and MAPK pathway. Life Sci 77 : 938-951.
- Shin DS et al. 2006. Synthèse et évaluation biologique de cinnamaldéhydes dimères comme agents antitumoraux puissants. Bioorg Med Chem 14 : 2498-2506.
- Shin SY et al. 2014. Polyphénols portant l’échafaudage cinnamaldéhyde montrant des effets inhibiteurs de la croissance cellulaire sur les cellules cancéreuses ovariennes A2780/Cis résistantes au cisplatine. Bioorg Med Chem 22 : 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. Composition chimique et effet hypoglycémiant et protecteur du pancréas de l’huile essentielle de feuilles de cannelle indigène. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Le cinnamaldéhyde protège de l’hypertension associée au diabète. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2011;49:3007-3012.
- Li M, Xu Y, Zhang W. Effets du cinnamaldéhyde sur les niveaux d’expression de irs-1 et de p85 alpha dans le gastrocnémien des rats diabétiques de type 2. Medical Journal of Wuhan University 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Analyse Gc-ms et dépistage du potentiel antidiabétique, antioxydant et hypolipidémique de l’huile de cinnamomum tamala dans le diabète sucré induit par la streptozotocine chez le rat. Cardiovascular diabetology 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. Effets anti-obésité et anti-hyperglycémique du cinnamaldehyde via une altération de la sécrétion de ghréline et un impact fonctionnel sur la prise alimentaire et la vidange gastrique. Scientific reports 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR. Le fond de souche de souris c57bl/6j modifie l’effet d’une mutation de bcl2l2. G3 2012;2:99-102.
- Mekada K, Abe K, Murakami A, Nakamura S, Nakata H, Moriwaki K, Obata Y, Yoshiki A. Les différences génétiques entre les sous-souches c57bl/6. Animaux expérimentaux 2009;58:141-149.
- Kiselycznyk C, Holmes A. Toutes les souris ne sont pas créées égales. Frontiers in neuroscience 2011;5:10.
- Attane C, Peyot ML, Lussier R, Zhang D, Joly E, Madiraju SR, Prentki M. Differential insulin secretion of high-fat diet-fed c57bl/6nn and c57bl/6nj mice : Implications du fond génétique mixte dans les études métaboliques. PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK, Mermierd. CM, Conne. CA, Vaughanc. RA. Le trans-cinnamaldéhyde stimule la biogenèse mitochondriale par le biais de pgc-1α et pparβ/δ conduisant à une expression accrue de glut4. Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. Effets antidiabétiques du cinnamaldéhyde et de la berbérine et leurs impacts sur l’expression de la protéine 4 de liaison au rétinol chez les rats atteints de diabète sucré de type 2. Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Augmentation de l’expression de p85/55/50 et diminution de l’activité de la phosphotidylinositol 3-kinase dans le muscle squelettique humain résistant à l’insuline. Diabetes 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS. Impact de la déficience en cyclooxygénase-1 hématopoïétique sur l’inflammation du tissu adipeux et les troubles métaboliques liés à l’obésité chez la souris. Métabolisme : clinique et expérimental 2013;62:1673-1685.
- Ohaeri OC. Effet de l’huile d’ail sur les niveaux de diverses enzymes dans le sérum et les tissus des rats diabétiques streptozotocine. Bioscience reports 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH. Évaluation de la lipocaline associée à la gélatinase des neutrophiles (ngal] et de la protéine 4 liant le rétinol chez les patients diabétiques de type 2 atteints de néphropathie. Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. et CORKE, H. 2007. Propriétés antibactériennes et principaux composants bioactifs du bâton de cannelle : Activity against foodborne pathogenic bacteria. J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K. et REMMAL, A. 2003. Le mécanisme d’action bactéricide des huiles essentielles d’origan et de girofle de leurs composants majeurs phénoliques sur Escherichia coli et Bacillus subtilis. J. Essent. Oil Res. 15, 356-362.
- KIM, H.-O., PARK, S.-W. et PARK, H.-D. 2004. Inactivation d’Escherichia coli O157:H7 par l’aldéhyde cinnamique purifié à partir de la pousse de Cinnamomum cassia. Food Microbiol. 21, 105-110
- WENDAKOON, C. et SAKAGUCHI, M. 1995. Inhibition de l’activité décarboxylase des acides aminés d’Enterobacter aerogenes par les composants actifs des épices. J. Food Prot. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. et GORRIS, L.G.M. 1996. Action fongicide et fongistatique des métabolites secondaires végétaux cinnamaldéhyde et carvone. Dans Modern Fungicides and Antimicrobial Compounds pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. Du diabète de type 2 à l’activité antioxydante : Une revue systématique de la sécurité et de l’efficacité de l’écorce de cannelle commune et cassia. Revue canadienne de physiologie et de pharmacologie 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Effet insulinotrope du cinnamaldéhyde sur la régulation transcriptionnelle de la pyruvate kinase, de la phosphoenolpyruvate carboxykinase et de la translocation glut4 chez les rats diabétiques expérimentaux. Interactions chimico-biologiques 2010;186:72-81.
- Gowder SJT. Évaluation de la sécurité de l’arôme alimentaire -cinnamaldéhyde. Biosécurité 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR. Études de toxicologie et de carcinogenèse du trans-cinnamaldéhyde microencapsulé chez le rat et la souris. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii : Mechanisms of cytotoxicity in rat isolated hepatocytes. Toxicology in vitro : an international journal published in association with BIBRA 1996;10:37-42.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens. Mutagenèse 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribution, quantification et toxicité du cinnamaldéhyde dans les liquides de recharge et les aérosols de cigarettes électroniques. Contrôle du tabac 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Manifestations somatosensorielles et vasomotrices de la stimulation individuelle et combinée de trpm8 et trpa1 à l’aide de l-menthol et de trans-cinnamaldéhyde topiques chez des volontaires sains. European journal of pain 2014;18:1333-1342.
Propriétés chimiques
Le trans-cinnamaldéhyde est le principal composant de l’huile de casse (environ 90%) et de l’huile d’écorce de cannelle du Sri Lanka (environ 75%). On en trouve de plus petites quantités dans de nombreuses autres huiles essentielles. Dans la nature, l’isomère trans est prédominant.
Le trans-Cinnamaldéhyde est un liquide jaunâtre avec une odeur épicée caractéristique, rappelant fortement la cannelle. Étant un aldéhyde insaturé, il subit de nombreuses réactions, dont l’hydrogénation en alcool cinnamique, dihydrocinnamaldéhyde et alcool dihydrocinnamique. L’acide cinnamique se forme par autoxydation.
A l’échelle industrielle, le cinnamaldéhyde est préparé presque exclusivement par condensation alcaline du benzaldéhyde et de l’acétaldéhyde. L’autocondensation de l’acétaldéhyde peut être évitée en utilisant un excès de benzaldéhyde et en ajoutant lentement de l’acétaldéhyde.
Le cinnamaldéhyde est utilisé dans de nombreuses compositions pour créer des notes épicées et orientales (par exemple, les parfums de savon). Il est le principal composant de l’huile de cannelle artificielle. En outre, il est un intermédiaire important dans la synthèse de l’alcool cinnamique et de l’alcool dihydrocinnamique.
Propriétés chimiques
LIQUIDE JAUNE CLAIR
Propriétés chimiques
Liquide huileux, jaunâtre, combustible (s’épaissit à l’exposition à l’air). Forte odeur piquante, épicée, de cannelle.
Définition
ChEBI : Le stéréoisomère E (trans) du cinnamaldéhyde, le parent de la classe des cinnamaldéhydes.
Référence(s) à la synthèse
Chemistry Letters, 12, p. 1207, 1983
Journal of the American Chemical Society, 93, p. 2080, 1971 DOI : 10.1021/ja00737a057
Tetrahedron Letters, 18, p. 1215, 1977
Description générale
Liquide jaune clair avec une odeur de cannelle et un goût sucré.
Réactions à l’air &à l’eau
Peut être sensible à une exposition prolongée à l’air et à la lumière. Insoluble dans l’eau.
Profil de réactivité
Le trans-Cinnamaldéhyde est incompatible avec les agents oxydants forts et les bases fortes. Le trans-Cinnamaldéhyde peut également réagir avec l’hydroxyde de sodium.
Danger d’incendie
Le trans-Cinnamaldéhyde est combustible.
Exposition potentielle
Fongicide et insecticide botanique. Utilisé comme agent antifongique, attractif pour la chrysomèle des racines du maïs et répulsif pour chiens et chats. Peut être utilisé sur l’enveloppe du sol pour les champignons, les cultures en ligne, le gazon et tous les produits alimentaires. Non répertorié pour une utilisation dans les pays de l’UE.
Envoi
UN1989 Aldéhydes, n.o.s., Classe de risque : 3 ; Étiquettes : 3-Liquide inflammable
Incompatibilités
Les aldéhydes sont fréquemment impliqués dans des réactions d’autocondensation ou de polymérisation. Ces réactions sont exothermiques ; elles sont souvent catalysées par un acide. Les aldéhydes sont facilement oxydés pour donner des acides carboxyliques. Des gaz inflammables et/ou toxiques sont générés par la combinaison des aldéhydes avec des composés azoïques, diazoïques, des dithiocarbamates, des nitrures et des agents réducteurs forts. Les aldéhydes peuvent réagir avec l’air pour donner d’abord des acides peroxo, et finalement des acides carboxyliques. Ces réactions d’autoxydation sont activées par la lumière, catalysées par des sels de métaux de transition, et sont autocatalytiques (catalysées par les produits de la réaction). L’ajout de stabilisants (antioxydants) aux expéditions d’aldéhydes retarde l’autoxydation. Incompatible avec les oxydants (chlorates, nitrates, peroxydes, permanganates, perchlorates, chlore, brome, fluor, etc.) ; le contact peut provoquer des incendies ou des explosions. Tenir à l’écart des matières alcalines, bases fortes, acides forts, oxoacides, époxydes, cétones, colorants azoïques, caustiques, boranes, hydrazines
Élimination des déchets
Incinération. Conformément à 40CFR165, suivre les recommandations pour l’élimination des pesticides et des récipients de pesticides.