Parmi les Neisseria humaines et les espèces apparentées, trois espèces – N. mucosa, M. catarrhalis, et K. denitrificans réduisent le nitrate. Le test de réduction du nitrate est un test critique pour différencier N. gonorrhoeae de K. denitrificans, en particulier lorsque les souches de K. denitrificans semblent être des diplocoques gram-négatifs dans les frottis colorés.
Principe
Les espèces bactériennes peuvent être différenciées sur la base de leur capacité à réduire le nitrate en nitrite ou en gaz azotés. Parmi les Neisseriaceae d’origine humaine, les souches de Neisseria mucosa, Moraxella catarrhalis, et Kingella denitrificans réduisent le nitrate. Des souches de M. catarrhalis et de K. denitrificans ont été identifiées à tort comme étant des N. gonorrhoeae. Le test de réduction du nitrate permet de différencier ces espèces, qui sont positives au nitrate, de N. gonorrhoeae (négatif au nitrate). La réduction du nitrate peut être couplée à la respiration anaérobie chez certaines espèces.
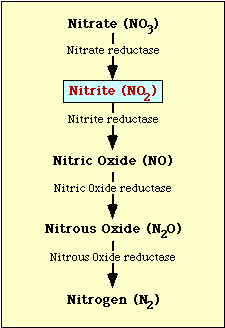
La voie biochimique impliquée dans la réduction du nitrate est présentée dans la figure 1. Le nitrate est réduit en nitrite qui peut ensuite être réduit en oxyde nitrique, en oxyde nitreux ou en azote (figure 1).
Figure l. Voie de réduction du nitrate.
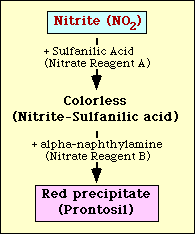
Le test de réduction du nitrate est basé sur la détection du nitrite dans le milieu après incubation avec un organisme. S’il est présent dans le milieu, le nitrite va réagir avec l’acide sulfanilique (réactif nitrate A) pour former un complexe incolore (acide nitrite-sulfanilique). Ce complexe donnera ensuite un précipité rouge (prontosil) lorsque le réactif nitrate B (alpha-naphtylamine) est ensuite ajouté au test comme le montre la figure 2.
Figure 2. Représentation schématique de la détection du nitrite dans le milieu.
Une couleur rouge sera produite dans le milieu uniquement lorsque le nitrite est présent dans le milieu. L’absence de couleur rouge dans le milieu après l’ajout d’acide sulfanilique et d’alpha-naphtylamine signifie seulement que le nitrite n’est pas présent dans le milieu. Il peut y avoir deux explications à cette observation.
- Le nitrate peut ne pas avoir été réduit ; la souche est négative en nitrate.
- Le nitrate peut avoir été réduit en nitrite qui a ensuite été complètement réduit en oxyde nitrique, en oxyde nitreux ou en azote qui ne réagira pas avec les réactifs qui réagissent avec le nitrite ; la souche est positive en nitrate.
Tout milieu d’essai qui donne un résultat négatif après l’ajout des réactifs de nitrate doit être testé plus avant pour déterminer laquelle des deux interprétations est exacte.
Une épreuve de réduction du nitrate réussie dépend de la réalisation de l’épreuve dans les bonnes conditions.
- La réaction se produira mieux si le milieu de base favorise la croissance de l’organisme. Cependant, bien que certaines espèces de Neisseria ne se développent pas bien dans les milieux de bouillon, le test de réduction du nitrate peut être réalisé avec succès dans un milieu qui ne supporte pas la croissance en inoculant fortement le milieu pour fournir suffisamment d’enzyme préformée pour que la réaction se produise.
- La réaction du nitrate se produit uniquement dans des conditions anaérobies. Le milieu contenant du nitrate est distribué dans des tubes pour donner un faible rapport surface:profondeur qui limite la diffusion de l’oxygène dans le milieu, par exemple, 5 ml de milieu sont distribués dans un tube de 13 mm de diamètre. Neisseria et les espèces apparentées utilisent l’oxygène du milieu et produisent rapidement des conditions anaérobies idéales pour que la réduction du nitrate se produise.
Le test de réduction du nitrate est réalisé dans un milieu contenant 0,2% de nitrate de potassium. Le milieu est fortement inoculé avec une culture pure de l’organisme suspect et incubé à 35C à 36,5C pendant 48 h. dans un incubateur avec ou sans supplément de dioxyde de carbone.
La réduction du nitrate est détectée avec les réactifs de Griess Llosvay, l’acide sulfanilique et l’alpha-naphtylamine. L’acide sulfanilique (réactif nitrate A) est ajouté au mélange d’incubation et forme un complexe (nitrite-acide sulfanilique) avec tout nitrite présent dans le milieu. Lorsque l’alpha-naphtylamine (réactif nitrate B) est ajoutée au milieu incubé, un précipité rouge (prontosil) se forme avec tout complexe acide nitrite-sulfanilique présent dans le milieu.
Un organisme peut être signalé comme positif au nitrate si une couleur rouge se développe dans le milieu après l’ajout des réactifs nitrate A et B au milieu, indiquant que l’organisme a réduit le nitrate en nitrite.
L’absence de couleur rouge après l’ajout des deux réactifs ne signifie pas automatiquement que l’organisme est incapable de réduire le nitrate. Les souches peuvent avoir réduit le nitrate en nitrite, puis réduit complètement le nitrite en gaz azotés qui ne sont pas détectés lorsque les réactifs A et B du nitrate sont ajoutés au milieu. Si le milieu ne change pas de couleur après l’ajout d’acide sulfanilique et d’alpha-naphtylamine, une petite quantité (« pointe de couteau ») de poussière de zinc est ajoutée au milieu incubé. La poussière de zinc catalyse chimiquement la réduction du nitrate en nitrite. Ainsi, si le nitrate n’a pas été réduit par les organismes, c’est-à-dire s’ils sont négatifs au nitrate, il sera réduit par la poussière de zinc et une couleur rouge apparaîtra dans le milieu incubé dans les 15 minutes. Si aucune couleur ne se développe dans le milieu incubé après l’ajout de la poussière de zinc, les organismes n’ont pas seulement réduit le nitrate en nitrite, mais ont réduit le nitrite en gaz azotés ; ces organismes sont également nitrate-positifs.
Bien que le milieu nitrate soit fourni avec des tubes de Durham inversés pour détecter la production de gaz, la production de gaz n’est pas enregistrée pour les espèces Neisseria. Bien que certaines espèces puissent réduire le nitrate au-delà du nitrite en gaz azotés, le gaz peut ne pas s’accumuler dans le tube. L’accumulation de gaz dépend de la vitesse à laquelle il est produit. Lorsque le gaz est produit très lentement, il peut se dissoudre dans le milieu et ne pas s’accumuler dans le tube de Durham.
Exigences relatives aux spécimens
Spécimen optimal : Une culture pure d’un diplocoque suspect à Gram négatif et à oxydase positive (Neisseria spp. ou M. catarrhalis) sur gélose chocolat incubée dans une atmosphère enrichie en dioxyde de carbone à 35C à 36,5C pendant 18 à 24 h.
Spécimen inacceptable : Cultures d’isolats sur gélose chocolat incubées dans une atmosphère enrichie en dioxyde de carbone à 35C à 36,5C pendant plus de 24 h.
Facteurs compromettants affectant les résultats de l’essai:
- Le milieu d’essai doit être suffisamment inoculé pour permettre la réaction avec les enzymes préformées. Un inoculum insuffisant peut ne pas permettre aux organismes d’utiliser l’oxygène pour produire des conditions anaérobies dans lesquelles la réduction du nitrate peut se produire.
- Une trop grande quantité de poussière de zinc ajoutée au tube incubé peut entraîner une réduction très rapide du nitrate au-delà du nitrite en gaz azotés, de sorte que le nitrite n’est pas détecté.
Stabilité de l’échantillon : La détection de la réduction du nitrate pour Neisseria et les espèces apparentées dépend de la présence d’enzymes préformées.
- Les tests ne doivent être effectués qu’avec un inoculum récolté à partir de cultures de 24 h.
- Le milieu de nitrate doit être inoculé dans les 30 minutes suivant le retrait de la culture de l’incubateur ; une exposition prolongée de la culture à la température ambiante peut entraîner une diminution de l’activité enzymatique.
Milieu/Réactifs
Milieu : Bouillon de nitrate (Bouillon d’infusion de cœur contenant 0,2 % de nitrate de potassium)
Bouillon d’infusion de cœur (Difco), 25,0 g
Nitrate de potassium, 2,0 g
Eau distillée, 1000,0 ml
- Dissoudre les ingrédients dans l’eau distillée ; ajuster la solution à pH 7.0.
- Dispenser des aliquotes de 5 ml du bouillon dans des tubes de 16 mm x 100 mm avec des inserts de gaz (tubes de Durham, 6 mm x 50 mm).
- Autoclave pendant 15 min à 121C.
Réserver le milieu entre 4C et 10C (réfrigéré) jusqu’à son utilisation. Préchauffer le milieu à température ambiante avant l’inoculation.
Réactifs : Solution d’acide sulfanilique (réactif nitrate A) : 0,8% dans l’acide acétique 5N
Nom chimique : Acide 4-aminobenzène sulfonique
Stocker le réactif nitrate A entre 15C et 30C (température ambiante) jusqu’à 3 mois, à l’obscurité. Les réactifs peuvent être stockés dans des récipients en verre brun foncé ; les bouteilles peuvent être enveloppées dans du papier d’aluminium pour assurer l’obscurité.
Solution d’alpha-naphtylamine (réactif nitrate B) : 0,6% dans de l’acide acétique 5N
Nom chimique : N,N-diméthyl-1 naphtylamine
Stocker le réactif nitrate B entre 2C et 8C (réfrigéré) jusqu’à 3 mois, dans l’obscurité. Les réactifs peuvent être stockés dans des récipients en verre brun foncé ; les bouteilles peuvent être enveloppées dans du papier d’aluminium pour assurer l’obscurité.
Poudre de zinc, qualité réactif : stocker à température ambiante (15C à 30C)
Avertissement : L’acide acétique est corrosif. Le contact avec la peau peut provoquer des cloques et des brûlures. En cas de contact, rincez immédiatement les yeux et la peau avec beaucoup d’eau (pendant au moins 15 min.)
Contrôle de qualité/Procédure de test
Souches de contrôle de qualité :
- Contrôle positif à la nitrate réductase : Kingella denitrificans, CDC 10 236
- Contrôle négatif à la nitrate réductase : Neisseria gonorrhoeae, ATCC 43069
Les souches de contrôle sont conservées à -70C dans une solution de bouillon tryptique de soja contenant 20% de glycérol. Les réactions des souches de contrôle doivent être confirmées au moment de la préparation des stocks congelés. Les souches CQ peuvent être conservées à -70C jusqu’à 2 ans.
Procédure:
Les souches CQ sont testées de la même manière que les isolats cliniques. Les souches QC doivent être subculturées au moins une fois après la culture initiale à partir de l’échantillon congelé avant que le test ne soit effectué. Les isolats cliniques peuvent être subculturés à partir d’un milieu sélectif ou de subcultures purifiées. S’assurer que les cultures sont pures.
- Dégeler les flacons de souches témoins conservés à -70C.
- Séparer sur des plaques de gélose chocolat ou de gélose GC supplémentée pour l’isolement. Incuber à 35C à 36,5C dans une atmosphère enrichie en dioxyde de carbone pendant 18 à 24 h.
-
Avec un écouvillon stérile, préparer une suspension lourde de colonies bien isolées à partir d’une culture pure de l’isolat incubé sur milieu chocolaté à 35C à 36.5 C dans une atmosphère enrichie en dioxyde de carbone pendant 18 à 24 h. Inoculer le milieu d’essai pour obtenir une forte turbidité.
Note : Les souches de N. gonorrhoeae et certaines autres Neisseria spp. peuvent ne pas croître dans ce milieu. Ainsi, la réaction peut dépendre d’une enzyme préformée.
- Incuber les milieux inoculés et un tube de milieu témoin non inoculé à 35C à 36,5 C dans une atmosphère enrichie en dioxyde de carbone pendant 48 h.
-
Après 48 h d’incubation, ajouter, avec des pipettes Pasteur, 5 gouttes de réactif #A, suivies de 5 gouttes de réactif #B dans chaque tube. Agitez bien le tube pour mélanger les réactifs avec le milieu.
Examinez la suspension pour détecter une couleur rose-rouge qui devrait se développer en quelques minutes si le milieu est encore chaud. La réaction peut prendre un peu plus de temps si le milieu est froid lorsque les réactifs sont ajoutés.
Si la suspension devient rose-rouge avant l’ajout de la poudre de Zn, la recation est positive et le test est terminé. Ne pas effectuer l’étape 4.
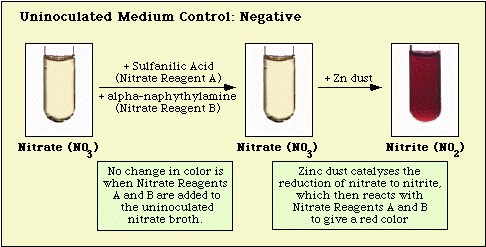
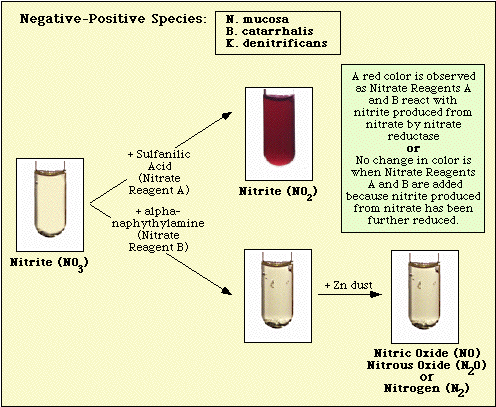
Les réactions observées avec le milieu témoin non inoculé, et les isolats négatifs au nitrate et positifs au nitrate sont illustrées à la figure 3, à la figure 4 et à la figure 5, respectivement.
-
Si la suspension est incolore après l’ajout des réactifs A et B, ajouter une petite quantité (4 à 5 mg ; « pointe de couteau aiguisée ») de poudre de zinc au milieu. Agiter vigoureusement le tube et le laisser reposer à température ambiante pendant 10 à 15 min.
Si le milieu reste incolore après l’ajout de la poudre de Zn, le résultat du test est positif.
Si le milieu devient rose après l’ajout de la poudre de Zn, le résultat est négatif. - Lire et enregistrer les résultats.
Figure 3. Réaction observée avec un milieu nitrate non inoculé.
Figure 4. Réaction observée avec des espèces négatives au nitrate.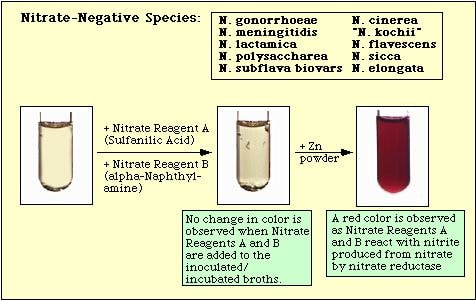
Figure 5. Réactions observées avec des espèces positives au nitrate.
Planification du contrôle de qualité:
- Un test de CQ de la nitrate réductase est effectué chaque jour où des isolats cliniques sont testés.
Problèmes & Solutions
Le test de réduction du nitrate peut donner des résultats faussement négatifs ou faussement positifs si le milieu n’est pas produit avec précision ou si le test n’est pas effectué avec précision. La réaction dans ce test dépend d’un certain nombre de facteurs.
- L’échec de la détection de la couleur rose dans le tube témoin du milieu non inoculé après l’ajout de poussière de Zn peut être dû (1) au fait que le milieu ne contient pas de nitrate ou (2) à l’ajout d’une trop grande quantité de poussière de zinc qui a catalysé la réduction du nitrate au-delà du nitrite en gaz azotés. La solution la plus simple est d’obtenir plus de milieu nitrate en s’assurant que du nitrate a été ajouté au milieu de base. Une autre solution consiste à inoculer le milieu avec une souche témoin positive, mais à tester une réaction après un temps d’incubation plus court ; les souches de N. mucosa produiront une réaction positive au nitrite après quelques heures d’incubation. S’il est confirmé que le milieu contient du nitrate, répétez le test jusqu’à ce que vous ayez déterminé la quantité correcte de poussière de zinc à ajouter. Il est essentiel de connaître la quantité de poussière de zinc à ajouter au test. L’ajout d’une trop grande quantité de poussière de zinc peut entraîner un résultat faussement positif.
- Si une couleur rose est détectée dans le contrôle du milieu non inoculé après l’ajout des réactifs de nitrate A et B au milieu, le milieu est contaminé par du nitrite. La seule solution est d’obtenir un nouveau lot de milieu qui n’est pas contaminé par le nitrite.
- Dans un milieu contenant du nitrate, l’échec de la souche témoin positive, Kingella denitrificans, à donner une réaction positive ne se produirait que si la souche n’est pas K. denitrificans. Revérifier l’identité de la souche témoin positive. Sélectionnez une nouvelle culture de la souche témoin et répétez le test. De même, si un test positif de nitrate réductase est obtenu avec la souche témoin négative, N. gonorrhoeae, soit la souche témoin négative n’est pas N. gonorrhoeae, soit la culture est contaminée par un organisme positif pour le nitrate. Revérifier la pureté et l’identité de la souche de référence gonococcique. Répéter le test avec une culture pure d’une culture confirmée de N. gonorrhoeae.
- La réaction de réduction du nitrate indique la capacité des organismes à réduire le nitrate, une réaction qui ne se produit que dans des conditions anaérobies ; la réaction ne se produira pas si les organismes reçoivent un apport continu d’oxygène. Ainsi, la réaction peut ne pas se produire dans des cultures fixes (en particulier d’espèces à croissance lente) dans lesquelles le milieu est réparti en couches peu profondes qui permettent à l’oxygène de se diffuser dans le milieu. Un test pour déterminer si l’oxygène est présent dans le milieu peut être effectué en ajoutant une goutte de réactif oxydase au milieu. Si le milieu devient violet, le milieu contient de l’oxygène et la réaction de réduction du nitrate ne peut pas se produire. Si le milieu reste incolore, le milieu ne contient pas d’oxygène et le test de réduction des nitrates peut se produire. Il a été noté que les cellules de N. gonorrhoeae utilisent rapidement l’oxygène si un nombre suffisant de cellules est inoculé dans le milieu. Si le réactif oxydase est ajouté après environ 1 à 2 heures d’incubation, le milieu restera clair. Comme le réactif oxydase tue les gonocoques présents dans le milieu, le milieu deviendra progressivement violet, en commençant par le haut du tube, à mesure que l’oxygène diffuse dans le milieu. Si le milieu est distribué dans des tubes de dimensions différentes de celles suggérées ci-dessus, s’assurer que le rapport surface/profondeur est au moins égal ou inférieur à ceux suggérés ci-dessus. Si le diamètre du tube dans lequel le milieu est distribué est supérieur à celui décrit ci-dessus, utiliser un plus grand volume de milieu pour maintenir le même rapport surface/profondeur.
-
La réaction de réduction du nitrate peut ne pas se produire si le milieu dans lequel le test est effectué ne permet pas une croissance normale de l’organisme. Cependant, l’essai peut être effectué dans un milieu qui ne permet pas la croissance des organismes si l’inoculum est suffisamment dense pour que les enzymes préformées puissent épuiser l’apport d’oxygène existant et réduire le nitrate à une vitesse plus rapide que celle à laquelle l’oxygène diffuse dans le milieu.
Note : Pour vérifier que l’oxygène a été éliminé du milieu, ajouter 2 à 3 gouttes de réactif oxydase à un duplicata du milieu inoculé. Si l’oxygène a été correctement éliminé du milieu, le réactif oxydase ne deviendra pas violet immédiatement. Si le milieu contient de l’oxygène dissous, le réactif d’oxydase deviendra violet. Notons également que le test de réduction des nitrates peut être effectué dans un milieu auquel le réactif oxydase a été ajouté.
- Lorsque le réactif A est ajouté au milieu de test, le nitrite produit suite à la réduction des nitrates formera un complexe avec l’acide sulfanilique qui produit un précipité rouge avec l’alpha-naphtylamine dans le réactif B. La présence d’une couleur rouge dans le milieu de test indique que le nitrite est présent suite à la réduction des nitrates. Toutefois, l’absence de couleur rouge après l’addition des réactifs A et B ne signifie pas nécessairement que le nitrate n’a pas été réduit. L’absence de couleur rouge peut signifier (1) que le nitrate n’a pas été réduit, ou (2) que le nitrite, produit par la réduction du nitrate, a lui-même été réduit en gaz azotés. Pour déterminer si le nitrite a été réduit, il suffit de placer une petite quantité de poudre de zinc dans le mélange d’incubation si celui-ci est incolore après l’addition des réactifs A et B. La poudre de zinc catalyse la réduction du nitrate en nitrite ; une couleur rouge doit apparaître dans le milieu qui contient encore du nitrate non réduit. Il est important, cependant, de ne pas ajouter trop de poussière de zinc ; un excès de poussière de zinc catalysera la réduction du nitrite produit à partir de ce nitrate, ce qui entraînera un milieu incolore et une interprétation incorrecte du test comme étant positif (un résultat faussement positif).
- Un test positif de nitrate réductase est obtenu avec la souche témoin négative, N. gonorrhoeae, après l’ajout de la poussière de zinc indique que le nitrate a été réduit au-delà du nitrite, probablement en raison de l’ajout d’une trop grande quantité de poussière de zinc au test. Répétez le test en veillant à ajouter très peu de poudre de zinc. La couleur rose, indiquant que l’organisme n’a pas réduit le nitrate, peut prendre 10 à 15 minutes pour se développer. N’ajoutez pas plus de poussière de zinc ! Attendez que la couleur se développe. Si aucune couleur ne s’est développée en 30 min, interprétez le test comme étant positif.
Limites du test
Si le test est réalisé correctement et que les souches de contrôle de qualité donnent des résultats appropriés, il ne devrait pas y avoir de limites à ce test. Il faut veiller à ce que toutes les composantes du test soient réalisées correctement .
Aucune identification de genre ou d’espèce ne peut être faite sur la base du seul test de réduction du nitrate.
Résultats, interprétation et rapport
Les isolats peuvent être signalés comme positifs au nitrate si du nitrite (couleur rose) est détecté dans le milieu inoculé après l’addition des réactifs A et B ou si aucune couleur n’est détectée dans le milieu après l’addition de la poussière de zinc.
Les isolats peuvent être rapportés comme nitrate-négatif si le nitrite n’est pas détecté (pas de changement de couleur) après l’addition des réactifs A et B, ou si une couleur rose se développe après l’addition de poussière de zinc au milieu inoculé.
Bibliographie
Knapp JS, Clark VL. Croissance anaérobie de Neisseria gonorrhoeae couplée à la réduction des nitrites. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Un guide pour l’identification des genres de bactéries. The Williams & Wilkins Co, Baltimore, MD.
.