Meera Senthilingam
Cette semaine, un aperçu de la vie d’un stagiaire en laboratoire de chimie. Et c’est Brian Clegg qui s’en souvient :
Brian Clegg
Entre l’école et l’université, avec un tout nouveau A-level de chimie à la ceinture, j’ai passé l’été à travailler dans un laboratoire industriel. Comme j’étais le plus bas de l’échelle, mes tâches étaient celles que personne d’autre ne voulait faire. Le rôle de notre laboratoire était de tester les matières premières entrantes dans une usine spécialisée dans les acides gras. Le pire travail était, sans aucun doute, d’être « lumper bumper » – un surnom d’origine incertaine pour sortir par tous les temps et grimper sur les camions-citernes de produits chimiques pour prélever des échantillons de leur contenu chaud. Dans le meilleur des cas, il s’agissait de manipuler de l’huile de noix de cacao odorante, dans le pire, du suif puant. Après ces excursions, le matériel d’échantillonnage rejoignait les piles interminables de matériel de laboratoire sale dont j’étais également responsable. Et c’est là que j’ai fait connaissance avec le tétrachlorure de carbone.

Source : ©
À l’époque, le tétrachlorure de carbone était un nettoyant de laboratoire presque universel. Nous l’utilisions avec abandon, tirant parti de la capacité de ce solvant à dissoudre des substances difficiles à éliminer comme les huiles et les graisses. Aujourd’hui, je regarde en arrière avec une certaine horreur : nous savons que le tétrachlorure de carbone provoque des dommages au système nerveux et aux organes et qu’il pourrait bien être cancérigène.
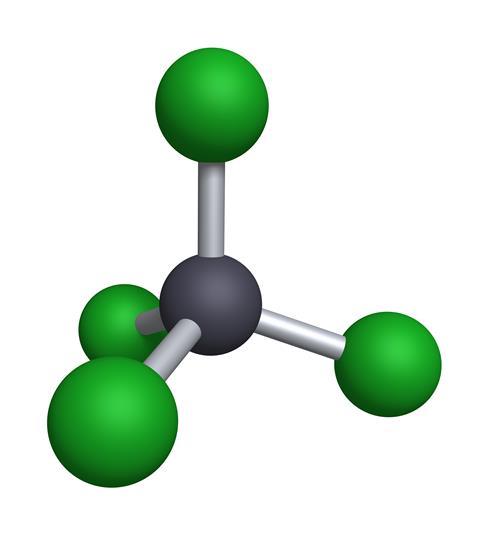
Ce composé simple d’un atome de carbone avec quatre atomes de chlore attachés est un liquide clair et incolore à température ambiante et a une odeur capiteuse, presque fruitée. Il a été fabriqué pour la première fois en 1839 par Henry Victor Regnault, probablement plus connu comme physicien, mais plus tôt dans sa carrière, il était un chercheur actif en chimie organique. Il a pris du chloroforme, qui est une molécule similaire avec un atome d’hydrogène à la place du chlore, et l’a fait réagir avec du chlore gazeux pour obtenir du tétrachlorure de carbone. Aujourd’hui, le point de départ est généralement du méthane – CH4 – facilement disponible et beaucoup de chlore, généralement produit par l’électrolyse de l’eau salée.
Au début du 20e siècle, le tétrachlorure de carbone a trouvé une multitude d’utilisations. En tant que solvant superlatif, c’était un produit évident pour le nettoyage à sec. Ce procédé étrangement nommé (il n’est sec que dans le sens où l’eau n’intervient pas) est utilisé pour nettoyer des tissus qui seraient abîmés par un lavage classique. Les premiers agents de nettoyage à sec, qui remontent au milieu du 19e siècle, étaient l’essence et le kérosène, mais ils étaient embarrassants et inflammables. On a donc cherché à trouver des solvants qui pouvaient encore faire le travail, mais qui ne s’enflammeraient pas et ne feraient pas exploser les machines.
Source : ©
Le tétrachlorure de carbone semblait être un choix idéal. Facile à fabriquer et bon marché, il donnait de bons résultats, mais la découverte qu’il était également très toxique a fait que, dans les années 1930, il a été remplacé par le tétrachloroéthylène (connu dans le commerce sous le nom de « perc » pour son nom plus ancien de perchloroéthylène), qui a continué à être utilisé jusqu’à aujourd’hui, bien qu’il soit lui aussi remplacé en raison des préoccupations concernant son potentiel cancérigène.
Le tétrachlorure de carbone (comme on l’appelait affectueusement dans le laboratoire) a également trouvé sa place dans les petits extincteurs. Un fin jet était vaporisé par la chaleur du feu et éteignait ensuite l’incendie en supprimant les réactions de combustion.
À l’autre extrémité du spectre des températures, il a aidé de nombreux premiers réfrigérateurs à faire leur travail. Bien qu’initialement utilisé comme réfrigérant à part entière, son rôle principal était dans la production de gaz fréon comme le dichlorodifluorométhane. C’était la plus grande application industrielle du tétrachlorure de carbone jusqu’à ce que l’on découvre que ces gaz chlorofluorocarbonés (ou CFC) avaient un impact sérieux sur la couche d’ozone.
Peut-être le plus étrangement, c’était aussi un favori des collectionneurs de timbres. Souvent, le filigrane sur le papier est le seul moyen de distinguer avec certitude les variantes d’un timbre, aussi les collectionneurs de timbres ont-ils toujours été intéressés par les moyens de les rendre plus visibles. Aujourd’hui, ils utilisent probablement des lampes spécialisées, mais quelques gouttes de tétrachlorure de carbone ont été considérées à une époque comme un excellent moyen de révéler le filigrane sans endommager le papier. Il enlevait même les traces de graisse dans le processus.

Source : ©
Pour les utilisateurs du début du XXe siècle, le tétrachlorure de carbone semblait être une sorte de merveille à tout faire. Mais les fissures ont commencé à apparaître. En respirant les vapeurs, les travailleurs se sentaient d’abord intoxiqués, puis nauséeux, étourdis et sujets à des maux de tête. Avec le temps, on a découvert que l’exposition au tétrachlorure de carbone endommageait le système nerveux central et que des doses élevées inhibaient les fonctions hépatiques et rénales. À l’extrême, il peut tuer. On soupçonne également qu’il est cancérigène, bien que cela n’ait pas été clairement établi.
Pour aggraver les choses, le tétrachlorure de carbone peut se transformer en phosgène lorsqu’il est fortement chauffé. Ce gaz, connu pour son odeur de foin fraîchement fauché, a été utilisé de manière mortelle pendant la Première Guerre mondiale. Le phosgène bloque les protéines qui permettent à l’oxygène d’être traité par les alvéoles des poumons, laissant la victime sans air et mourante. Les extincteurs à gaz carbonique sont donc devenus des armes chimiques involontaires. Et pour couronner le tout, en tant que complice de la destruction de la couche d’ozone, il nuit à notre environnement, ainsi qu’à notre santé.
Ces problèmes ont entraîné un énorme déclin de l’utilisation du tétrachlorure de carbone. Il est certainement peu probable qu’il soit manipulé avec autant de désinvolture dans les laboratoires que par le passé et, bien qu’il soit encore utilisé pour fabriquer des réfrigérants, c’est un composé très ancien. L’âge d’or du tétrachlorure de carbone était une autre époque. Une époque où le risque venait loin derrière la nouveauté. Et pourtant, la simplicité de sa structure et l’exubérance juvénile de ses utilisations originales signifient qu’il ne faut pas l’oublier.
Meera Senthilingam
Et grâce à ce podcast, il ne le sera pas. C’était l’écrivain scientifique Brian Clegg, qui nous ramenait à une époque où le tétrachlorure de carbone était à son apogée. Maintenant, la semaine prochaine, nous continuons à regarder dans le passé et nous creusons pour révéler le côté plus sale des débuts de la biotechnologie.
Lars ?hrstr?m
Lorsque nous pensons à la biotechnologie, nous pensons à des réacteurs brillants en acier inoxydable, à des hommes et des femmes en blouse blanche, à des pipettes, des seringues et des processus contrôlés par ordinateur dans des salles blanches. Nous ne pensons généralement pas à des pelles, à du fumier, à de l’urine et à des chaudrons rouillés de taille humaine. Mais tels étaient les instruments et les réactifs des petermen, sans doute les premiers chimistes du gouvernement. Ces bandes d’hommes peu recommandables mais bien organisées ont fait des ravages dans les fermes du 17e siècle, creusant les granges et les étables dans une recherche sanctionnée par l’État de leur homonyme, le salpêtre ; autrement connu sous le nom de nitrate de potassium.
Meera Senthilingam
Et pour découvrir les utilisations du nitrate de potassium qui font qu’il vaut la peine de casudiung une telle destruction, rejoignez Lars ?hrstr?m dans la Chimie dans son élément de la semaine prochaine. D’ici là, merci de nous avoir écoutés. Je suis Meera Senthilingam.