Dossier clinique
Deux patients présentant un déficit en ornithine transcarbamylase, un trouble du cycle de l’urée, ont été transférés dans notre unité de soins intensifs en l’espace de 12 mois. Tous deux étaient des hommes auparavant en bonne santé qui ont initialement présenté des symptômes neurologiques indéfinis mais progressifs après des procédures mineures (résumés des cas dans l’encadré 1).
Chaque patient a développé ses premiers symptômes neurologiques (céphalées, lenteur mentale, incoordination) environ 24-48 heures après le précipitant probable, qui dans chaque cas était une dose unique de corticostéroïde. Chez le patient 1, la somnolence à 48 heures a évolué vers l’incoordination, une vision floue et une agitation sévère qui a nécessité une intubation 2 jours plus tard. Chez le patient 2, des maux de tête, des nausées, une vision trouble et des douleurs épigastriques à 48 heures ont évolué au cours des 2 jours suivants vers une confusion et un discours lent ; le jour suivant, un coma s’était développé, nécessitant une intubation.
Lors de leur présentation à un hôpital périphérique, un panel étendu d’investigations pathologiques avait été entrepris pour chaque patient, y compris des tests sanguins (numération globulaire complète, tests de la fonction rénale, niveaux d’enzymes hépatiques, profil de coagulation et marqueurs inflammatoires), une ponction lombaire et une imagerie cérébrale (tomographie par ordinateur et imagerie par résonance magnétique). Les résultats de ces examens étaient tous sans particularité.
L’identification d’une hyperammoniémie significative a été retardée jusqu’à environ 36-48 heures après la présentation à l’hôpital. Les patients étaient comateux lors de leur transfert à notre hôpital. Le patient 1 a eu un séjour prolongé dans notre unité de soins intensifs, avec un état de conscience minimale persistant ; le patient 2 est passé en état de mort cérébrale et a fait l’objet d’un don d’organes.
Les médecins connaissent les causes les plus courantes de l’hyperammoniémie, notamment une charge protéique accrue associée à une maladie du foie et un dysfonctionnement des enzymes du cycle de l’urée causé par des médicaments tels que le valproate de sodium. Les troubles héréditaires du cycle de l’urée (TUC) sont des causes moins courantes mais importantes d’élévation du taux d’ammoniac sanguin. Les formes les plus graves se manifestent au début de la vie, mais des formes plus légères de ces troubles peuvent devenir évidentes à l’âge adulte.
Les TUC sont un groupe d’erreurs innées du métabolisme, dont l’incidence totale est estimée entre 1:80001 et 1:30 0002 naissances. Elles sont dues à un dysfonctionnement de l’une des six enzymes ou des deux protéines de transport impliquées dans la biosynthèse de l’urée, un processus qui se déroule principalement dans le foie. Le cycle de l’urée est la voie terminale d’élimination de l’ammoniac formé lors du catabolisme des acides aminés. L’ammoniac est neurotoxique, et toute augmentation aiguë des taux sanguins au-delà de 50 μmol/L peut provoquer des symptômes neurologiques. Si des taux d’ammoniac supérieurs à 100 μmol/L peuvent provoquer une obturation, des élévations plus faibles doivent être interprétées dans le contexte clinique de leur survenue.
Le DUC affectant nos deux patients était un déficit en ornithine transcarbamylase (OTC), le plus courant des troubles du cycle de l’urée. Le déficit en OTC est un trait lié au chromosome X, et s’exprime donc plus fréquemment chez les hommes, bien que les femmes porteuses puissent décompenser après un stress important, tel qu’un accouchement.3 Les autres TUC sont des traits autosomiques récessifs.4
La première présentation à l’âge adulte peut être attribuée au degré plus léger du déficit, et souvent aussi à l’autolimitation de l’apport en protéines comme comportement appris, permettant la stabilité jusqu’à ce qu’un facteur de stress environnemental survienne. Les conditions qui entraînent des demandes accrues sur le cycle de l’urée, telles que la charge protéique, l’infection, les corticostéroïdes systémiques, la perte de poids rapide, la chirurgie, les traumatismes et la chimiothérapie,5 peuvent toutes précipiter la décompensation chez les personnes atteintes d’un DUC. Le cas d’un homme de 44 ans décédé d’un déficit en DUT non diagnostiqué auparavant après un pontage coronarien a été rapporté dans ce Journal en 2007.6
Dans les deux patients décrits dans notre article, une dose accidentelle unique mais significative de corticostéroïde a été l’événement précipitant initial, avec un jeûne prolongé perpétuant un cercle vicieux métabolique qui a culminé en une hyperammoniémie sévère.
L’hyperammoniémie chez l’adulte peut se présenter avec des symptômes psychiatriques ou neurologiques, notamment des céphalées, une confusion, une agitation avec un comportement combatif, une dysarthrie, une ataxie, des hallucinations et une déficience visuelle,3 symptômes qui reflètent une encéphalopathie métabolique toxique. Des symptômes abdominaux (nausées, vomissements) peuvent accompagner les phénomènes du système nerveux.
Nos deux cas illustrent l’évolution de l’hyperammoniémie progressive si le traitement n’est pas initié précocement : aggravation des troubles cognitifs et de l’œdème cérébral, avec développement d’un coma, de convulsions et d’un décès par hypertension intracrânienne.
Lorsqu’il n’y a pas d’explication alternative à la nature disproportionnée et progressive des troubles cognitifs d’un patient, cela doit être considéré comme un indice important pour explorer la possibilité d’une étiologie métabolique. Comme le déclin se produit sur une période de plusieurs jours, il existe une fenêtre pour une intervention de sauvetage si la condition est reconnue à temps.
La mesure du taux d’ammoniac sanguin dans le cadre d’un dépistage métabolique doit être effectuée à la première occasion possible dans un tel cas. Si le taux d’ammoniac est élevé, il convient de consulter un spécialiste du métabolisme, de préparer un profil d’acides aminés plasmatiques, de mesurer les acides organiques et l’acide orotique urinaires et de mettre en place un traitement d’urgence de l’hyperammoniémie.
Les trois éléments du traitement d’un coma hyperammoniémique lié au cycle de l’urée sont :
-
l’élimination physique de l’ammoniac par hémodialyse ou hémodiafiltration ;
-
l’inversion de l’état catabolique par une perfusion d’insuline/dextrose et d’intralipides ; et
-
la rétention temporaire de protéines et le début de l’utilisation de piégeurs d’azote, une fois disponibles.
Ces mesures doivent être initiées sous la direction d’un médecin métaboliste, et dans une unité de soins intensifs où l’agitation ou le coma peuvent être gérés. Les taux d’ammoniac peuvent être rapidement réduits par dialyse ; son élimination dépend des débits, ce qui fait de l’hémodialyse intermittente la méthode d’élimination la plus efficace, comme le montre l’encadré 2. Pour cette raison, nous préconisons la dialyse intermittente plutôt que l’hémodiafiltration veino-veineuse continue pour le contrôle précoce de l’ammoniac dans le contexte de l’urgence.
Bien qu’une déficience neurologique sévère au début du traitement soit très préoccupante, cela ne devrait pas être en soi une raison de suspendre le traitement, car une bonne récupération neurologique est possible. Ceci est illustré par le rapport de cas d’un patient d’âge moyen qui s’est rétabli, malgré une posture de décortication lorsque le traitement a été initié.5
Nous préconisons une évaluation précoce des niveaux d’ammoniac chez les patients présentant un état de conscience altéré inexpliqué, ou lorsque leur trouble cognitif semble disproportionné par rapport à toute maladie systémique concomitante. Bon nombre des éléments de soins nécessaires peuvent être initiés dans des unités de soins intensifs non tertiaires. L’instauration d’un traitement à l’hôpital de présentation est essentielle, car il s’agit d’une urgence médicale ; le résultat neurologique et la survie dépendent essentiellement du moment de l’intervention. S’il est reconnu tôt et traité de manière appropriée, le pronostic de récupération neurologique est bon.
Lessons pour la pratique
-
Les troubles du cycle de l’urée peuvent se manifester pour la première fois à l’âge adulte, démasqués par des déclencheurs tels qu’une maladie systémique, une charge protéique accrue, une intervention chirurgicale ou des corticostéroïdes.
-
L’évaluation des taux d’ammoniac est un test simple mais critique chez les patients présentant des troubles de la conscience inexpliqués.
-
Une séance d’hémodialyse intermittente est très efficace pour un contrôle rapide de l’ammoniac, et supérieure à l’hémodiafiltration continue pour une correction rapide.
-
Le traitement d’urgence de l’hyperammoniémie doit être entrepris précocement pour prévenir des lésions neurologiques dévastatrices.
Boîte 1 – Antécédents des deux patients
Patient 1 : 24 ans, homme
Analyse médicale
- Apnée obstructive du sommeil ; pas d’antécédents familiaux notables ; individu à haut niveau de fonctionnement
- Probable précipitant : dexaméthasone peropératoire (8 mg) pendant la septoplastie nasale
Évolution
- Vague et léthargie 48 h après l’opération, évoluant sur 24 h vers l’incohérence
- Intubé 12 h plus tard pour agitation sévère
- Le SGC a diminué à 5-6 sur les 48 h suivantes ; taux d’ammoniac, 334 μmol/L (RR, < 50 μmol/L) ; traitement spécifique à la maladie commencé
- Haugmentation des pressions intracrâniennes 6 h plus tard (pupilles dilatées avec œdème cérébral au CT cérébral), conduisant à une craniectomie décompressive compliquée d’un hématome frontal, nécessitant une évacuation
- Séjour prolongé en unité de soins intensifs et à l’hôpital
Outcome
- État de conscience minimale persistant (à 22 mois)
- Sortie en établissement de soins infirmiers
- Analyse biochimique du plasma et des urines compatible avec une carence en OTC (acide orotique urinaire élevé ; taux de glutamine plasmatique élevé ; taux d’ornithine, de citrulline et d’arginine plasmatiques faibles)
- Les tests génétiques ont confirmé la mutation du gène OTC associée au déficit en OTC
Patient 2 : 39 ans, homme
Analyse médicale
- Douleur chronique au genou ; pas d’antécédents familiaux notables ; individu au fonctionnement élevé
- Précipitant probable : injection de cortisone dans le genou pour douleur au genou
Progression
- Maux de tête, nausées, douleurs épigastriques, vision trouble et incoordination 48 h après l’injection
- Progression au cours des 48 h suivantes vers la confusion, ralentissement de l’élocution
- Dégradation progressive du GCS, nécessitant une intubation
- Activité convulsive
- Un nouveau CT cérébral a montré un œdème cérébral
- Taux d’ammoniac : 652 μmol/L (RR, < 50 μmol/L) ; début du traitement spécifique à la maladie ; mise en place d’un moniteur de pression intracrânienne ; absence de contrôle de l’hypertension intracrânienne ; décision de pallier
Outcome
- Procédure de mort cérébrale et de don d’organes (sauf don de foie : contre-indiqué)
- Résultats biochimiques compatibles avec un déficit en OTC (élévation profonde de l’acide orotique urinaire, taux de glutamine plasmatique élevé, taux d’arginine faible)
- Les tests génétiques ont confirmé la mutation du gène OTC associée au déficit en OTC
GCS = Glasgow coma score ; RR = intervalle de référence ; CT = tomographie assistée par ordinateur ; OTC = ornithine transcarbamylase.
Boîte 2 – Niveaux d’ammoniac chez nos deux patients, et leur réponse au traitement*
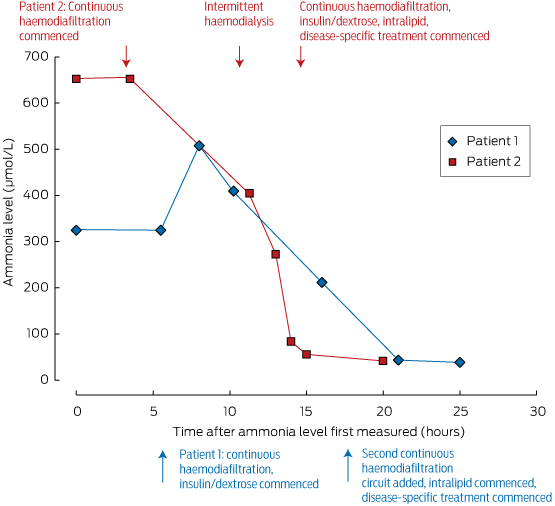
* Notez le taux rapide de diminution des niveaux d’ammoniac sérique chez le patient 2 réalisé après le début de l’hémodialyse intermittente (environ 10 heures après la première mesure).