
Tapez vos exemples ici.
- 9.1 Molécules de signalisation et récepteurs cellulaires
- 9.2 Propagation du signal
- 9.3 Réponse au signal
Imaginez ce que serait la vie si vous et les personnes qui vous entourent ne pouvaient pas communiquer. Vous ne seriez pas en mesure d’exprimer vos souhaits aux autres, ni de poser des questions pour en savoir plus sur votre environnement. L’organisation sociale dépend de la communication entre les individus qui composent cette société.
Comme pour les personnes, il est vital pour les cellules individuelles de pouvoir interagir avec leur environnement et entre elles. Cela est vrai qu’une cellule se développe seule dans un bassin ou qu’elle soit l’une des nombreuses cellules qui forment un organisme plus vaste. Afin de répondre correctement aux stimuli externes, les cellules ont développé des mécanismes complexes de communication afin de pouvoir recevoir un message, transférer l’information à travers la membrane plasmique, puis produire des changements à l’intérieur de la cellule en réponse au message.
Dans les organismes multicellulaires, les cellules envoient et reçoivent constamment des messages chimiques pour coordonner les actions des autres organes, tissus et cellules. La capacité à envoyer des messages rapidement et efficacement permet aux cellules de coordonner et d’affiner leurs fonctions. Si la nécessité de la communication cellulaire dans les grands organismes semble évidente, même les organismes unicellulaires communiquent entre eux. Les cellules de levure se signalent mutuellement pour faciliter l’accouplement. Certaines formes de bactéries coordonnent leurs actions afin de former de grands complexes appelés biofilms ou d’organiser la production de toxines pour éliminer les organismes concurrents. La capacité des cellules à communiquer par des signaux chimiques est apparue dans les cellules uniques et a été essentielle à l’évolution des organismes multicellulaires. Une communication efficace et sans erreur est vitale pour toute vie.
- 9.1 | Molécules de signalisation et récepteurs cellulaires
- 9.1.1 Formes de signalisation
- Signalisation paracrine
- Signalisation autocrine
- Signalisation endocrine
- Signalisation directe
- 9.1.2 Types de récepteurs
- Récepteurs internes
- Récepteurs de surface cellulaire
- 9.1.3 Molécules de signalisation
- Petits ligands hydrophobes
- Ligands hydrosolubles
- 9.2 | Propagation du signal
- 9.2.1 Voies de signalisation et amplification du signal
- 9.2.2 Méthodes de signalisation intracellulaire
- Phosphorylation
- Les seconds messagers
- 9.3 | Réponse au signal
- 9.3.1 Réponses à la voie de signalisation
- Expression génétique
- Augmentation du métabolisme cellulaire
- Croissance cellulaire
- Mort cellulaire
- 9.3.2 Terminaison des voies de signalisation
9.1 | Molécules de signalisation et récepteurs cellulaires
À la fin de cette section, vous serez en mesure de :
- Décrire quatre types de signalisation trouvés dans les organismes multicellulaires.
- Comparer les récepteurs internes aux récepteurs de surface cellulaire.
- Reconnaître la relation entre la chimie d’un ligand et son mécanisme d’action.
Il existe deux types de communication dans le monde des cellules vivantes. La communication entre les cellules est appelée signalisation intercellulaire, et la communication à l’intérieur d’une cellule est appelée signalisation intracellulaire. Un moyen facile de se souvenir de la distinction est de comprendre que le préfixe inter- signifie « entre » (une autoroute interétatique traverse plusieurs états) et intra- signifie « à l’intérieur » (une IV signifie intraveineuse ou « à l’intérieur de la veine »).
Les signaux chimiques sont libérés par une cellule de signalisation et reçus par une cellule cible. Les cellules cibles possèdent des protéines appelées récepteurs, qui se lient aux molécules de signalisation et provoquent une réponse. Les molécules de signalisation qui se lient aux récepteurs sont appelées ligands. Les ligands et les récepteurs sont spécifiques les uns des autres ; un récepteur ne se lie généralement qu’à son ligand spécifique. Cependant, il existe différents types de signalisation.
9.1.1 Formes de signalisation
On trouve quatre catégories de signalisation chimique dans les organismes multicellulaires : la signalisation autocrine, la signalisation paracrine, la signalisation endocrine et la signalisation directe à travers les jonctions gap (figure 9.2). La principale différence entre les différentes catégories de signalisation est la distance parcourue par le signal pour atteindre la cellule cible.
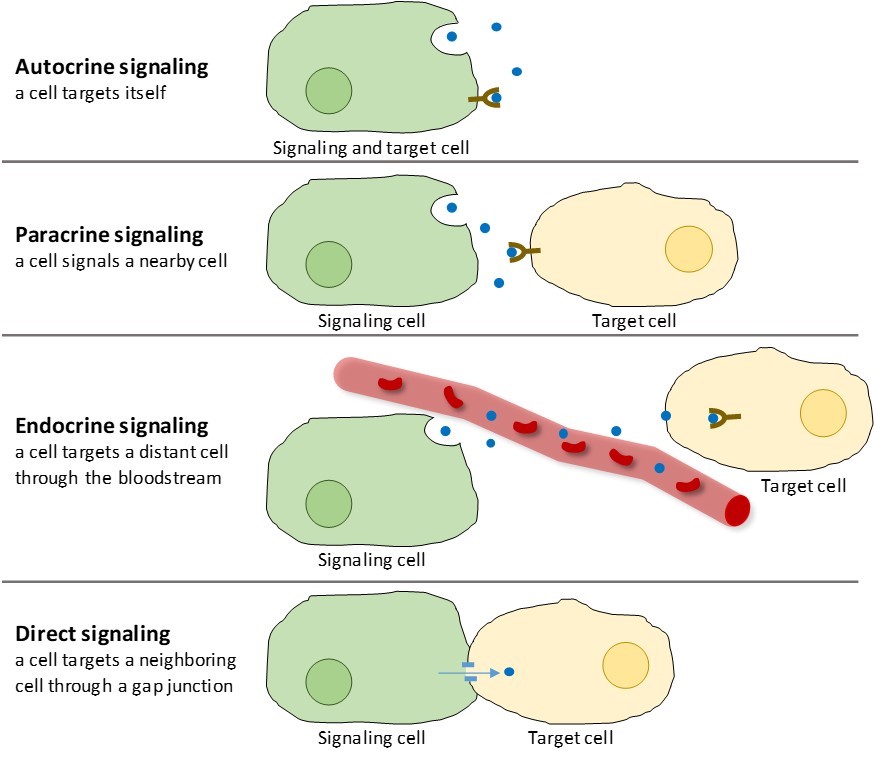
Signalisation paracrine
Les signaux qui agissent localement entre des cellules proches sont appelés signaux paracrines. Les signaux paracrines se déplacent par diffusion à travers la matrice extracellulaire (figure 9.2). Ces types de signaux provoquent généralement des réponses rapides qui ne durent que peu de temps. Pour que la réponse reste localisée, les ligands paracrines sont généralement rapidement dégradés par des enzymes ou éliminés par les cellules voisines. L’élimination des signaux rétablit le gradient de concentration de la molécule signal, ce qui leur permet de diffuser rapidement dans l’espace intracellulaire s’ils sont à nouveau libérés.
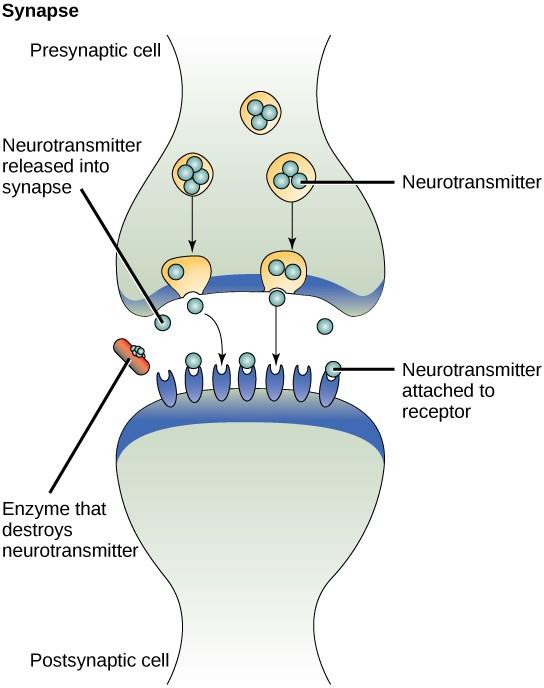
Un exemple de signalisation paracrine est le transfert de signaux entre les cellules nerveuses. Le minuscule espace entre les cellules nerveuses où se produit la transmission du signal s’appelle une synapse. Les signaux sont propagés le long des cellules nerveuses par des impulsions électriques rapides. Lorsque ces impulsions atteignent l’extrémité d’une cellule nerveuse, des ligands chimiques appelés neurotransmetteurs sont libérés dans la synapse par la cellule présynaptique (la cellule qui émet le signal). Les neurotransmetteurs se diffusent à travers la synapse (figure 9.3). La faible distance entre les cellules nerveuses permet au signal de se propager rapidement, ce qui permet une réponse immédiate, comme « enlève ta main de la cuisinière ». Lorsque le neurotransmetteur se lie au récepteur à la surface de la cellule postsynaptique, l’impulsion électrique suivante est lancée. Les neurotransmetteurs sont dégradés rapidement ou sont réabsorbés par la cellule présynaptique afin que la cellule nerveuse réceptrice puisse récupérer rapidement et être prête à répondre rapidement au prochain signal synaptique.
Signalisation autocrine
Lorsqu’une cellule répond à sa propre molécule de signalisation, on parle de signalisation autocrine (auto = « soi »). La signalisation autocrine se produit souvent avec d’autres types de signalisation. Par exemple, lorsqu’un signal paracrine est libéré, la cellule de signalisation peut répondre au signal en même temps que ses voisines (figure 9.2).
La signalisation autocrine se produit souvent au début du développement d’un organisme pour s’assurer que les cellules se développent dans les bons tissus. La signalisation autocrine régule également la sensation de douleur et les réponses inflammatoires. De plus, si une cellule est infectée par un virus, la cellule peut se signaler pour subir une mort cellulaire programmée, tuant le virus dans le processus.
Signalisation endocrine
Les signaux provenant de cellules distantes sont appelés signaux endocrines, et ils proviennent des cellules endocrines. (Dans le corps, de nombreuses cellules endocrines sont situées dans les glandes endocrines, comme la glande thyroïde, l’hypothalamus et la glande pituitaire). Ces types de signaux produisent généralement une réponse plus lente mais ont un effet plus durable. Les ligands libérés dans la signalisation endocrine sont appelés hormones, des molécules de signalisation qui sont produites dans une partie du corps mais qui affectent d’autres régions du corps à une certaine distance (figure 9.2).
Les hormones parcourent les grandes distances entre les cellules endocrines et leurs cellules cibles via la circulation sanguine, qui est un moyen relativement lent de se déplacer dans le corps. En raison de leur forme de transport, les hormones se diluent et sont présentes en faibles concentrations lorsqu’elles agissent sur leurs cellules cibles. Ceci est différent de la signalisation paracrine, dans laquelle les concentrations locales de molécules de signalisation peuvent être très élevées.
Signalisation directe
Les jonctions gap chez les animaux et les plasmodesmes chez les plantes sont des connexions entre les membranes plasmiques de cellules voisines. Ces canaux remplis d’eau permettent à de petites molécules de signalisation de diffuser entre les deux cellules. Les petites molécules, telles que les ions calcium (Ca2+), sont capables de se déplacer entre les cellules, mais les grosses molécules comme les protéines et l’ADN ne peuvent pas passer par les canaux. La spécificité des canaux fait que les cellules restent indépendantes mais peuvent transmettre rapidement et facilement des signaux. La signalisation directe permet à un groupe de cellules de coordonner leur réponse à un signal qu’une seule d’entre elles a pu recevoir. Chez les plantes, les plasmodesmes sont omniprésents, faisant de la plante entière un réseau de communication géant.
9.1.2 Types de récepteurs
Les récepteurs sont des molécules protéiques dans la cellule cible ou à sa surface qui se lient à des ligands. Il existe deux types de récepteurs, les récepteurs internes et les récepteurs de surface cellulaire.
Récepteurs internes
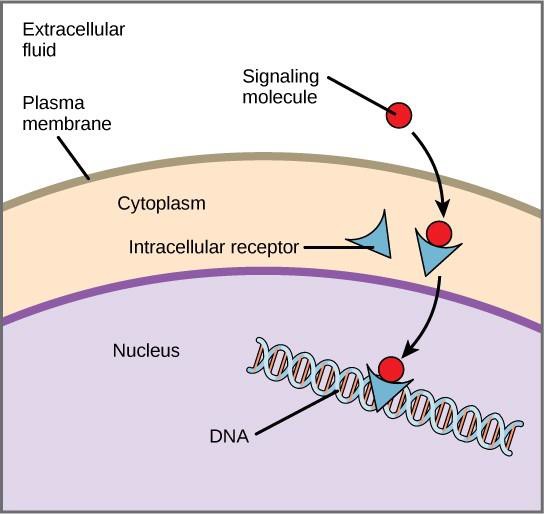
Les récepteurs internes, également appelés récepteurs intracellulaires ou cytoplasmiques, se trouvent dans le cytoplasme des cellules cibles et répondent aux molécules ligands hydrophobes qui sont capables de traverser la membrane plasmique. Une fois à l’intérieur de la cellule, beaucoup de ces molécules se lient à des protéines qui agissent comme régulateurs de la synthèse de l’ARNm (transcription) pour médier l’expression des gènes.
L’expression des gènes est le processus cellulaire de transformation de l’information contenue dans l’ADN d’une cellule en une séquence d’acides aminés, qui forme finalement une protéine. Lorsque le ligand se lie au récepteur interne, un changement de conformation est déclenché qui expose un site de liaison à l’ADN sur la protéine réceptrice. Le complexe ligand-récepteur se déplace dans le noyau, puis se lie à des régions régulatrices spécifiques de l’ADN chromosomique et favorise l’initiation de la transcription (figure 9.4). La transcription est le processus qui consiste à copier les informations contenues dans l’ADN d’une cellule dans une forme spéciale d’ARN appelée ARN messager (ARNm) ; la cellule utilise les informations contenues dans l’ARNm pour lier des acides aminés spécifiques dans le bon ordre, produisant ainsi une protéine. Ainsi, lorsqu’un ligand se lie à un récepteur interne, il peut influencer directement l’expression génique dans la cellule cible.
Récepteurs de surface cellulaire
Les récepteurs de surface cellulaire, également appelés récepteurs transmembranaires, sont des protéines intégrales qui se lient à des molécules de signalisation externes. Ces récepteurs enjambent la membrane plasmique et effectuent la transduction du signal, dans laquelle un signal extracellulaire est converti en un signal intercellulaire. (Figure 9.5). Les protéines réceptrices de la surface cellulaire étant fondamentales pour le fonctionnement normal des cellules, il n’est pas surprenant qu’un dysfonctionnement de l’une de ces protéines puisse avoir de graves conséquences. Il a été démontré que des erreurs dans les structures protéiques de certaines molécules réceptrices jouent un rôle dans l’hypertension (pression artérielle élevée), l’asthme, les maladies cardiaques et le cancer.
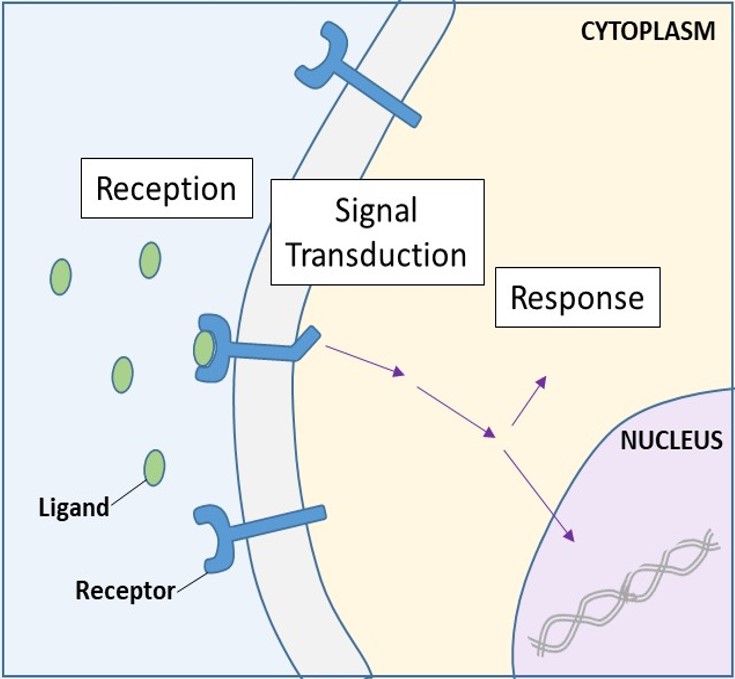
Chaque récepteur de surface cellulaire possède trois composants principaux : un domaine de liaison au ligand externe, ou domaine extracellulaire ; une région hydrophobe qui traverse la membrane ; et un domaine intracellulaire. Les récepteurs de surface sont impliqués dans la plupart des signaux émis par les organismes multicellulaires. Il existe trois catégories générales de récepteurs de surface cellulaire : les récepteurs liés aux enzymes, les récepteurs liés aux canaux ioniques et les récepteurs liés aux protéines G.
Les récepteurs liés aux enzymes sont des récepteurs de surface cellulaire avec des domaines intracellulaires qui sont associés à une enzyme. Dans certains cas, le domaine intracellulaire du récepteur lui-même est une enzyme. D’autres récepteurs liés à une enzyme possèdent un petit domaine intracellulaire qui interagit directement avec une enzyme. Les récepteurs liés à une enzyme ont normalement de grands domaines extracellulaires et intracellulaires, mais la région qui traverse la membrane consiste en une seule hélice alpha dans le brin peptidique.
Lorsqu’un ligand se lie au domaine extracellulaire d’un récepteur lié à une enzyme, un signal est transféré à travers la membrane, activant l’enzyme. L’activation de l’enzyme déclenche une chaîne d’événements au sein de la cellule qui conduit finalement à une réponse.
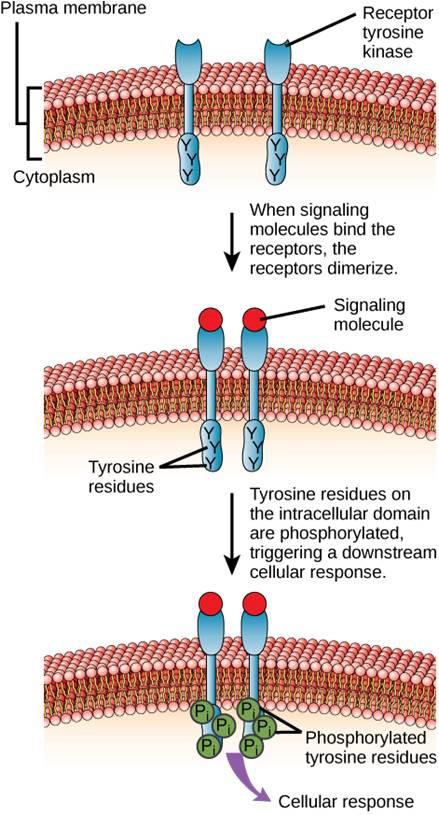
Un exemple de récepteur lié à une enzyme est le récepteur tyrosine kinase (figure 9.6). Une kinase est une enzyme qui transfère les groupes phosphates de l’ATP à une autre protéine. Le récepteur de la tyrosine kinase transfère les groupes phosphates aux molécules de tyrosine. Tout d’abord, les molécules de signalisation se lient au domaine extracellulaire de deux récepteurs à tyrosine kinase voisins. Les deux récepteurs voisins se lient alors ensemble, ou se dimérisent. Des phosphates sont ensuite ajoutés aux résidus de tyrosine du domaine intracellulaire des récepteurs (phosphorylation). Les résidus phosphorylés peuvent alors transmettre le signal au messager suivant dans le cytoplasme.
Les récepteurs du facteur de croissance épidermique sont un exemple de récepteurs tyrosine kinases qui suit ce mode de signalisation. Les défauts de la signalisation ErbB de cette famille peuvent conduire à des maladies neuromusculaires telles que la sclérose en plaques et la maladie d’Alzheimer.
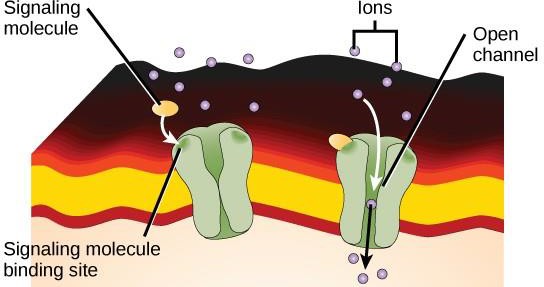
Les récepteurs liés à un canal ionique se lient à un ligand et ouvrent un canal à travers la membrane qui permet le passage d’ions spécifiques. Ce type de récepteur de surface cellulaire possède une région étendue de la membrane avec des acides aminés hydrophobes. À l’inverse, les acides aminés qui tapissent l’intérieur du canal sont hydrophiles pour permettre le passage des ions. Lorsqu’un ligand se lie à la région extracellulaire du canal, il se produit un changement de conformation dans la structure de la protéine qui permet le passage d’ions tels que le sodium, le calcium, le magnésium ou l’hydrogène (figure 9.7).
Les récepteurs liés aux protéines G se lient à un ligand et activent une protéine G associée. La protéine G activée interagit ensuite avec une protéine membranaire proche, qui peut être un canal ionique ou une enzyme (figure 9.8). Tous les récepteurs liés aux protéines G possèdent sept domaines transmembranaires, mais chaque récepteur possède un domaine extracellulaire spécifique et un site de liaison aux protéines G.
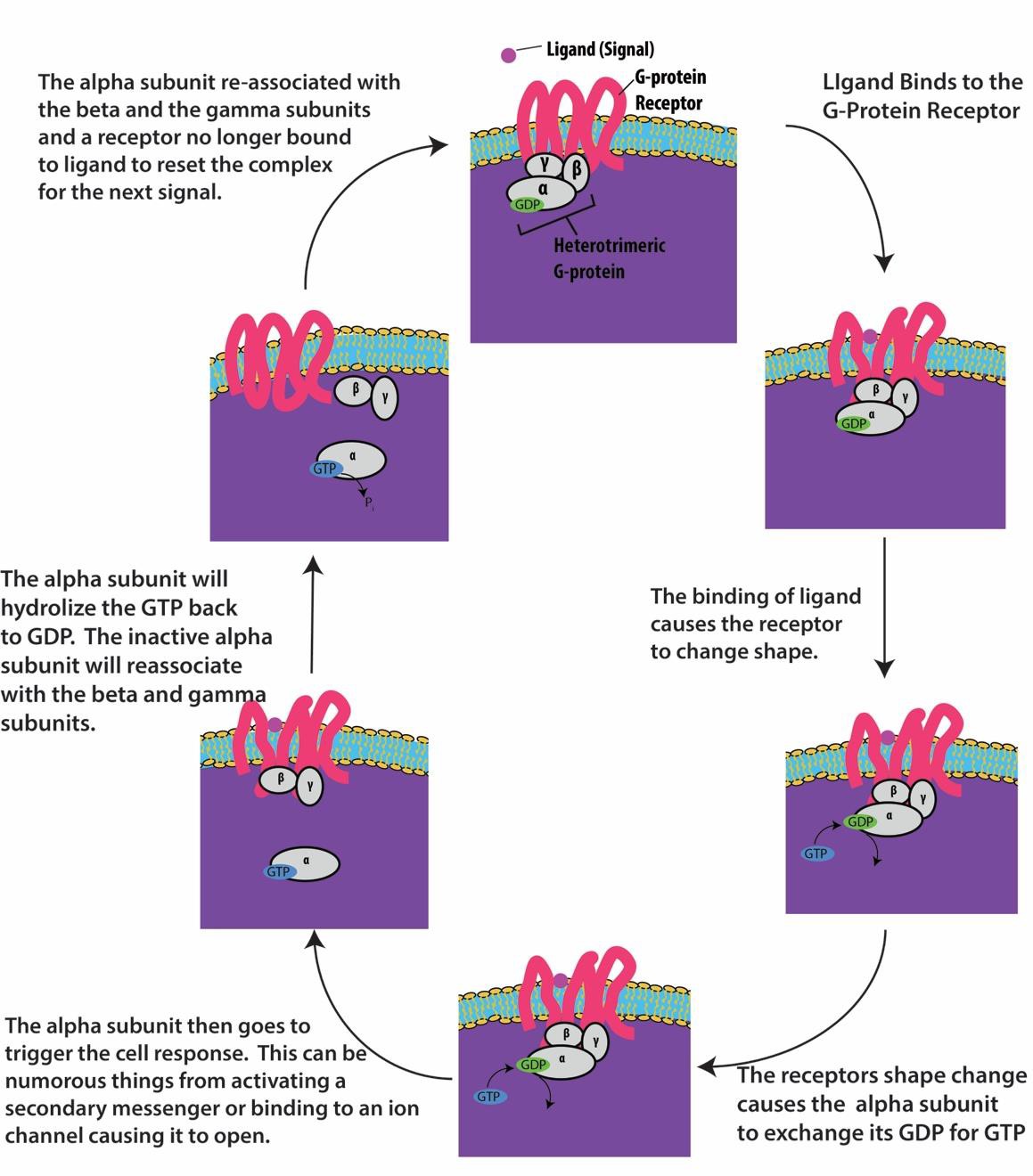
La signalisation cellulaire à l’aide de récepteurs liés aux protéines G se produit sous forme de cycle. Une fois que le ligand se lie au récepteur, le changement de forme qui en résulte active la protéine G, qui libère le GDP et capte le GTP. Les sous-unités de la protéine G se divisent alors en sous-unités α et βγ. L’un ou les deux fragments de la protéine G peuvent être capables d’activer d’autres protéines dans la cellule. Après un certain temps, le GTP présent sur la sous-unité α active de la protéine G est hydrolysé en GDP et la sous-unité βγ est désactivée. Les sous-unités se réassocient pour former la protéine G inactive et le cycle recommence (figure 9.8).
Les récepteurs liés aux protéines G sont utilisés dans de nombreux processus physiologiques, notamment ceux de la transduction de la vision, du goût et de la régulation du système immunitaire et de l’inflammation.

HER2 est un récepteur tyrosine kinase. Dans 30 % des cancers du sein humains, HER2 est activé en permanence, ce qui entraîne une division cellulaire non régulée. Le lapatinib, un médicament utilisé pour traiter le cancer du sein, inhibe le processus par lequel le récepteur se phosphoryle, réduisant ainsi la croissance tumorale de 50 pour cent. Laquelle des étapes suivantes serait inhibée par le Lapatinib ?
- La liaison de la molécule de signalisation, la dimérisation et la réponse cellulaire en aval
- Dimérisation, et la réponse cellulaire en aval
- La réponse cellulaire en aval
- L’activité de la phosphatase, la dimérisation et la réponse cellulaire en aval
9.1.3 Molécules de signalisation
Produits par les cellules de signalisation, les ligands sont des signaux chimiques qui se déplacent vers les cellules cibles et provoquent une réponse. Les types de molécules qui servent de ligands sont incroyablement variés et vont des petites protéines aux petits ions. Les ligands sont classés en deux catégories : les petits ligands hydrophobes, qui peuvent traverser les membranes plasmatiques, et les ligands hydrosolubles, qui ne le peuvent pas.
Petits ligands hydrophobes
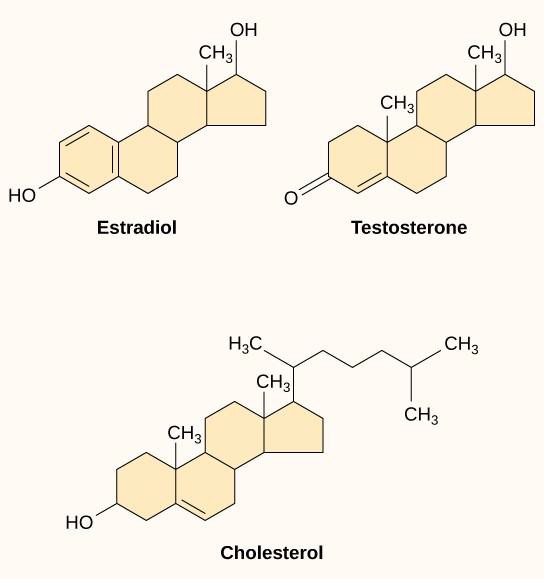
Les petits ligands hydrophobes, également appelés ligands liposolubles, peuvent diffuser directement à travers la membrane plasmique et interagir avec les récepteurs internes. Les membres importants de cette classe de ligands sont les hormones stéroïdes. Les stéroïdes sont des lipides dont le squelette hydrocarboné comporte quatre cycles fusionnés ; les différents stéroïdes ont des groupes fonctionnels différents attachés au squelette carboné. Les hormones stéroïdes comprennent l’hormone sexuelle féminine œstradiol, qui est un type d’œstrogène, l’hormone sexuelle masculine testostérone et le cholestérol, qui est un composant structurel important des membranes biologiques et un précurseur des hormones stéroïdes (figure 9.10). D’autres hormones hydrophobes comprennent les hormones thyroïdiennes et la vitamine D. Pour être solubles dans le sang, les ligands hydrophobes doivent se lier à des protéines porteuses pendant leur transport dans la circulation sanguine.
Ligands hydrosolubles
Comme les ligands hydrosolubles sont polaires, ils ne peuvent pas traverser la membrane plasmique sans aide. Parfois, ils sont trop gros pour traverser la membrane tout court. Au lieu de cela, la plupart des ligands hydrosolubles se lient au domaine extracellulaire des récepteurs de surface cellulaire (voir figure 9.5). Ce groupe de ligands est assez diversifié et comprend des petites molécules, des peptides et des protéines.
9.2 | Propagation du signal
À la fin de cette section, vous serez en mesure :
- D’expliquer comment la liaison d’un ligand initie la transduction du signal à travers une cellule.
- Reconnaître que les signaux intracellulaires sont transmis par le rôle de la phosphorylation ou des seconds messagers.
Une fois qu’un ligand hydrosoluble se lie à son récepteur, le signal est transmis à travers la membrane et dans le cytoplasme. La poursuite d’un signal de cette manière est appelée transduction du signal (figure 9.5). La transduction du signal ne se produit qu’avec les récepteurs de la surface cellulaire puisque les récepteurs internes sont capables de pénétrer dans la cellule.
Lorsqu’un ligand se lie à son récepteur, des changements de conformation se produisent qui affectent le domaine intracellulaire du récepteur. Ces changements de conformation conduisent à l’activation du domaine intracellulaire ou de ses protéines associées. Dans certains cas, la liaison du ligand entraîne la dimérisation du récepteur, ce qui signifie que deux récepteurs se lient l’un à l’autre pour former un complexe stable appelé dimère. Un dimère est un composé chimique formé lorsque deux molécules (souvent identiques) s’assemblent. La liaison des récepteurs de cette manière permet à leurs domaines intracellulaires d’entrer en contact étroit et de s’activer mutuellement.
9.2.1 Voies de signalisation et amplification du signal
Bien que les molécules de signalisation se trouvent souvent à des concentrations très faibles, elles peuvent produire des effets profonds. Après que le ligand se lie au récepteur de la surface cellulaire, l’activation des composants intracellulaires du récepteur déclenche une chaîne d’événements que l’on appelle une voie de signalisation ou une cascade de signalisation. Dans une voie de signalisation, les seconds messagers, les enzymes et/ou les protéines activées activent d’autres protéines ou messagers (figure 9.11). Chaque membre de la voie peut activer des milliers de membres de la voie suivante dans un processus appelé amplification du signal. Comme le signal est amplifié à chaque étape, une réponse très importante peut être générée à partir d’un seul récepteur liant un ligand.
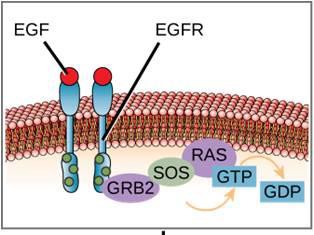
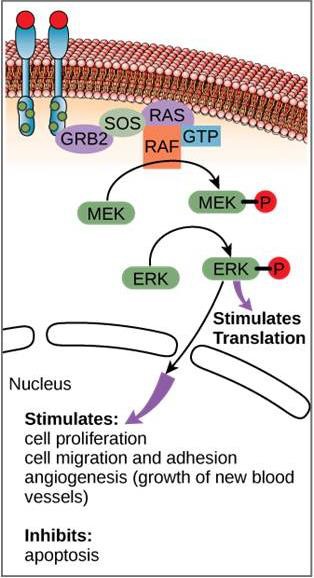
Un exemple de voie de signalisation est présenté à la figure 9.11. Le facteur de croissance épidermique (EGF) est une molécule de signalisation qui intervient dans la régulation de la croissance cellulaire, la cicatrisation et la réparation des tissus. Le récepteur de l’EGF (EGFR) est une tyrosine kinase. Une kinase activée phosphoryle et active de nombreuses molécules en aval. Lorsque l’EGF se lie à l’EGFR, une cascade d’événements de phosphorylation en aval signale à la cellule qu’elle doit croître et se diviser. Si l’EGFR est activé à des moments inappropriés, une croissance cellulaire incontrôlée (cancer) peut se produire.
Dans certains cancers, l’activité GTPase de la protéine G RAS est inhibée. Cela signifie que la protéine RAS ne peut plus hydrolyser le GTP en GDP. Quel effet cela aurait-il sur les événements cellulaires en aval ?
9.2.2 Méthodes de signalisation intracellulaire
L’induction d’une voie de signalisation dépend de la modification d’un composant cellulaire par une enzyme. Il existe de nombreuses modifications enzymatiques qui peuvent se produire pour activer le composant suivant de la voie. Voici quelques-uns des événements les plus courants de la signalisation intracellulaire.
Phosphorylation
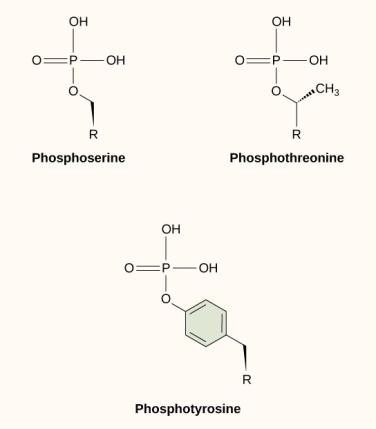
L’une des modifications chimiques les plus courantes qui se produit dans les voies de signalisation est l’ajout d’un groupe phosphate à une molécule dans un processus appelé phosphorylation. Le phosphate peut être ajouté à un nucléotide tel que le GMP pour former le GDP ou le GTP. Les phosphates sont également souvent ajoutés aux résidus de sérine, de thréonine et de tyrosine des protéines, où ils remplacent le groupe hydroxyle de l’acide aminé (figure 9.12). Le transfert du phosphate est catalysé par une enzyme appelée kinase. La phosphorylation peut activer ou inactiver des enzymes, et le renversement de la phosphorylation, la déphosphorylation, inversera l’effet.
Les seconds messagers
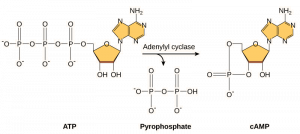
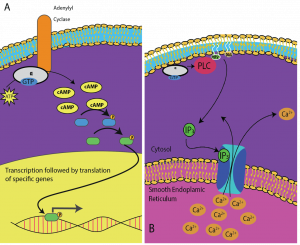
Les seconds messagers sont de petites molécules qui propagent un signal après qu’il ait été initié par la liaison de la molécule de signalisation au récepteur. Ces molécules aident à diffuser un signal dans le cytoplasme en modifiant le comportement de certaines protéines cellulaires. L’AMP cyclique (cAMP) est un second messager utilisé par de nombreux types de cellules. L’AMP cyclique est synthétisé par l’enzyme adénylyl cyclase à partir de l’ATP (figure 9.13). Le rôle principal de l’AMPc dans les cellules est de se lier à une enzyme appelée kinase dépendante de l’AMPc (A-kinase) et de l’activer. L’A-kinase régule de nombreuses voies métaboliques vitales : Elle phosphoryle les résidus de sérine et de thréonine de ses protéines cibles, les activant au passage. La A-kinase est présente dans de nombreux types de cellules, et les protéines cibles sont différentes dans chaque type de cellule. Un autre messager secondaire est le Ca2+qui peut être libéré pour inonder la cellule.
Les différentes cellules répondent différemment à l’AMPc. Dans la figure 9.14, la sous-unité alpha d’un récepteur à protéine G est représentée en train d’activer deux types de signalisation différents. Dans la première image, l’AMPc est produit par l’enzyme adénylate cyclase lorsqu’il est activé par la sous-unité alpha. L’AMPc active ensuite d’autres protéines qui affectent la transcription des gènes. Dans la deuxième image, la sous-unité alpha de la protéine G déclenche une cascade qui libère le Ca2+ du réticulum endoplasmique lisse. Dans ce cas, le Ca2+ est le messager secondaire qui provoque la réponse cellulaire.
9.3 | Réponse au signal
À la fin de cette section, vous serez en mesure de :
- Connaître que les voies de signalisation dirigent l’expression des protéines, le métabolisme cellulaire et la croissance cellulaire.
- Reconnaître le rôle de l’apoptose dans le développement et le maintien d’un organisme sain.
Utilisant les voies de transduction du signal, les récepteurs de la membrane plasmique produisent une variété d’effets sur la cellule. À l’intérieur de la cellule, les ligands se lient à leurs récepteurs internes, ce qui leur permet d’affecter directement l’ADN de la cellule et les mécanismes de production de protéines. Les résultats des voies de signalisation sont extrêmement variés et dépendent du type de cellule concerné ainsi que des conditions externes et internes. Un petit échantillon de réponses est décrit ci-dessous.
9.3.1 Réponses à la voie de signalisation
Expression génétique
Certaines voies de transduction du signal régulent la transcription de l’ARN. D’autres régulent la traduction des protéines.
Augmentation du métabolisme cellulaire
L’activation des récepteurs β-adrénergiques des cellules musculaires par l’adrénaline entraîne une augmentation de l’AMP cyclique à l’intérieur de la cellule. L’adrénaline est une hormone produite par la glande surrénale qui prépare le corps à des urgences à court terme.
Croissance cellulaire
Les voies de signalisation cellulaire jouent également un rôle majeur dans la division cellulaire. Les cellules ne se divisent normalement pas à moins d’être stimulées par des signaux provenant d’autres cellules. Les ligands qui favorisent la croissance cellulaire sont appelés facteurs de croissance. La plupart des facteurs de croissance se lient à des récepteurs de surface cellulaire qui sont liés à des tyrosines kinases.
Mort cellulaire
Lorsqu’une cellule est endommagée, superflue ou potentiellement dangereuse pour un organisme, une cellule peut initier un mécanisme pour déclencher la mort cellulaire programmée, ou apoptose. L’apoptose permet à une cellule de mourir d’une manière contrôlée qui empêche la libération de molécules potentiellement dommageables à l’intérieur de la cellule. Cependant, dans certains cas, comme une infection virale ou une division cellulaire incontrôlée due à un cancer, les mécanismes normaux de contrôle de la cellule ne fonctionnent pas. Des signaux externes peuvent également déclencher l’apoptose. Par exemple, la plupart des cellules animales normales possèdent des récepteurs qui interagissent avec la matrice extracellulaire, un réseau de glycoprotéines qui fournit un support structurel aux cellules animales. La liaison des récepteurs cellulaires à la matrice extracellulaire déclenche une cascade de signaux à l’intérieur de la cellule. Toutefois, si la cellule s’éloigne de la matrice extracellulaire, la signalisation cesse et la cellule subit une apoptose. Ce système permet d’empêcher les cellules de se déplacer dans l’organisme et de proliférer de manière incontrôlée, comme cela se produit avec les cellules tumorales qui se métastasent.
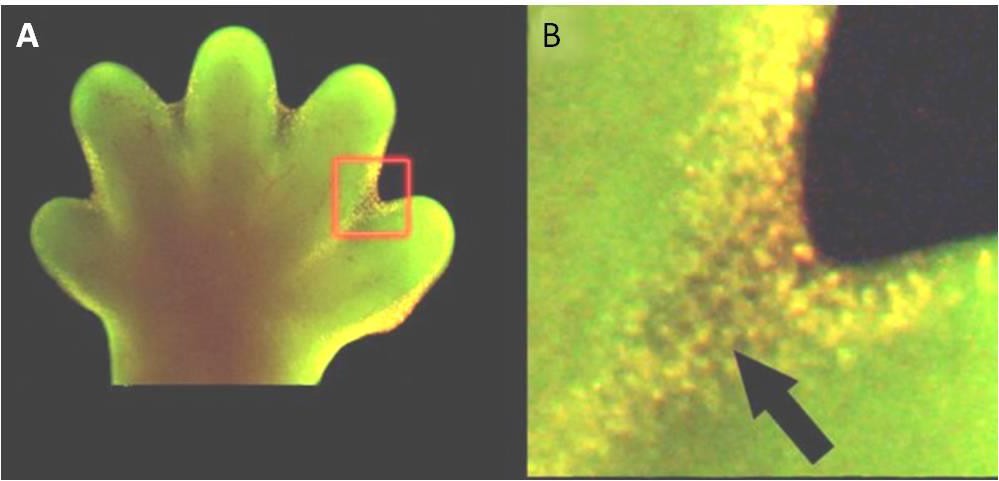
L’apoptose est également essentielle au développement embryologique normal. Chez les vertébrés, par exemple, les premiers stades du développement comprennent la formation de tissus en forme de toile entre les doigts et les orteils individuels (figure 9.15). Au cours du développement normal, ces cellules inutiles doivent être éliminées, ce qui permet la formation de doigts et d’orteils complètement séparés. Un mécanisme de signalisation cellulaire déclenche l’apoptose, qui détruit les cellules entre les doigts en développement.
9.3.2 Terminaison des voies de signalisation
La signalisation aberrante souvent observée dans les cellules tumorales est la preuve que la terminaison d’un signal au moment approprié peut être tout aussi importante que l’initiation d’un signal. Une méthode pour stopper un signal spécifique consiste à dégrader le ligand ou à l’éliminer de sorte qu’il ne puisse plus accéder à son récepteur. L’une des raisons pour lesquelles les hormones hydrophobes comme les œstrogènes et la testostérone déclenchent des événements de longue durée est qu’elles se lient à des protéines porteuses. Ces protéines permettent aux molécules insolubles d’être solubles dans le sang, mais elles protègent également les hormones de la dégradation par les enzymes circulantes.
À l’intérieur de la cellule, de nombreuses enzymes différentes inversent les modifications cellulaires qui résultent des cascades de signalisation. Par exemple, les phosphatases sont des enzymes qui enlèvent le groupe phosphate attaché aux protéines par les kinases dans un processus appelé déphosphorylation. L’AMPc est dégradé en AMP par la phosphodiestérase, mettant ainsi fin à son signal. De même, la libération des réserves de calcium est inversée par les pompes à Ca2+ qui sont situées dans les membranes cellulaires.
.