La guanosine triphosphate (Guanosine-5′-triphosphate pour être précis ou aussi communément abrégé GTP pour plus de simplicité) est un nucléotide de haute énergie (à ne pas confondre avec le nucléoside) présent dans le cytoplasme ou polymérisé pour former la base guanine.
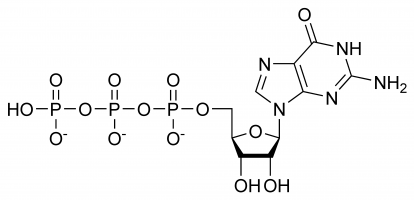
Le GTP a des rôles sélectifs dans la formation des brins d’ARN, fonctionnant comme une molécule porteuse d’énergie pour la synthèse des protéines, un coenzyme, un prédécesseur de la GMPc – une molécule messagère secondaire ou comme une molécule effectrice. Les deux dernières fonctions sont généralement démontrées par la modulation de la protéine G. Tous ces rôles sont le résultat de sa structure tridimensionnelle complexe et de la variété des différents groupes chimiques qui la composent. Pour simplifier, on peut donc la considérer comme une mallette de différents groupes fonctionnels qui remplissent pratiquement différentes fonctions de manière isolée (bien que parfois la structure soit impliquée, par exemple lorsqu’elle interagit avec une enzyme et un autre substrat). Par exemple, seul le triphosphate est impliqué dans la libération d’énergie pour la polymérisation, tandis que seule la base guanine est impliquée dans sa désamination. Il est important de noter que la liste donnée au début n’exhuaste pas ses interactions chimiques mais est simplement une démonstration de ses différentes capacités.
Dans le GTP, le sucre ribose est central dans l’arrangement tridimensionnel des molécules de guanine et de triphosphate liées de manière covalente. Ce monosaccharide fournit des groupes hydroxyles pour les réactions de condensation et les attaques nucléophiles, ces dernières étant importantes pour la destruction des molécules d’ARN et donc la régulation de l’expression des gènes. La molécule de guanine et le triphosphate forment des liaisons covalentes aux atomes C’1 et C’5 respectivement, mais il leur est également possible d’utiliser d’autres groupes hydroxyle tant que la structure résultante ne provoque pas de collision. Du point de vue de la purine, elle est liée à la suite d’une réaction de condensation à son atome 9’N, qui était auparavant lié de manière covalente à un atome d’hydrogène. Comme la guanine est une base purique, elle est classée comme un triphosphate purique avec l’adénine triphosphate (ATP) et se forme par modification de l’inosine monophosphate.
Contenu
- 1 Idée fausse : GTP, un élément de base
- 2 Un des nombreux prédécesseurs de bases d’ARN
- 3 GTP ; un cousin de l’ATP universel
- 4 Une ressource pour la signalisation
- 5 Références
Idée fausse : Le GTP, un élément de base
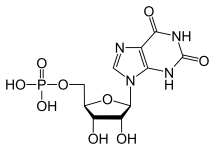
Le foie est le principal organe qui synthétise les nucléotides puriques et pyramidiques. Les nucléotides puriques (GTP et ATP) sont synthétisés en créant d’abord de l’inosine monophosphate à partir d’ATP, de glutamine, de glycine, de CO2, d’aspartate et de formate. L’IMP
peut ensuite être modifié pour donner l’une ou l’autre des molécules.
Dans le cas de la formation du GTP, l’IMP est d’abord converti en XMP par l’IMP déshydrogénase. La modification chimique et structurelle qui en résulte permet l’action de la GTP synthase qui convertit rapidement le XMP en GMP. Cependant, le GMP n’est pas une molécule à haute énergie car il ne possède pas de triphosphate, il est donc ensuite phosphorylé par les nucléoside phosphate kinases pour donner d’abord un diphosphate et éventuellement un triphosphate.
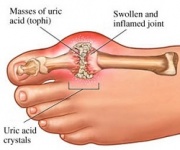
Le GTP est normalement catabolisé en acide urique insoluble qui peut ensuite apparaître dans l’urine sous forme de cristaux d’urate de sodium. Ce processus est considéré comme anormal s’il a lieu dans les articulations synoviales, donnant lieu à de l’acide urique qui est ensuite transformé en urate monosodique ou en pyrophosphate de calcium dihydraté nocif. La présence de ces substances chimiques permet le développement d’une inflammation et d’une arthrite et les symptômes combinés conduisent à la classification de la maladie en goutte. Un autre exemple de l’importance d’un catabolisme approprié des nucléotides puriques est la maladie d’immunodéficience combinée sévère qui entraîne la destruction des lymphocytes B et T essentiels
Un des nombreux prédécesseurs des bases de l’ARN
Il existe plusieurs différences entre l’ARN et l’ADN, mais la principale distinction réside dans la structure des nucléobases qui construisent chaque polymère. Les nucléobases de l’ARN contiennent un groupe 2’OH sur leur sucre ribose, ce qui leur permet d’être beaucoup plus réactives chimiquement, catalytiques et instables. Il est important de noter que le triphosphate de guanosine ne concerne que la production de la base guanine dans l’ARN. L’analogue du GTP pour la formation d’une base guanine dans l’ADN est le désoxyguanosine triphosphate. Ce triphosphate contient un sucre désoxyribose sans
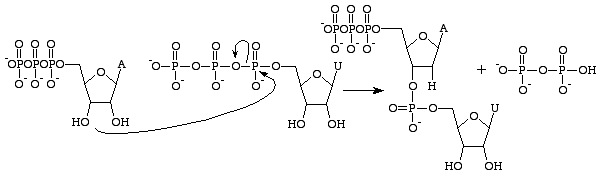
2’OH groupe qui le rend nettement plus stable – empêchant les attaques nucléophiles qui couperaient les liaisons phosphodiester entre les nucléobases. C’est idéal car l’ARN doit être désintégré après avoir été traduit en protéine alors que l’ADN doit rester intact pour le passage de l’information génétique sur la cellule fille.
La guanosine triphosphate va entraîner la formation d’une base guanine suite au clivage d’une liaison anhydride et à la libération des phosphates alpha et gamma sous forme de phosphates libres. La GMP va ensuite former une liaison phosphodiester avec la base voisine contenant un groupe 3’OH, et fournir un groupe 3’OH pour la base suivante de l’ARN. Cette réaction ne se produit que si la base opposée à la GMP est la cytosine avec laquelle elle peut former des liaisons hydrogène et sa vitesse est augmentée par l’ARN polymérase. L’ARN polymérase n’aligne pas les triphosphates. Elle catalyse simplement la réaction qui se produit après que cela ait été fait de manière indépendante. Après la catalyse, la molécule fait partie d’une chaîne polynucléotidique et n’est plus connue sous le nom de GTP, mais sous celui de la base guanine.
GTP ; un cousin de l’ATP universel
Le mécanisme sous-jacent de rendement énergétique à partir de la coupure de la liaison anhydride est le même dans tous les triphosphates. Le statut d’énergie élevée des triphosphates est obtenu par trois mécanismes distincts. Le premier est dû aux forces répulsives
sur chacun des groupes phosphates. Cela contribue à une grande instabilité des triphosphates liés et à un fort « désir » d’atteindre un statut énergétique inférieur. La seconde est due à la stabilisation par résonance. Lorsque le GTP est
converti en GDP, la quantité de positions possibles pour les paires d’électrons existantes augmente, prêtant à une plus grande stabilité. Cet argument est également confirmé par la conversion du PIB en GMP. Le troisième est dû à l’effet entropique défavorable qu’une quantité accrue de phosphates a sur la conformation des molécules d’eau qui entourent la molécule.
La concentration de GTP dans le cytoplasme étant nettement inférieure à celle de l’ATP, il est utilisé pour des fonctions spécifiques dans les processus métaboliques cellulaires.
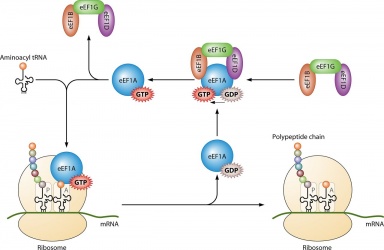
Son utilisation principale est dans la synthèse des protéines lorsqu’il est couplé avec IF2 pendant l’initiation ribosomale, Ef-Tu et Ef-G pendant l’élongation et ;RF3 pendant la terminaison. Toutes les molécules de GTP qui se lient avec les protéines indiquées deviennent déphosphorylées, ce qui donne du PIB et un phosphate libre
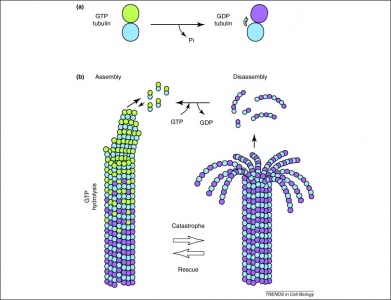
En outre, le GTP est également utilisé par les dimères de tubuline dans leur formation des microtubules. Les dimères de tubuline sont composés d’une tubuline alpha et d’une tubuline bêta, chacune d’entre elles possédant des sites de liaison au GTP. Comme la tubuline bêta se trouve à l’extrémité positive du filament, le GTP est toujours hydrolysé à cet endroit lorsqu’un autre dimère est ajouté au polymère qui s’allonge. Il est important de noter que l’hydrolyse du GTP affaiblit les interactions non covalentes entre les dimères de tubuline, ce qui facilite la dissolution des microtubules si nécessaire. Notez que la protéine GTP de la tubuline alpha n’est pas déphosphorylée donc on peut considérer qu’elle est cohérente à travers la structure des microtubules.
Une ressource pour la signalisation
L’utilisation de la chimie spécifique et de la conformation spatiale du GTP est efficacement démontrée par son utilisation dans la transmission de signaux. Principalement, il est capable de se lier et de réguler l’activité de différentes protéines de la voie de signalisation qui sont classées en deux groupes différents. Le premier est celui des protéines hétérotrimériques de liaison au GTP (également connues sous le nom de protéines G hétérotrimériques) qui utilisent le GTP lors de l’activation des récepteurs couplés aux protéines G afin de modifier l’activité d’autres protéines de la voie de signalisation. Les secondes sont des protéines monomères de liaison au GTP (également appelées protéines G monomères). Celles-ci répondent à des récepteurs autres que les récepteurs couplés à la protéine G. Un exemple typique cité au cours de leur explication est la protéine Ras. Notez qu’elles sont capables de lier sélectivement le GTP b non seulement grâce à sa chimie spécifique mais aussi grâce au phénomène d’ajustement induit. Le GTP lié sera ensuite hydrolysé après un certain temps, ce qui entraînera une auto-inactivation de la protéine et empêchera une stimulation excessive d’une voie de signalisation. Après l’hydrolyse du GTP, le PIB restera lié puisque le changement de conformation entraînera un déplacement de l’affinité entre la molécule de GTP et la molécule de PIB. Cependant, il s’agit d’un changement impernament et il peut être inversé par une activation ultérieure par le récepteur couplé à la protéine G.
Le GTP peut également être utilisé comme réactif pour produire du GMPc qui est une molécule de signalisation secondaire relativement courante. La catalyse est déclenchée par la libération de NO qui active la guanylate cyclase, une enzyme qui produit le GMPc sous forme de GTP. Le GMPc peut alors agir comme effecteur vers les protéines kinases qui phosphorylent et modifient l’action de protéines spécifiques.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell et P A Weil. Harper’s Illustrated Biochimie. 28e édition. Beijing, Chine. 2009.
- J Dow, G Lindsay et J Morrison, Biochemistry : Molécules, cellules et le corps. 1ère édition. Wokingham, Angleterre. Addison-Wesley. 1996.
- J Dow, G Lindsay et J Morrison, Biochimie : Les molécules, les cellules et le corps. 1ère édition. Wokingham, Angleterre. Addison-Wesley. 1996.
- J Dow, G Lindsay et J Morrison, Biochimie : Les molécules, les cellules et le corps. 1ère édition. Wokingham, Angleterre. Addison-Wesley. 1996.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- M W King. La page de la biochimie médicale. Septembre 2016. Cité : 11:31. 03.12.2016. Disponible à partir de : http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell et P A Weil. Harper’s Illustrated Biochimie. 28ème édition. Beijing, Chine. 2009.
- M W King. La page de la biochimie médicale. Septembre 2016. Cité : 11:31. 03.12.2016. Disponible à partir de : http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La page de biochimie médicale. Septembre 2016. Cité : 11:31. 03.12.2016. Disponible à partir de : http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La page de biochimie médicale. Septembre 2016. Cité : 11:31. 03.12.2016. Disponible à partir de : http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. La page de biochimie médicale. Septembre 2016. Cité : 11:31. 03.12.2016. Disponible à partir de : http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay et J Morrison, Biochimie : Molécules, cellules et le corps. 1ère édition. Wokingham, Angleterre. Addison-Wesley. 1996.
- J Dow, G Lindsay et J Morrison, Biochimie : Les molécules, les cellules et le corps. 1ère édition. Wokingham, Angleterre. Addison-Wesley. 1996.
- J Dow, G Lindsay et J Morrison, Biochimie : Les molécules, les cellules et le corps. 1ère édition. Wokingham, Angleterre. Addison-Wesley. 1996.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto et R Stryer. Biochemistry. Huitième édition. Ville et pays non identifiés. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto et R Stryer. Biochemistry. Huitième édition. Ville et pays non identifiés. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto et R Stryer. Biochemistry. Huitième édition. Ville et pays non identifiés. Freeman and Co. 2015.
- T E Dever et R Green. Les phases d’élongation, de terminaison et de recyclage chez les eucaryotes. CSHPB. Juillet 2012. 4:7:1-16
- B Alberts et al. Biologie moléculaire de la cellule. 6ème édition. New York, USA. Garland Science. 2015.
- B Alberts. Biologie moléculaire de la cellule. 6th Edition. New York, USA. Garland Science. 2015.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
- J Koolman et KH Roehm, Color Atlas of Biochemistry, 3e édition, Stuttgart, Allemagne. Thieme 2013.
.