- Introduction : Clinique de la migraine
- Pathophysiologie de la migraine et peptide lié au gène de la calcitonine (CGRP)
- Interventions pharmacologiques sur la voie du CGRP
- Relation pharmacocinétique (PK)/Pharmacodynamique (PD) des AcM antimigraineux
- Conclusion
- Contributions des auteurs
- Déclaration de conflit d’intérêts
Introduction : Clinique de la migraine
La migraine consiste en une céphalée unilatérale accompagnée d’un ensemble d’autres symptômes sensoriels, autonomes et cognitifs et elle a été identifiée par l’étude Global burden of disease (GBD) 2016 comme le sixième trouble le plus répandu et l’une des principales causes d’invalidité dans le monde entier, survenant souvent en âge de travailler et chez les jeunes adultes et les femmes d’âge moyen (Collaborateurs, 2018). Par conséquent, la migraine représente un problème social très grave en termes d’années de vie vécues avec une incapacité (AVI) et la cause la plus importante d’AVI dans la tranche d’âge de 15 à 49 ans (voir Steiner et al., 2018). Le fardeau de cette maladie n’a pas été identifié jusqu’à récemment car : la migraine n’est pas une cause d’invalidité permanente ou de décès ; les céphalées surviennent occasionnellement dans la population générale (Collaborateurs, 2018). Bien que l’on ne connaisse pas une pathogénie précise de la migraine, la circulation extracrânienne est impliquée (Drummond et Lance, 1983). L’évolution clinique de la migraine s’articule en différentes étapes suivantes ou concomitantes : prémonitoire, aura, céphalée et postdrome (similaire à la phase prémonitoire) (Goadsby et al., 2017a). La phase prémonitoire comprend l’irritabilité, l’envie de manger, la raideur de la nuque et peut survenir de 2 à 72 h avant l’attaque et se poursuit sur les autres phases. Selon les définitions de la classification internationale des troubles de la tête, troisième édition (ICHD-3) :
– l’aura est caractérisée par un ou plusieurs déficits neurologiques transitoires et réversibles, dont au moins un doit avoir une localisation unilatérale, qui se développent sur 5 min ou plus et dont chaque déficit dure entre 5 et 60 min;
– la migraine consiste en des crises de céphalées qui durent de 4 à 72 h accompagnées de nausées, de photophobie et de phonophobie, ou des deux (voir Goadsby et al., 2017a).
L’allodynie cutanée, définie comme la perception de la douleur suite à des stimuli non douloureux, se produit chez plus du 70% des patients (Lambru et al., 2018). Les céphalées sévères s’atténuent ou s’arrêtent pendant la phase postdrome, tandis que d’autres symptômes tels que l’asthénie, la somnolence et la photophobie continuent d’affecter le patient, montrant ainsi la base neuronale complexe qui sous-tend la migraine (Lambru et al., 2018). En fonction des jours par mois affectés, la migraine est classée comme épisodique (moins de 15 jours de migraine ou de céphalée) ou chronique (au moins 15 jours, dont 8 ou plus sont des jours de migraine) (voir Goadsby et al., 2017b). Cet aspect influence remarquablement l’impact de la maladie et les options thérapeutiques (Giamberardino et al., 2017). Avec 1 à 3 crises par mois, il est possible d’utiliser uniquement des médicaments symptomatiques abortifs, tandis que si 4 à 14 crises par mois se produisent, il est obligatoire d’ajouter des traitements préventifs ; ces derniers traitements sont nécessaires pour éviter la chronification de la maladie (Giamberardino et Martelletti, 2015 ; Giamberardino et al, 2017) et pour réduire le risque de céphalées de surconsommation de médicaments et de migraine réfractaire (Martelletti, 2017).
Pathophysiologie de la migraine et peptide lié au gène de la calcitonine (CGRP)
La cause exacte des crises de migraine n’est pas encore bien connue, mais les recherches actuelles mettent en évidence l’importance des processus de sensibilisation au sein du système trigéminovasculaire et de l’ensemble du tronc cérébral, ainsi que l’observation d’une réduction de la matière grise dans les zones de traitement de la douleur (voir Goadsby et al, 2017a). À partir du ganglion trigéminal contenant le corps cellulaire, des afférences primaires pseudo-unipolaires font synapse sur les vaisseaux sanguins et sur le complexe trigéminocervical à partir duquel des fibres de deuxième ordre font synapse sur des neurones thalamocorticaux de troisième ordre et sur le locus coeruleus, le gris périaqueducal et l’hypothalamus (Goadsby et al., 2017a). Les fibres nociceptives du ganglion trigéminal et des ganglions de la racine dorsale cervicale innervent les vaisseaux de la dure-mère et leurs terminaisons libèrent des neuropeptides vasoactifs tels que le calcitonin gene-related peptide (CGRP) induisant une vasodilatation. L’expression du CGRP, du CLR et du RAMP1 dans les vaisseaux de la dure-mère humaine est illustrée dans les figures 1A-C. En effet, les fibres nerveuses autonomes innervant les vaisseaux extracérébraux contiennent plusieurs molécules vasoactives neurotransmetteurs : noradrénaline, sérotonine, acétylcholine, neuropeptide Y (NPY), polypeptide intestinal vasoactif (VIP), substance P (SP), neurokinine A (NU), et CGRP (Goadsby et al., 1990). Les antagonistes des récepteurs du CGRP agissent en bloquant les informations nociceptives provenant de la dure-mère : elles sont traitées dans les noyaux thalamiques d’où elles atteignent les régions corticales supérieures. Ces entrées du système trigémino-vasculaire sont soumises à une modulation par la voie descendante du tronc cérébral : on pense que les agonistes des récepteurs 5-hydroxytryptamine (5HT)1B/1D, c’est-à-dire les triptans, agissent via ce système et contrecarrent la vasodilatation qui se produit. Alors que le propranolol et le topiramate sont utilisés comme traitement préventif, ces derniers médicaments sont utilisés dans les épisodes aigus de migraine. En particulier, outre leur activité vasoconstrictrice, les triptans qui agissent directement sur les récepteurs présynaptiques 5HT1B/D inhibent la libération de médiateurs comme le CGRP, impliqués dans la nociception. En outre, il a été démontré expérimentalement que le sumatriptan inhibe le courant entrant médié par le récepteur potentiel transitoire vanilloïde 1 (TRPV1) dans les ganglions du trijumeau (Evans et al., 2012). Le CGRP est libéré pendant les crises de migraine et joue plusieurs rôles en tant que neuropeptide le plus vasoactif dont les niveaux craniovasculaires augmentent au cours de la maladie (Goadsby et al., 1990). Il a été démontré que le CGRP subit également des altérations dans le liquide céphalo-rachidien (van Dongen et al., 2017). Les éléments déclencheurs de l’altération de l’excitabilité centrale et de la percée consécutive des épisodes douloureux migraineux sont étudiés depuis longtemps. La stimulation des fibres nerveuses peut favoriser les potentiels d’action orthodromiques et antidromiques et, en particulier, l’activation des afférences sensorielles primaires peptidergiques durales qui expriment le potentiel récepteur transitoire (TRP) peut induire la libération de plusieurs molécules, dont le CGRP, qui déclenchent des réactions tissulaires inflammatoires connues sous le nom d’inflammation neurogène (Xanthos et Sandkuhler, 2014). En particulier, le CGRP est impliqué dans la nociception crânienne et dans l’épiphénomène de vasodilatation liant ses récepteurs sur les vaisseaux sanguins méningés et cérébraux (Deen et al., 2017). Ces processus favorisent la sensibilisation des fibres de second ordre du trijumeau qui transmettent les stimuli douloureux amplifiés à des régions plus élevées comme le thalamus, l’hypothalamus et le cortex, d’où la migraine (Dussor et al., 2014). Les TRP sont soumis à une activation en réponse à plusieurs stimuli environnementaux irritants comme les variations de température et de pH qui, chez les individus prédisposés, peuvent déclencher la douleur migraineuse. Le CGRP est produit par un épissage alternatif spécifique au tissu du gène de la calcitonine CALC I sur le chromosome 11, codant également pour la calcitonine. Au contraire, le β CGRP est produit à partir du gène CALC II situé sur un site différent du chromosome 11. Le neuropeptide α CGRP est présent dans le système nerveux central sous forme d’isoforme α de 37 acides aminés et la transduction de son signal est médiée par deux récepteurs.
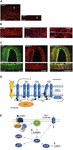
Figure 1. Expression et voie du CGRP dans la migraine. Expression du CGRP, du CLR et du RAMP1 dans les vaisseaux de la dure-mère humaine : (A) L’immunoréactivité du CGRP se trouve dans les fibres fines de l’adventice ; (B) sections transversales et longitudinales montrant l’expression de RAMP1 dans le cytoplasme des cellules musculaires lisses ; (C) coexpression de CLR et RAMP1 dans la couche de cellules musculaires lisses. (D) Composants du récepteur du CGRP et résidus importants pour la signalisation et l’internalisation du récepteur. Le récepteur du CGRP est formé par CLR (bleu), RAMP1 (jaune) et RCP (orange). Les résidus importants sur le plan fonctionnel sont représentés par des abréviations d’une seule lettre. Les résidus d’acides aminés sont numérotés à partir du début du peptide signal N-terminal prédit (Swiss-Prot Q16602). Plusieurs acides aminés dans l’extrémité C-terminale du CLR (∼N400-C436) et I312 à la jonction ICL3/TM5 sont nécessaires pour une internalisation efficace médiée par le CGRP. Les caractéristiques importantes du récepteur du CGRP, notamment le » coude » TM6 (P343) et la huitième hélice putative (∼G388-W399) dans le CLR sont illustrées. C′, C-terminal ; ECL, boucle extracellulaire ; ICL, boucle intracellulaire ; N′, N-terminal ; TM, transmembrane. (E) Signalisation intracellulaire médiée par le récepteur du CGRP : La signalisation Gαs augmente l’activité de l’AC (vert), élevant l’AMPc intracellulaire, activant la PKA et par la suite de nombreux effecteurs potentiels en aval. Les panneaux (A-C) sont adaptés d’Eftekhari et al. (2013) et le panneau (D,E) de Walker et al. (2010), respectivement, avec permission.
Le premier est connu sous le nom de récepteur canonique du CGRP et est un récepteur couplé à la protéine Gαs qui nécessite la protéine modificatrice d’activité du récepteur (RAMP) 1 pour être fonctionnel (Goadsby et al., 2017a). Le second est le récepteur humain de sous-type 1 de l’amyline (AMY1) : l’amyline appartient à la famille des gènes de la calcitonine et elle a une activité hormonale. Lorsque le CGRP se lie à son récepteur, il est soumis à une internalisation dépendante de la dynamine/clathrine après avoir été complexé avec la β-arrestine (voir Walker et al., 2010). Des changements conformationnels se produisent induisant l’activation de l’adénylate cyclase (AC), l’augmentation de l’AMPc et l’activation de la protéine kinase A (PKA) qui peut favoriser la vasodilatation par l’activation directe de l’oxyde nitrique synthase endothéliale et des réponses douloureuses. Ce dernier récepteur peut être couplé à Gαq/11 avec l’activation de la phospholipase C (PLC), à la protéine kinase activée par des agents mitogènes (MAPK) et à la libération de NO (voir Walker et al., 2010) (voir les figures 1D,E pour une représentation schématique de la signalisation intracellulaire médiée par le récepteur du CGRP). L’administration de CGRP aux migraineux déclenche des crises et cette preuve soutient son rôle central dans la pathogenèse de la migraine (Lassen et al., 2002). Un système de terminaison du signal n’a pas encore été identifié : Le CGRP est métabolisé par la néprilysine, l’enzyme dégradant l’insuline et l’enzyme-1 de conversion de l’endothéline et un système de transport actif de recapture a été supposé (voir Russell et al., 2014). De plus, lorsque le récepteur est activé transitoirement par le CGRP, il est internalisé dans les endosomes et recyclé rapidement vers la membrane cellulaire, tandis que la stimulation chronique du récepteur induit une désensibilisation et une dégradation lysosomale (voir Russell et al, 2014).
Interventions pharmacologiques sur la voie du CGRP
La migraine est un trouble neurovasculaire invalidant à multiples facettes et le traitement actuel par triptans oraux est efficace dans les crises aiguës, bien qu’environ 40% des patients soient résistants au traitement (Ferrari et al., 2001 ; Edvinsson, 2015). Ces agonistes sélectifs des récepteurs 5-HT1B/1D, dont le plus utilisé est le sumatriptan principalement actif par voie sous-cutanée, exercent leur action thérapeutique par le biais de la vasoconstriction des vaisseaux crâniens et de l’inhibition du système trigéminal et trigéminocervical (voir Ferrari et al., 2001). Cependant, la vasoconstriction représente une limite pour les effets secondaires cardiovasculaires de ces médicaments. En outre, le traitement par triptans ne peut durer plus de 9 jours par mois en raison du risque de céphalées médicamenteuses. En 2010, la toxine botulique de type A (BoNT-A) a été approuvée par la Food and Drug Administration (FDA) dans la prévention de la migraine chez les migraineux chroniques non réactifs. Son administration complexe (elle nécessite une injection dans 31 sites) limite l’observance du traitement par les patients. En raison du rôle central joué par le CGRP dans la physiopathologie de la migraine, des antagonistes de son récepteur ont été développés. Ces médicaments appartiennent à la classe des gépants. Telgecepant, le premier gépant oral, a été bien toléré par les migraineux atteints d’une maladie coronarienne (ClinicalTrials.gov NCT00662818, Ho et al., 2012), mais il présentait une hépatotoxicité. Ainsi, malgré des recherches continues sur ces petites molécules, une nouvelle approche consistant à développer des anticorps monoclonaux (mAbs) dirigés contre le CGRP (nezumabs) ou le récepteur du CGRP (numabs) a été proposée. Ces médicaments sont censés inhiber l’action des molécules de CGRP circulantes pour prévenir les crises de migraine et, comme ils ne traversent pas la barrière hémato-encéphalique (BHE) en raison de leur taille, les sites d’action devraient se situer dans le système trigéminal (Edvinsson, 2015). En particulier, les vaisseaux duraux ne sont pas inclus dans la BHE. De plus, le CGRP ne traverse probablement pas la BHE et agit comme un modulateur paracrine puisqu’il est exprimé par la moitié des neurones du ganglion trigéminal qui ne présentent pas le récepteur du CGRP, exprimé par les cellules gliales satellites et les 30 % du soma neuronal du ganglion trigéminal (voir Yuan et al., 2017). Actuellement, quatre mAbs, l’eptinezumab, le fremanezumab, le galcanezumab et l’erenumab sont étudiés dans le cadre d’essais cliniques pour la migraine épisodique et chronique. Les trois premiers AcM sont des anticorps humanisés dirigés contre le CGRP, tandis que l’erenumab est un anticorps humain dirigé contre son récepteur canonique. La demi-vie de ces médicaments est assez longue, ce qui ne permet pas plus d’une administration par mois, ce qui est intéressant puisque les AcM doivent être administrés par voie intraveineuse ou sous-cutanée. En particulier, l’eptinezumab uniquement est administré par voie intraveineuse (Israël et al., 2018). L’essai de phase III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) a évalué l’efficacité de l’eptinezumab sur la prévention de la migraine épisodique fréquente. Les résultats ont montré une réduction significative du critère d’évaluation primaire consistant en une diminution des jours de migraine mensuels (JMM) par rapport à la ligne de base moyenne de 8,5 jours sur les semaines 1-12 à 4,3 JMM avec la dose de 300 mg, 3,9 avec 100 mg, et 4,0 avec 30 mg par rapport à 3,2 jours de placebo (Saper et al., 2018). Pour l’évaluation de l’eptinezumab dans la prévention de la migraine chronique, 1121 participants ont été recrutés dans l’étude PROMISE 2 (ClinicalTrials.gov NCT02974153). L’efficacité du galcanezumab dans la prévention de la migraine épisodique a été évaluée dans l’étude EVOLVE-1 de phase 3 en double aveugle, randomisée, contrôlée contre placebo (ClinicalTrials.gov NCT02614183) disséquée en 4 périodes et dans l’essai clinique EVOLVE-2 de phase 3 en double aveugle, randomisé et contrôlé de 6 mois (ClinicalTrials.gov NCT02614196). Dans l’EVOLVE-1, les deux doses de galcanezumab (120 et 240 mg) ont atteint l’objectif primaire de réduction significative des jours de migraine mensuels de 4,7 jours et 4,6 jours, respectivement, par rapport aux 2,8 jours du placebo (Stauffer et al., 2018). Dans l’étude EVOLVE-2, les patients ont reçu une injection mensuelle de 120 ou 240 mg de galcanezumab. Les jours moyens de migraine mensuels ont été réduits de 4,3 et 4,2 jours, respectivement, par rapport à la réduction de 2,3 jours obtenue avec le placebo (p < 0,001) (Skljarevski et al., 2018). Les critères secondaires de réduction de la déficience fonctionnelle évaluée par le score du domaine Role Function-Restrictive (R-FR) du questionnaire de qualité de vie spécifique à la migraine (MSQ) et l’amélioration du score de l’impression globale de gravité du patient (PGI-S) et de l’évaluation de l’invalidité liée à la migraine (MIDAS ; point de temps = mois 6) ont également été respectés (Skljarevski et al., 2018). 147 (65,0 %) et 163 (71,5 %) des patients traités par galcanezumab, 120 et 240 mg, respectivement, et 287 (62,3 %) par placebo ont présenté des événements indésirables, parmi lesquels un infarctus aigu du myocarde et un accident ischémique transitoire au sein d’un groupe de sept patients sous traitement par galcanezumab 240 mg (Skljarevski et al., 2018). Il n’y avait pas de différences statistiquement significatives dans le changement moyen par rapport à la ligne de base pour la pression artérielle systolique/diastolique. Les 19 (8,6 %), 11 (5,1 %) et 2 (0,5 %) patients des groupes galcanezumab 120 mg, galcanezumab 240 mg et placebo, respectivement, ont présenté des anticorps anti-médicaments (ADA) apparus pendant le traitement. Dans l’essai de phase III REGAIN évaluant le galcanezumab contre la migraine chronique, les MMD ont été réduits de 4,8 jours avec la dose de 120 mg et de 4,6 jours avec la dose de 240 mg, contre 2,7 pour le placebo (voir Yuan et al., 2017). En outre, il a été démontré que le traitement par galcanezumab était doté d’une persistance statistiquement significative de l’effet (Forderreuther et al., 2018). Le galcanezumab a été étudié dans l’essai de phase III HALO pour le traitement préventif de la migraine (ClinicalTrials.gov NCT02638103). Il a réduit les MMD de la migraine épisodique à 12 semaines de 3,7 jours à 225 mg par mois pendant 3 mois et de 3,4 jours à 675 mg une fois par trimestre par rapport à la diminution de 2,2 jours du placebo (voir Yuan et al., 2017). L’efficacité de l’erenumab dans la prévention des migraines épisodiques a été étudiée dans l’étude de phase 3, randomisée, en double aveugle, contrôlée par placebo, ARISE (ClinicalTrials.gov NCT02483585). Les MMD ont été réduites par 70 mg d’erenumab mensuel sous-cutané de 2,9 jours par rapport à 1,8 jour de placebo (p < 0,001) et il a été efficace dans les critères secondaires de réduction d’au moins 50 % des MMD et de changement des jours de traitement médicamenteux mensuel spécifique à la migraine (MSMD) (Dodick et al., 2018). La proportion de patients présentant des effets indésirables était similaire entre le groupe traité par l’AcM et celui traité par le placebo ; 4,3 % ont été testés positifs pour des anticorps se liant à l’érénumab jusqu’à la semaine 12, dont un transitoirement positif pour des anticorps neutralisants mais seulement à la semaine 4 (Dodick et al., 2018). Par ailleurs, l’essai clinique de phase III STRIVE (ClinicalTrials.gov NCT02456740) a évalué l’efficacité de l’erenumab dans la prévention de la migraine épisodique. L’erenumab a été administré à raison de 70 ou 140 mg par mois pendant 6 mois (Goadsby et al., 2017b). Le nombre moyen de MMD au départ était de 8,3 et les doses de 70 mg et 140 mg l’ont réduit de 3,2 et 3,7, respectivement, contre 1,8 jour sous placebo (avec p < 0,001 pour chaque dose par rapport au placebo) (Goadsby et al., 2017b). De même, au cours des 3 derniers mois de traitement, chaque dose d’erenumab a rempli les critères secondaires d’une réduction d’au moins 50 % par rapport au début de l’étude du nombre moyen de jours de migraine par mois et d’une réduction par rapport au début de l’étude des activités quotidiennes (MPFID-EA) et de la détérioration physique (MPFID-PI) du Migraine Physical Function Impact Diary (MPFID) (Goadsby et al., 2017b). Chez les patients présentant des anticorps anti-érénumab, un seul dans le groupe traité avec 70 mg a été testé positif pour les anticorps neutralisants et l’AcM a été globalement bien toléré en termes de taux de créatinine, de toxicité hépatique, de nombre de neutrophiles totaux et de fonction électrocardiographique (Goadsby et al., 2017b). Selon les auteurs, l’une des limites de cet essai est que les patients qui n’avaient pas montré de réponse thérapeutique à plus de deux classes de médicaments prévenant la migraine ont été exclus (Goadsby et al., 2017b). Par ailleurs, des essais cliniques étudient l’efficacité du fremanezumab (NCT02945046 et NCT02964338) et du galcanezumab (NCT 02397473 et NCT02438826) dans la prévention de la céphalée en grappe (voir Israël et al., 2018), c’est-à-dire une céphalée primaire caractérisée par une douleur unilatérale sévère dans la zone périorbitaire accompagnée de larmoiement, de rougeur conjonctivale et de rhinorrhée (Vollesen et al., 2018). En effet, il a été démontré que la perfusion intraveineuse continue, par l’intermédiaire d’une pompe à perfusion, de 1,5 μg/min de CGRP pendant 20 min (en 2 jours séparés d’au moins 7 jours) à des patients souffrant d’une céphalée en grappe épisodique (phase active ou de rémission) ou chronique a suscité des crises de type cluster chez les patients en phase active ou souffrant d’une céphalée en grappe chronique, mais pas en phase de rémission (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). Les principaux avantages pharmacocinétiques des mAbs sont représentés par une longue demi-vie d’élimination limitant ainsi la nécessité d’une prise quotidienne et une clairance par protéolyse. En raison des effets des gépants sur le foie et en raison des propriétés vasodilatatrices du CGRP, les risques les plus redoutés de l’inhibition de la signalisation du CGRP consistent en une hépatotoxicité hypothétique et un risque théorique cardiovasculaire (Yuan et al., 2017). La Fédération européenne des céphalées (EHF) a produit des lignes directrices sur l’utilisation des AcM anti-CGRP en appliquant la méthode GRADE (Grading of Recommendation, Assessment, Development and Evaluation) et, lorsque cela n’est pas possible, en s’appuyant sur l’avis d’un panel d’experts (Sacco et al., 2019).
Relation pharmacocinétique (PK)/Pharmacodynamique (PD) des AcM antimigraineux
Le développement des AcM a représenté une approche complètement nouvelle pour inhiber la voie du CGRP. La principale amélioration PD obtenue en utilisant les mAbs au lieu des petites molécules est qu’il est plus facile de cibler le large site de liaison récepteur-ligand du CGRP (Taylor, 2018). Les principaux avantages pharmacocinétiques des AcM sont représentés par une longue demi-vie d’élimination sans nécessité de dosage quotidien et une clairance par protéolyse et les risques les plus redoutés de l’inhibition de la signalisation du CGRP consistent en une hépato-toxicité hypothétique, due aux effets des gépants sur le foie, et un risque théorique cardiovasculaire, en raison des propriétés vasodilatatrices du CGRP. Cependant, après le parcours de ces AcM depuis leur production jusqu’à leur cible, le premier obstacle que rencontrent ces molécules est leur administration en raison de leur faible biodisponibilité orale. Par conséquent, une voie d’administration parentérale est nécessaire et, afin de favoriser l’adhésion au traitement, la demi-vie doit être longue (Taylor, 2018). Les immunoglobulines (Ig)G1, 2, ou 4 sont les possibilités (Wang et al., 2008 ; Taylor, 2018). Outre l’origine de l’IgG, une éventuelle réactivité croisée et des modifications individuelles du catabolisme peuvent affecter la demi-vie (Bonilla, 2008 ; Taylor, 2018). La technologie utilisée pour produire des AcM repose sur l’utilisation d’hybridomes composés de cellules en division continue qui produisent des clones déterminés d’un seul type d’anticorps, avec une variabilité nulle ou faible (Taylor, 2018). Sur la base de l’origine des acides aminés composant l’AcM, il est possible de distinguer les AcM chimériques (immunisation par des rongeurs ; maintien de la région Fab de liaison à l’antigène du fragment de rongeur, mais introduction de la région Fc cristallisable du fragment humain), humanisés (zumabs, avec des régions déterminant la complémentarité, CDR, de souris, greffées sur des régions Fab humaines) et humains (introduction de la séquence complète du gène de l’anticorps humain dans la souris qui devient humanisée, comme par exemple la XenoMouse) (voir Taylor, 2018). Les CDR influencent l’adaptation à la cible. Parmi les 4 AcM anti-migraineux, seul l’erenumab est humain, alors que les CDR greffés sont de souris pour le fremanezumab, de lapin pour l’eptinezumab et probablement de souris pour le galcanezumab (voir Taylor, 2018). En particulier, le seul AcM antirécepteur du CGRP est l’erenumab, qui est une IgG2λ humaine, et les trois autres AcM dirigés contre les sites du CGRP sont : l’eptinezumab, une IgG1k humanisée génétiquement modifiée ; le fremanezumab, une IgG2k humanisée ; le galcanezumab, une IgG4 humanisée (Edvinsson et al., 2018). L’érénumab (Tmax 3-14 jours) nécessite une administration sous-cutanée mensuelle, de même que le fremanezumab (Tmax 3-20 jours) et le galcanezumab (Tmax 7-14 jours) (Taylor, 2018). Au contraire, l’eptinezumab (Tmax 4,8 h) est administré par voie intraveineuse une fois tous les 3 mois ; il s’associe plus rapidement et se dissocie plus lentement que le fremanezumab et le galcanezumab. Les AcM étant des protéines de grande taille, ils ne peuvent pas traverser facilement la BHE. Certains récepteurs du CGRP se trouvent en dehors de la BHE, ce qui permet l’action des AcM anti-CGRP (Edvinsson, 2018). Avant de se lier, l’anticorps pénètre dans les cellules endothéliales vasculaires par pinocytose. Les grands volumes de distribution apparents pourraient dépendre du tissu et de la capacité de liaison de l’AcM (Lobo et al., 2004 ; Taylor, 2018). L’érénumab est l’approche la plus novatrice, car il est le seul à cibler une protéine de fusion des domaines extracellulaires du récepteur humain couplé à la protéine G, le récepteur analogue à la calcitonine CALCRL (requis dans les récepteurs du CGRP et de l’adrénomédulline) et du RAMP1, y compris la poche de liaison du CGRP (Edvinsson et al., 2018). Il a été démontré qu’il inhibe de manière compétitive la liaison du -CGRP au récepteur humain du CGRP dans les cellules de neuroblastome humain (SK-N-MC) avec un Ki de 0,02 ± 0,01 nM (Shi et al., 2016). L’érénumab a exercé un antagonisme puissant et complet de l’accumulation d’AMPc stimulée par le CGRP avec une CI50 de 2,3 ± 0,9 nM dans les essais fonctionnels réalisés dans les SK-N-MC (Shi et al., 2016). De plus, il a résulté 5000 fois plus sélectif pour le récepteur du CGRP ne montrant aucun effet agoniste/antagoniste sur les autres récepteurs humains de la famille de la calcitonine, y compris les récepteurs de l’adrénomédulline, de la calcitonine et de l’amyline jusqu’à la plus haute concentration testée de 10 μM (Shi et al., 2016). Le fremanezumab pourrait exercer son effet sur différents vaisseaux ; en effet, il provoque une inhibition dépendante de la concentration de la vasodilatation induite par le CGRP dans des artères cérébrales, méningées et abdominales périphériques humaines précontractées (Ohlsson et al., 2018). Par ailleurs, le CGRP peut également agir sur les neurones et les cellules gliales ainsi que sur le glymphatique (de type lymphatique), ce dernier étant impliqué dans l’expression de l’aura (voir Messlinger, 2018). L’absence probable de métabolisme par les enzymes hépatiques pourrait éviter les interactions médicamenteuses. L’élimination se fait par protéolyse rénale des acides aminés. Bien que les essais cliniques rapportent que ces anticorps sont globalement bien tolérés, hormis la douleur au point d’injection mise en évidence, leur immunogénicité par la production d’ADA suscite des inquiétudes (Taylor, 2018). Au cours d’un essai clinique en double aveugle, randomisé, contrôlé par placebo (ClinicalTrials.gov NCT 01337596) évaluant le traitement avec différents schémas de doses uniques et multiples de galcanezumab, 11 des patients traités (26%) ont présenté des titres faibles (1:10 – 1:80) d’ADA émergent du traitement (chez 3 patients, les anticorps préexistants ont augmenté en titre), sans réponse à la dose et sans effets détectés sur la PK et la PD (Monteith et al., 2017). L’étude de l’immunogénicité est essentielle car la présence d’ADA peut accélérer l’élimination du médicament ou, pire, favoriser les dommages aux organes terminaux (Taylor, 2018). Les principales caractéristiques des AcM anti-migraineux sont résumées dans le tableau 1.

Tableau 1. Principales caractéristiques du fremanezumab, de l’eptinezumab, du galcanezumab et de l’erenumab.
Conclusion
La migraine est une affection douloureuse neurovasculaire invalidante et débilitante représentant plus de 90% des cas de céphalées récurrentes et vers laquelle la tendance peut être héritée (MacGregor, 2017). Le divalproex sodique, le valproate de sodium, le topiramate, le métoprolol, le propranolol et le timolol ont fait l’objet de preuves solides, de niveau A, pour la prévention de la migraine (American Academy of Neurology et American Headache Society, 2015). Cependant, tous les traitements préventifs oraux classiques, y compris les antidépresseurs tricycliques, les bêtabloquants, les antagonistes des récepteurs 5-HT2, les ergots et les antiépileptiques, n’ont pas été développés pour la migraine et ne permettent de réduire de 50 % le nombre de jours mensuels de douleur migraineuse que pour 45 % des migraineux (D’Amico et Tepper, 2008). La persistance et l’abandon des médicaments ont été examinés dans une analyse rétrospective des demandes de remboursement aux États-Unis (Hepp et al., 2017) et les résultats suggèrent une faible persistance du médicament initial utilisé et un nombre élevé d’abandons avant 6 mois, indépendamment de la classe de médicaments. En raison du rôle fondamental du CGRP dans le maintien de la neuroinflammation et de la sensibilisation centrale dans la voie allant du ganglion trigéminal et du tronc cérébral aux régions supérieures impliquées dans la physiopathologie de la migraine, de nouveaux AcM dirigés contre le CGRP et son récepteur ont été développés. Les premières petites molécules antagonistes du CGRP ont montré qu’elles induisaient une toxicité hépatique, mais les mAbs n’ont produit ni métabolites toxiques ni réactions secondaires cardiovasculaires en raison de l’inhibition de la vasodilatation (voir Deen et al., 2017). Les effets secondaires centraux n’ont pas non plus été mis en évidence. Les effets potentiels à long terme du blocage du CGRP doivent encore être étudiés mais, un avantage fondamental de ces anticorps provient de leur longue demi-vie permettant des injections mensuelles ou moins fréquentes, ce qui peut améliorer remarquablement l’adhésion au traitement et son efficacité ultérieure (Deen et al., 2017). Ainsi, les mAbs anti-CGRP pourraient représenter des outils efficaces dans l’arsenal thérapeutique contre la migraine sans réponse ; cependant, une surveillance approfondie de l’efficacité et de la sécurité (c’est-à-dire la production de métabolites toxiques, l’immunogénicité avec ADA, les anticorps neutralisants et la réactivité croisée tissulaire et les effets secondaires) est obligatoire (Taylor, 2018). En fait, des preuves provenant de produits biotechnologiques plus anciens montrent que les thérapies avec des AcM anti-facteur de nécrose tumorale α (TNFα) peuvent être soumises à un échec secondaire (contrairement aux non-répondants primaires) de la réponse thérapeutique initiale car ces médicaments induisent la production d’anticorps qui peuvent dégrader l’AcM mais aussi neutraliser son action avant de se lier à la cible (voir Prado et al., 2017). L’immunogénicité peut être influencée par la glycosylation, le type de mAb, le nombre d’épitopes et les impuretés dans la formulation (voir Prado et al., 2017). En outre, plusieurs effets secondaires graves apparemment inexplicables sont associés à l’immunogénicité des anti-TNFα. Des réactions d’hypersensibilité locales et systémiques, une immunodéficience avec une sensibilité accrue aux infections et la formation de complexes immuns pouvant aller jusqu’au décès ont été mis en évidence (voir Prado et al., 2017). Par conséquent, l’utilisation de diagnostics thérapeutiques (théranostiques) peut améliorer la connaissance et la gestion correcte de ces dispositifs pharmacologiques (Bendtzen, 2013 ; Prado et al., 2017).
Contributions des auteurs
MTC, LAM, PT et GB ont conçu l’étude. DS a collecté les résultats de l’essai, analysé la littérature et rédigé le manuscrit. AA, LR, et MN ont participé à l’enquête bibliographique. Tous les auteurs ont lu et approuvé le manuscrit final.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
American Academy of Neurology et American Headache Society (2015). Annexe a : résumé de la directive fondée sur des preuves à l’intention des cliniciens, mise à jour : traitement pharmacologique pour la prévention de la migraine épisodique chez les adultes. Continuum 21, 1165-1166. doi : 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Médecine personnalisée : théranostics (diagnostics thérapeutiques) essentiels pour une utilisation rationnelle des antagonistes du facteur de nécrose tumorale-alpha. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Pharmacocinétique des immunoglobulines administrées par voie intraveineuse ou sous-cutanée. Immunol. Allergy Clin. North Am. 28, 803-819. doi : 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborateurs, G. B. D. H. (2018). Charge mondiale, régionale et nationale de la migraine et des céphalées de type tension, 1990-2016 : une analyse systématique pour l’étude sur la charge mondiale de morbidité 2016. Lancet Neurol. 17, 954-976. doi : 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., et Tepper, S. J. (2008). Prophylaxie de la migraine : principes généraux et acceptation par les patients. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Bloquer le CGRP chez les patients migraineux – un examen des avantages et des inconvénients. J. Headache Pain 18:96. doi : 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE : un essai randomisé de phase 3 sur l’erenumab pour la migraine épisodique. Cephalalgia 38, 1026-1037. doi : 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., et Lance, J. W. (1983). Les changements vasculaires extracrâniens et la source de la douleur dans la migraine. Ann. Neurol. 13, 32-37. doi : 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., et Porreca, F. (2014). Cibler les canaux TRP pour de nouvelles thérapies contre la migraine. ACS Chem. Neurosci. 5, 1085-1096. doi : 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). Antagonistes du récepteur du CGRP et anticorps contre le CGRP et son récepteur dans le traitement de la migraine. Br. J. Clin. Pharmacol. 80, 193-199. doi : 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). La voie CGRP dans la migraine comme une cible viable pour les thérapies. Headache 58(Suppl. 1), 33-47. doi : 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., et Krause, D. N. (2018). CGRP comme cible de nouveaux traitements contre la migraine – traduction réussie du banc à la clinique. Nat. Rev. Neurol. 14, 338-350. doi : 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., et Edvinsson, L. (2013). Différenciation des fibres nerveuses stockant le CGRP et les récepteurs du CGRP dans le système trigeminovasculaire périphérique. J. Pain 14, 1289-1303. doi : 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., et Premkumar, L. S. (2012). Le sumatriptan inhibe les canaux TRPV1 dans les neurones du trijumeau. Headache 52, 773-784. doi : 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., et Goadsby, P. J. (2001). Oral triptans (serotonin 5-HT(1B/1D) agonists) in acute migraine treatment : a meta-analysis of 53 trials. Lancet 358, 1668-1675. doi : 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., et Lainez, M. J. A. (2018). Les effets préventifs du galcanezumab chez les patients adultes atteints de migraine épisodique ou chronique sont persistants : données des études de phase 3, randomisées, en double aveugle, contrôlées par placebo EVOLVE-1, EVOLVE-2 et REGAIN. J. Headache Pain 19:121. doi : 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., et Martelletti, P. (2017). Le récepteur du peptide lié au gène de la calcitonine comme nouvelle cible pour la prise en charge des personnes souffrant de migraine épisodique : preuves actuelles et profil de sécurité de l’erenumab. J. Pain Res. 10, 2751-2760. doi : 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., et Martelletti, P. (2015). Médicaments émergents pour le traitement de la migraine. Opinions d’experts. Emerg. Drugs 20, 137-147. doi : 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., et Ekman, R. (1990). Libération de peptides vasoactifs dans la circulation extracérébrale de l’homme pendant la migraine. Ann. Neurol. 28, 183-187. doi : 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., et Akerman, S. (2017a). Physiopathologie de la migraine : un trouble du traitement sensoriel. Physiol. Rev. 97, 553-622. doi : 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Un essai contrôlé de l’erenumab pour la migraine épisodique. N. Engl. J. Med. 377, 2123-2132. doi : 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistance et modèles de changement de médicaments prophylactiques oraux contre la migraine chez les patients souffrant de migraine chronique : une analyse rétrospective des réclamations. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Étude randomisée et contrôlée du telcagepant chez les patients atteints de migraine et de maladie coronarienne. Headache 52, 224-235. doi : 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., et Reuter, U. (2018). Anticorps monoclonaux CGRP pour le traitement préventif de la migraine. Curr. Pain Headache Rep. 22:38. doi : 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., et Martelletti, P. (2018). Médicaments émergents pour le traitement de la migraine : une mise à jour. Opinions d’experts. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., et Olesen, J. (2002). CGRP may play a causative role in migraine. Cephalalgia 22, 54-61. doi : 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., et Balthasar, J. P. (2004). Pharmacocinétique et pharmacodynamique des anticorps. J. Pharm. Sci. 93, 2645-2668. doi : 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migraine. Ann. Intern. Med. 166, ITC49-ITC64. doi : 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). L’application des anticorps monoclonaux CGRP(r) dans le spectre de la migraine : besoins et priorités. BioDrugs 31, 483-485. doi : 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). La grande inondation de CGRP – sources, puits et sites de signalisation dans le système trigéminovasculaire. J. Headache Pain 19:22. doi : 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Sécurité, tolérance, pharmacocinétique et pharmacodynamique de l’anticorps monoclonal liant le CGRP LY2951742 (Galcanezumab) chez des volontaires sains. Front. Pharmacol. 8:740. doi : 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., et Edvinsson, L. (2018). Le fremanezumab bloque la dilatation induite par le CGRP dans les artères cérébrales, méningées moyennes et abdominales humaines. J. Headache Pain 19:66. doi : 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., et Andrade, L. E. C. (2017). Médicaments biologiques anti-TNF : immunogénicité sous-jacente à l’échec thérapeutique et aux événements indésirables. Opinions d’experts. Drug Metab. Toxicol. 13, 985-995. doi : 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., et Brain, S. D. (2014). Calcitonin gene-related peptide : physiologie et physiopathologie. Physiol. Rev. 94, 1099-1142. doi : 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Directive de la fédération européenne des céphalées sur l’utilisation d’anticorps monoclonaux agissant sur le peptide lié au gène de la calcitonine ou son récepteur pour la prévention de la migraine. J. Headache Pain 20:6. doi : 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Résultats primaires de l’essai PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) : une étude de phase 3, randomisée, en double aveugle, contrôlée par placebo, visant à évaluer l’efficacité et la sécurité de l’eptinezumab pour la prévention des migraines épisodiques fréquentes (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Caractérisation pharmacologique de l’AMG 334, un anticorps monoclonal humain puissant et sélectif contre le récepteur du peptide lié au gène de la calcitonine. J. Pharmacol. Exp. Ther. 356, 223-231. doi : 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., et Yang, J. Y. (2018). Efficacité et sécurité du galcanezumab pour la prévention de la migraine épisodique : résultats de l’essai clinique contrôlé randomisé de phase 3 EVOLVE-2. Cephalalgia 38, 1442-1454. doi : 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., et Conley, R. R. (2018). Évaluation du galcanezumab pour la prévention de la migraine épisodique : l’essai clinique randomisé EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi : 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., et Katsarava, Z. (2018). La migraine est la première cause d’invalidité chez les moins de 50 ans : les politiciens de la santé vont-ils maintenant en tenir compte ? J. Headache Pain 19:17. doi : 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amyline, immunologie et médecine des céphalées. Headache 59, 131-150. doi : 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Biomarqueurs de la migraine dans le liquide céphalorachidien : une revue systématique et une méta-analyse. Cephalalgia 37, 49-63. doi : 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Effet de la perfusion de peptide lié au gène de la calcitonine sur les crises de céphalées en grappe : un essai clinique randomisé. JAMA Neurol. 75, 1187-1197. doi : 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., et Hay, D. L. (2010). Régulation de la transduction du signal par les récepteurs du peptide lié au gène de la calcitonine. Trends Pharmacol. Sci. 31, 476-483. doi : 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., et Balthasar, J. P. (2008). Pharmacocinétique et pharmacodynamique des anticorps monoclonaux. Clin. Pharmacol. Ther. 84, 548-558. doi : 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., et Sandkuhler, J. (2014). Neuroinflammation neurogène : réactions inflammatoires du SNC en réponse à l’activité neuronale. Nat. Rev. Neurosci. 15, 43-53. doi : 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., et Silberstein, S. D. (2017). Anticorps monoclonaux anti-CGRP pour la migraine : justification et progrès. BioDrugs 31, 487-501. doi : 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar
.