Les complications mécaniques de l’infarctus aigu du myocarde (IAM) sont la communication interventriculaire (CIV), la rupture ou le dysfonctionnement du muscle papillaire, la rupture de la paroi libre cardiaque, l’anévrisme ventriculaire, l’obstruction dynamique de la voie de sortie (OT) du ventricule gauche (VG) et l’insuffisance du ventricule droit (VR). Toutes ces conditions peuvent potentiellement conduire à une insuffisance du ventricule gauche avec choc cardiogénique.
Une compréhension approfondie des complications mécaniques de l’IAM et de leurs facteurs de risque peut aider les cliniciens à poser un diagnostic précoce. Pour obtenir des résultats favorables pour les patients, un diagnostic rapide avec un traitement médical approprié et une intervention chirurgicale en temps opportun sont nécessaires. Les facteurs importants de la mortalité hospitalière due aux complications mécaniques de l’IM sont l’âge avancé, le choc cardiogénique et l’insuffisance cardiorespiratoire.
Rupture de la paroi libre du ventricule
La RFEV est la complication la plus grave de l’IAM. La RFEV est généralement associée à de grands infarctus transmuraux et à une expansion antécédente de l’infarctus. C’est la cause la plus fréquente de décès, juste après l’insuffisance ventriculaire gauche, et elle représente 15 à 30 % des décès associés à l’IAM. Incontestablement la plus catastrophique des complications mécaniques, le RVF entraîne un hémopéricarde aigu et le décès par tamponnade cardiaque.
L’incidence globale du RVF varie de 0,8 à 6,2%. L’incidence de cette complication a diminué au fil des ans grâce à un meilleur contrôle de la pression artérielle systolique sur 24 heures, à une utilisation accrue du traitement de reperfusion, des bêtabloquants et des inhibiteurs de l’ECA, et à une diminution de l’utilisation de l’héparine.
Les données du National Registry of Myocardial Infarction (NRMI) ont montré une incidence élevée de la mortalité hospitalière chez les patients ayant reçu un traitement thrombolytique (12,1 %) par rapport aux patients n’en ayant pas reçu (6,1 %). Dans l’essai Thrombolysis in Myocardial Infarction Phase II (TIMI II), 16 % des patients sont décédés d’une rupture cardiaque dans les 18 heures suivant le traitement. Les patients qui ont subi une angioplastie coronaire transluminale percutanée (ACTP) ont eu une incidence de rupture de la paroi libre inférieure à celle des patients recevant un traitement thrombolytique.
Les facteurs de risque de RFEV comprennent un âge avancé supérieur à 70 ans, le sexe féminin, l’absence d’antécédents d’infarctus, des ondes Q sur l’ECG, l’hypertension pendant la phase initiale du STEMI, l’utilisation de corticostéroïdes ou d’AINS et un traitement fibrinolytique plus de 14 heures après le début du STEMI. Les patients ayant des antécédents d’angine de poitrine, d’IAM antérieur, de maladie coronarienne multivasculaire et d’insuffisance cardiaque chronique sont moins susceptibles que les autres de développer une VFWR du LV car ils développent des collatérales et un préconditionnement ischémique.
Présentation clinique du RVF
Les RVF sont dramatiques ; ils se présentent de façon aiguë ou parfois subaiguë comme des pseudo-anévrismes ; et ils impliquent le plus souvent la paroi antérieure ou latérale du VG. La plupart des VFWR se produisent dans la première semaine suivant l’IAM.
Becker et al ont classé les 3 types de RVF suivants :
-
Type I – une déchirure abrupte en forme de fente qui est fréquemment associée aux infarctus antérieurs et qui survient précocement (dans les 24 heures)
-
Type II – une érosion du myocarde infarci à la frontière entre le myocarde infarci et le myocarde viable
-
Type III – une formation précoce d’anévrisme corrélée à des infarctus plus anciens et sévèrement étendus
Le type III survient généralement plus tard que les ruptures de type I ou II. Le traitement thrombolytique accélère la survenue de la rupture cardiaque dans les infarctus de type I et II de Becker. Dans les infarctus sévèrement élargis (type III), le traitement thrombolytique diminue l’incidence de la rupture cardiaque.
Un pseudo-anévrisme se forme lorsque le péricarde et l’hématome adjacents obturent une rupture ou une perforation myocardique. La paroi d’un pseudo-anévrisme est le plus souvent visualisée comme une excroissance anévrismale qui communique avec la cavité du ventricule gauche au moyen d’un col étroit. Cette paroi est composée de péricarde et de thrombus et/ou hématome organisé. Elle est dépourvue d’éléments myocardiques, alors qu’un véritable anévrisme possède tous les éléments de la paroi myocardique d’origine et une base relativement large. Le pseudo-anévrisme peut varier en taille et présente un risque élevé de rupture.
Les présentations cliniques du RVF varient selon l’acuité, la localisation et la taille de la rupture. Les patients atteints de RVF aiguë présentent une douleur thoracique sévère, une dissociation électromécanique brutale ou une asystole, un collapsus hémodynamique et éventuellement la mort. Chez environ un tiers des patients, l’évolution est subaiguë et ils présentent des symptômes tels que syncope, hypotension, choc, arythmie et douleurs thoraciques prolongées et récurrentes.
Diagnostic des RVF
Le diagnostic précoce des RVF et l’intervention sont essentiels à la survie des patients. Un indice de suspicion élevé est nécessaire lorsque les patients atteints d’IAM présentent une douleur thoracique sévère, un choc ou des arythmies, et un développement abrupt de la dissociation électromécanique. Les signes ECG d’une FVWR imminente ont une spécificité limitée, mais comprennent la tachycardie sinusale, le défaut de conduction intraventriculaire et l’élévation persistante ou récurrente du segment ST.
L’échocardiographie est l’outil diagnostique de choix. La principale constatation diagnostique est un épanchement péricardique de taille modérée à grande avec des signes cliniques et échocardiographiques de tamponnade péricardique imminente. Chez les patients présentant une tamponnade cardiaque et une dissociation électromécanique, un épanchement péricardique modéré à grave augmente le risque de mortalité. Les patients sans tamponnade cardiaque initiale, bien que présentant un taux de mortalité plus faible, doivent néanmoins être suivis, car une rupture tardive peut toujours se produire. L’absence d’épanchement péricardique à l’échocardiographie a une valeur prédictive négative élevée. Si la capacité d’obtenir des échocardiogrammes transthoraciques est limitée chez les patients sous ventilation mécanique, l’échocardiographie transœsophagienne peut aider à confirmer la VFWR.
L’IRM fournit une qualité d’image supérieure et permet d’identifier le site et l’anatomie d’un pseudo-anévrisme ventriculaire (c’est-à-dire une LV rompue retenue par le péricarde avec un caillot enfermé). Cependant, l’IRM est d’une utilité limitée dans le contexte aigu en raison du temps nécessaire et de la non portabilité des unités d’imagerie.
Traitement du RVF
La stratégie de prévention la plus importante est le traitement de reperfusion précoce, l’intervention coronarienne percutanée (ICP) étant la modalité préférée. Le traitement fibrinolytique est associé à une diminution globale du risque de RVF ; cependant, son utilisation plus de 14 heures après le début du STEMI peut augmenter le risque de rupture précoce.
Le traitement standard de la RVF est la réparation chirurgicale d’urgence après obtention de la stabilité hémodynamique. Les patients peuvent d’abord avoir besoin de liquides intraveineux, d’agents inotropes et d’une péricardiocentèse d’urgence.
Pifarré et ses associés ont recommandé le déploiement d’une pompe à ballonnet intra-aortique pour diminuer la postcharge systolique et améliorer la perfusion myocardique diastolique.
Plusieurs techniques chirurgicales ont été appliquées, notamment l’infarctectomie, l’adhésion avec des patchs de colle biologique en fibre de polyester de polyéthylène téréphtalate (Dacron ; DuPont, Wilmington, DE) ou en résine de fluoropolymère de polytétrafluoroéthylène (Teflon ; DuPont) ; et l’utilisation de sutures gagées sans infarctectomie.
Le taux de mortalité est significativement élevé et dépend largement de l’état hémodynamique préopératoire du patient. Un diagnostic précoce, l’institution rapide des mesures décrites ci-dessus pour obtenir une stabilité hémodynamique et une réparation chirurgicale rapide peuvent améliorer le taux de survie. Un suivi de l’essai randomisé Acorn a démontré une amélioration à long terme de la structure et de la fonction du ventricule gauche après une chirurgie de la valve mitrale, et ce jusqu’à 5 ans. Ces données fournissent des preuves soutenant la réparation de la valve mitrale en combinaison avec le dispositif Acorn CorCap pour les patients souffrant d’insuffisance cardiaque non ischémique avec un dysfonctionnement ventriculaire gauche sévère qui ont été optimisés médicalement mais qui restent symptomatiques avec une régurgitation mitrale significative.
Rupture septale ventriculaire
La RVP est une complication peu fréquente mais potentiellement mortelle de l’IAM. Malgré un traitement médical et chirurgical optimal, les patients atteints de VSR ont un taux de mortalité hospitalière élevé. Avant l’avènement des thrombolytiques, les RVP se produisaient chez 1 à 3 % des personnes ayant subi un IM. L’incidence a diminué avec le traitement thrombolytique (à 0,2-0,34%) en raison des améliorations de la reperfusion et du sauvetage du myocarde. La distribution bimodale du VSR est caractérisée par une incidence élevée dans les 24 premières heures, avec un autre pic aux jours 3-5 et rarement plus de 2 semaines après l’IAM.
Chez les patients recevant des thrombolytiques, le délai médian entre l’apparition des symptômes de l’IAM et la rupture septale était de 1 jour dans l’essai Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) et de 16 heures dans l’essai Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock ? (SHOCK).
Les facteurs de risque de rupture septale comprennent l’âge avancé (>65 ans), le sexe féminin, la maladie monovasculaire, l’IM étendu et la mauvaise circulation collatérale septale. Avant l’avènement des thrombolytiques, l’hypertension et l’absence d’antécédents d’angine de poitrine étaient des facteurs de risque de rupture septale. La taille extensive de l’infarctus et l’implication du VR sont d’autres facteurs de risque connus de rupture septale.
Chez les patients ayant subi un IAM sans reperfusion, une nécrose de coagulation se développe dans les 3 à 5 jours suivant l’infarctus. Les neutrophiles migrent vers la zone nécrotique et subissent une apoptose, libèrent des enzymes lytiques et accélèrent la désintégration du myocarde nécrotique. Certains patients présentent des infarctus avec de grands hématomes intramuraux, qui se dissèquent dans le tissu et entraînent une rupture septale précoce. La taille de la rupture septale varie de quelques millimètres à plusieurs centimètres.
La rupture septale est classée comme simple ou complexe selon sa longueur, son évolution et sa localisation. Dans le cas d’une rupture septale simple, la perforation se situe au même niveau des deux côtés du septum, et une communication directe de part en part est présente à travers le septum. Une rupture septale complexe est caractérisée par une hémorragie étendue avec des trajets irréguliers et serpigineux dans le tissu nécrotique.
Les ruptures septales sont les plus fréquentes chez les patients présentant un gros infarctus du myocarde antérieur dû à une occlusion de l’artère LAD provoquant des infarctus septaux étendus. Ces infarctus sont associés à des élévations du segment ST et à des ondes Q dans les dérivations inférieures (II, III, aVF) et ces modifications ECG sont donc plus fréquemment observées dans les ruptures septales. Ces ruptures sont généralement apicales et simples.
Les ruptures septales chez les patients présentant un IM inférieur sont relativement peu fréquentes. Ces ruptures impliquent le septum basal inféropostérieur et sont souvent complexes.
Présentation clinique de la VSR
Les symptômes de la VSR compliquant un IAM comprennent une douleur thoracique, un essoufflement, une hypotension, une insuffisance biventriculaire et un choc dans les heures à jours qui suivent. Les patients présentent souvent un souffle holosystolique nouveau, fort et difficile. Ce souffle est le plus fort le long du bord inférieur gauche du sternum et est associé à un thrill systolique parasternal palpable. Les galops S3 du VR et du VG sont fréquents.
Chez les patients présentant un choc cardiogénique compliquant une rupture septale, le murmure et le thrill peuvent être difficiles à identifier. En revanche, les patients présentant une RM aiguë ont souvent un souffle systolique doux à l’apex sans thrill.
Diagnostic de la VSR
L’échocardiographie avec imagerie Doppler à flux coloré est l’outil diagnostique de choix pour identifier une VSR. (Voir l’image ci-dessous.) Sa sensibilité et sa spécificité ont été rapportées comme atteignant 100%. En outre, elle peut être utilisée pour les éléments suivants :
-
Définir le site et la taille de la rupture septale
-
Évaluer la fonction LV et RV. fonction
-
Estimez la pression systolique du VR
-
Quantifiez le shunt gauche-à droite
Un cathétérisme cardiaque est généralement nécessaire pour confirmer le diagnostic, quantifier le degré de shunt gauche-droit, différencier le VSR d’autres conditions (par exemple, régurgitation mitrale), plus visualiser les artères coronaires.
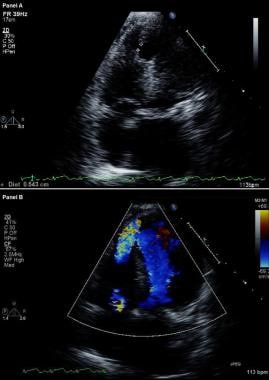 Complications de l’infarctus du myocarde. Échocardiogramme bidimensionnel modifié (en haut) et image Doppler à flux coloré (en bas). Les vues de quatre chambres apicales montrent une brèche dans le septum interventriculaire et une communication libre entre les ventricules à travers un large défaut septal ventriculaire apical chez un patient ayant récemment subi un infarctus du myocarde antérieur.
Complications de l’infarctus du myocarde. Échocardiogramme bidimensionnel modifié (en haut) et image Doppler à flux coloré (en bas). Les vues de quatre chambres apicales montrent une brèche dans le septum interventriculaire et une communication libre entre les ventricules à travers un large défaut septal ventriculaire apical chez un patient ayant récemment subi un infarctus du myocarde antérieur. Chez les patients atteints de VSR, le cathétérisme cardiaque droit montre une augmentation de la saturation en oxygène de l’oreillette droite vers le RV ; en revanche, aucune augmentation de la saturation en oxygène ne se produit chez les patients atteints de MR. La présence de grandes ondes V dans le tracé du coin capillaire pulmonaire appuie le diagnostic de RM aiguë sévère.
La ventriculographie gauche peut également être utilisée pour identifier le site de la rupture ventriculaire (voir Cathétérisme cardiaque ). Cependant, cette étude est généralement inutile après la réalisation d’un examen échocardiographique et Doppler de bonne qualité.
Traitement de la VSR
La clé de la prise en charge de la VSR est un diagnostic rapide et une approche agressive de stabilisation hémodynamique, d’angiographie et de chirurgie. L’approche optimale comprend une stabilisation hémodynamique avec l’administration d’oxygène et un soutien mécanique avec l’utilisation d’une pompe à ballonnet intra-aortique, ainsi que l’administration de vasodilatateurs (pour réduire la postcharge et donc la pression du VG et le shunt gauche-droit), de diurétiques et d’agents inotropes.
Un cathétérisme cardiaque est nécessaire pour définir l’anatomie coronaire ; il est suivi d’une réparation chirurgicale urgente.
Dans une étude portant sur 52 patients consécutifs présentant une rupture septale ventriculaire post-infarctus et réparée chirurgicalement, les investigateurs ont constaté que le taux de mortalité à 30 jours était de 36 % (n = 19). La plupart des patients qui ont survécu moins de 30 jours avaient un état de choc préopératoire. Les investigateurs concluent que pour les patients présentant une rupture septale ventriculaire, l’amélioration préopératoire de l’état de choc et une revascularisation coronaire agressive sont nécessaires.
La thérapie médicale n’est destinée qu’à une stabilisation temporaire avant la chirurgie, car l’état de la plupart des patients se détériore rapidement et ils meurent en l’absence d’intervention chirurgicale. Dans l’essai GUSTO-I, le taux de mortalité à 30 jours était plus faible chez les patients atteints de VSR ayant subi une réparation chirurgicale que chez les patients traités médicalement (47 % contre 94 %), tout comme le taux de mortalité à 1 an (53 % contre 97 %). Lemery et al ont rapporté un taux de survie à 30 jours de 24 % chez les patients traités médicalement, contre 47 % chez ceux traités chirurgicalement.
Les lignes directrices de l’American College of Cardiology/American Heart Association (ACC/AHA) pour le traitement des patients présentant une rupture septale compliquant un IAM mettent en évidence une intervention chirurgicale urgente, quel que soit leur état clinique. La prise en charge chirurgicale de la rupture septale comprend les éléments suivants :
-
Mise en place rapide d’une dérivation cardio-pulmonaire hypothermique
-
Une approche de la rupture septale à travers la zone d’infarctus et l’excision de toutes les marges nécrotiques et friables du septum et des parois ventriculaires pour éviter une hémorragie postopératoire, un défaut septal résiduel, ou les deux
-
Reconstruction du septum et des parois ventriculaires en utilisant du matériel prothétique et préservation de la configuration géométrique des ventricules et de la fonction cardiaque
La fermeture percutanée de la rupture septale est une approche relativement nouvelle, utilisée chez certains patients comme alternative à la réparation chirurgicale ou pour la stabilisation aiguë des patients gravement malades. Cependant, la fermeture percutanée n’est actuellement pas disponible dans de nombreuses institutions, et aucune donnée sur les résultats à long terme n’est disponible.
Plusieurs études n’ont pas réussi à montrer une relation entre la mortalité péri-opératoire et la revascularisation coronaire concomitante (pontage aorto-coronarien). Les patients présentant un choc cardiogénique dû à une rupture septale ont le plus mauvais résultat. Dans l’essai SHOCK, le taux de mortalité à l’hôpital était plus élevé chez les patients présentant un choc cardiogénique dû à une rupture septale (87,3 %) que chez les patients présentant un choc cardiogénique de toutes autres causes (59,2 % avec insuffisance ventriculaire gauche pure et 55,1 % avec RM aiguë).
Chez les patients qui survivent à une réparation chirurgicale, le taux d’anomalie septale récurrente ou résiduelle serait d’environ 28%, et le taux de mortalité associé est élevé.
Une nouvelle intervention chirurgicale est indiquée chez les patients qui présentent une insuffisance cardiaque clinique ou une fraction pulmonaire-systémique supérieure à 2.
Régurgitation mitrale aiguë
La RM est une complication fréquente de l’IAM qui résulte d’un remodelage local et global du VG et qui est un prédicteur indépendant d’insuffisance cardiaque et de décès. La RM survient généralement 7 à 10 jours après un IAM, bien que ce délai puisse varier en fonction du mécanisme de la RM. La rupture du muscle papillaire entraînant un RM survient dans les 1 à 14 jours (médiane, 1 j).
Un RM léger à modéré est souvent cliniquement silencieux et détecté par échocardiographie Doppler effectuée pendant la phase précoce de l’IAM. Dans de tels cas, le MR provoque rarement un compromis hémodynamique.
Le suivi des spicules et l’échocardiographie tridimensionnelle se sont avérés être des outils d’imagerie importants pour évaluer le remodelage inverse du VG après une chirurgie de régurgitation de la valve mitrale dégénérative. De subtils changements régionaux préopératoires de la fonction diastolique de la paroi septale et latérale ont pu être identifiés en préopératoire, aidant à optimiser le moment de référence et à reconnaître les coupables potentiels comme indicateurs de récidive de la maladie après la réparation mitrale.
La RM aiguë sévère qui résulte de la rupture des muscles papillaires ou des cordes tendineuses entraîne une détérioration hémodynamique brutale avec choc cardiogénique. Un diagnostic rapide, une stabilisation hémodynamique et une intervention chirurgicale rapide sont nécessaires car la RM aiguë sévère est associée à un taux de mortalité élevé.
L’incidence rapportée de la RM peut varier en raison de plusieurs facteurs, notamment les méthodes diagnostiques utilisées, la présence ou l’absence d’insuffisance cardiaque, le degré de RM rapporté, le type de traitement administré et le délai entre l’apparition de l’infarctus et le test.
Pendant l’essai GUSTO-I, l’incidence de la RM chez les patients recevant un traitement thrombolytique était de 1,73 %. L’essai SHOCK, qui incluait des patients victimes d’un IM présentant un choc cardiogénique, a noté une incidence de 39,1 % de RM modérée à sévère. Kinn et al ont rapporté que la reperfusion par angioplastie a entraîné une diminution de 82% du taux de RM aiguë, par rapport au traitement thrombolytique (0,31% vs 1,73%).
Les facteurs de risque de RM sont l’âge avancé, le sexe féminin, un infarctus important, un IAM antérieur, une ischémie récurrente, une coronaropathie multivasculaire et une insuffisance cardiaque.
Plusieurs mécanismes peuvent provoquer une RM après un IAM. La rupture du muscle papillaire est le mécanisme le plus fréquemment rapporté.
Cette rupture survient chez 1 % des patients ayant subi un IAM et implique fréquemment le muscle papillaire postéro-interne plutôt que le muscle papillaire antéro-externe, car le premier n’a qu’un seul apport sanguin contre un double apport pour le second. La rupture du muscle papillaire peut entraîner un battement ou un prolapsus des feuillets, ce qui entraîne une RM grave. Le dysfonctionnement du muscle papillaire dû à la cicatrisation ou à l’ischémie récurrente peut également entraîner un RM dans les phases subaiguës et chroniques après l’IM ; cette condition peut se résoudre spontanément.
Les grands infarctus postérieurs produisent un RM aigu en raison de la dilatation annulaire asymétrique et de l’altération de la fonction et de la géométrie du muscle papillaire.
Présentation clinique du RM
Les patients présentant un RM léger ou modéré fonctionnel sont souvent asymptomatiques. La gravité des symptômes varie en fonction de la fonction ventriculaire. Les caractéristiques cliniques d’un RM aigu sévère comprennent l’essoufflement, la fatigue, un nouveau souffle holosystolique apical, un œdème pulmonaire flash et un choc.
Le nouveau souffle systolique peut n’être que systolique précoce à moyen, et non holosystolique. Il peut être mou ou même absent en raison de l’augmentation brutale de la pression auriculaire gauche, qui diminue le gradient de pression entre l’oreillette gauche et le VG, par rapport à la RM chronique. Le souffle est mieux entendu à l’apex qu’au bord inférieur gauche du sternum, et il est rarement associé à un thrill. Des galops S3 et S4 sont attendus.
Diagnostic du RM
Le clinicien ne peut pas se fier à un nouveau souffle holosystolique pour diagnostiquer le RM ou évaluer sa sévérité en raison de l’état hémodynamique variable. Chez un patient atteint d’IAM qui présente un nouveau souffle systolique apical, un œdème pulmonaire aigu et un choc cardiogénique, un indice élevé de suspicion clinique de RM grave est la clé du diagnostic.
La radiographie thoracique peut montrer des signes d’œdème pulmonaire dans le contexte aigu sans hypertrophie cardiaque cliniquement significative.
L’échocardiographie avec imagerie Doppler à flux coloré est l’outil diagnostique standard pour détecter la RM. L’échocardiographie transthoracique est l’outil de dépistage initial privilégié, mais l’échocardiographie transœsophagienne est précieuse pour définir la gravité et le mécanisme exact de la RM aiguë, en particulier lorsque la suspicion de rupture du muscle papillaire est élevée. Un cathétérisme cardiaque doit être effectué chez tous les patients afin de déterminer l’étendue et la gravité de la maladie coronarienne.
Traitement du RM
La détermination de la stabilité hémodynamique, l’élucidation du mécanisme exact du RM aigu et un traitement rapide sont tous nécessaires pour une issue favorable. La prise en charge médicale comprend la réduction de la postcharge par l’utilisation de diurétiques, de nitroprussiate de sodium et de nitrates chez les patients qui ne sont pas hypotendus.
Chez les patients dont l’hémodynamique est compromise, la contre-pulsion par ballonnet intra-aortique doit être déployée rapidement. Cette intervention réduit généralement de manière substantielle la postcharge et le volume régurgitant, améliorant ainsi le débit cardiaque en vue d’une réparation chirurgicale. Sans réparation chirurgicale, le traitement médical seul chez les patients présentant une rupture du muscle papillaire entraîne une amélioration hémodynamique inadéquate et un mauvais pronostic à court terme.
L’intervention chirurgicale d’urgence est le traitement de choix pour la rupture du muscle papillaire. Les approches chirurgicales peuvent inclure la réparation ou le remplacement de la valve mitrale. En l’absence de nécrose du muscle papillaire, la réparation de la valve mitrale améliore davantage le taux de survie que le remplacement de la valve mitrale. Cette différence s’explique par le fait que l’appareil sous-valvulaire est généralement préservé. La réparation de la valve mitrale élimine également les complications liées au mauvais fonctionnement de la prothèse.
Chez les patients présentant une nécrose étendue du muscle papillaire et/ou de la paroi libre ventriculaire, le remplacement de la valve mitrale est la modalité préférée. Un pontage aorto-coronarien (PAC) effectué au moment de la chirurgie a montré dans une étude qu’il améliorait la survie à court et à long terme.
La seule situation dans laquelle la chirurgie d’urgence peut être évitée en toute sécurité est le cas d’une RM intermittente due à une ischémie récurrente. Chez ces patients, une revascularisation myocardique réussie peut être efficace. Cette procédure est accomplie au moyen d’une angioplastie ou d’un pontage aorto-coronarien.
Dynamique LVOTO
On pensait à l’origine qu’elle n’était présente que dans la cardiomyopathie hypertrophique, divers chercheurs ont signalé la présence d’une LVOTO dynamique comme complication de l’IM antérieur aigu. La présence d’une LVOTO dynamique a également été postulée comme l’une des étiologies de la rupture myocardique.
La LVOTO dynamique est mécaniquement causée par une hyperkinésie compensatoire des segments basal et médian du LV chez les patients présentant des infarctus distaux du LAD. Les facteurs prédictifs de l’amélioration du mouvement de la paroi régionale dans les zones non infarcies sont l’absence de maladie multivasculaire, le sexe féminin et un débit plus élevé dans le vaisseau lié à l’infarctus. L’augmentation de la force contractile du myocarde basal provoque une régurgitation mitrale via l’effet Venturi. Il en résulte une augmentation de l’OTO, ce qui entraîne une réduction supplémentaire du débit du VG dans le cadre d’une hypoperfusion systémique déjà présente.
Cette augmentation de l’OTO du VG dans le cadre d’un myocarde transmural endommagé forme un cadre parfait dans lequel il y a une augmentation de la pression intraventriculaire end-systolique, ce qui induit une augmentation de la contrainte de paroi de la zone d’infarctus affaiblie et nécrosée. Cette complication fréquemment fatale survient le plus souvent chez les femmes, les patients plus âgés (>70 ans) et ceux qui n’ont pas eu d’infarctus antérieur.
Présentation clinique du LVOTO
Les patients affectés peuvent présenter les symptômes habituels d’un complexe de symptômes autonomes intensifiés tels que la détresse respiratoire, la diaphorèse et les extrémités froides et moites, en plus des signes et symptômes typiques de l’IAM.
Ces patients peuvent rapidement évoluer vers un choc cardiogénique avec une orthopnée, une dyspnée et une oligurie sévères, et ils peuvent avoir un état mental altéré par une hypoperfusion cérébrale. Les patients peuvent présenter un nouveau souffle d’éjection systolique, un nouveau souffle holosystolique irradiant vers l’aisselle à la suite d’un mouvement antérieur systolique (SAM) du feuillet mitral. Un galop en S3, des râles pulmonaires, une hypotension et une tachycardie peuvent également être présents ; ces derniers signes physiques peuvent être totalement absents dans le contexte aigu.
L’échocardiographie transthoracique ou transœsophagienne (ETT/ETH) est le test diagnostique de choix et peut caractériser avec précision le segment hyperkinétique, la LVOTO et le SAM du feuillet mitral.
Traitement de la LVOTO
Envisagez de réduire l’hypercontractilité du myocarde en employant l’ajout prudent de bêta-bloquants. De même, une réanimation volumique lente par augmentation de la postcharge (phényléphérine) peut augmenter la précharge et diminuer le LVOTO et le SAM. Il serait préférable d’éviter les médicaments augmentant la postcharge. Les vasodilatateurs, les inotropes et les pompes à ballonnet devraient également être évités car ils peuvent augmenter la LVOTO.
Défaillance du VR
Souvent observée dans le cadre d’un IM inférieur, la dysfonction légère du VR post-IAM est fréquente ; cependant, dans la plupart des cas, l’effet sur le VG est minime.
Une hypokinésie significative du VR se produit lorsqu’il y a une occlusion de l’artère coronaire droite proximale avec peu de collatérales de la circulation du côté gauche. Il est postulé que, comme le VR a une paroi mince et une demande en oxygène plus faible, il y a une perfusion coronaire pendant tout le cycle cardiaque ; par conséquent, l’infarctus irréversible généralisé est rare.
La défaillance typique du VR peut se présenter avec une hypotension (due à l’absence de précharge du VG) et une distension veineuse jugulaire avec un champ pulmonaire clair. Bien que classiquement décrite dans le cadre d’une insuffisance du VR, cette triade est rarement observée dans sa forme pure dans le contexte clinique. La plupart des patients présentent un choc cardiogénique à faible débit ou une insuffisance ventriculaire gauche avec des symptômes autonomes associés.
La présence d’une pression veineuse jugulaire supérieure à 8 cm H2O et du signe de Kussmaul est très sensible et spécifique d’une insuffisance RV sévère.
Occasionnellement, une dérivation droite-gauche via un foramen ovale persistant provoque une hypoxémie persistante. Gardez cette complication particulière à l’esprit.
Electrocardiographiquement, les patients présentent un sursaut ST inférieur en conjonction avec un sursaut ST dans la dérivation V4R. La radiographie pulmonaire apparaît généralement fade, sans distension veineuse du lobe supérieur.
Diagnostic de l’insuffisance RV
L’échocardiographie bidimensionnelle (2D) et l’imagerie par résonance magnétique (IRM) sont très utiles. Le plus souvent, l’échocardiographie permet d’affirmer le diagnostic.
Les résultats du cathétérisme de Swan-Ganz sont généralement évocateurs de pressions élevées du VR avec une PCWP basse.
Traitement de l’insuffisance du VR
La réanimation volumique pour maintenir la PCWP à ou autour de 15 mmHg pourrait aider à temporiser en augmentant transitoirement la précharge du VR. Bien que le traitement définitif implique le rétablissement de la circulation coronaire. Dans de rares cas de défaillance grave du VR, il faut envisager une assistance circulatoire mécanique à l’aide de dispositifs d’assistance au VR (DA), soit temporairement, soit comme thérapie de pont dans le cadre d’une atteinte biventriculaire étendue.