Les coenzymes sont de petites molécules organiques qui se lient aux enzymes et dont la présence est essentielle à l’activité de ces enzymes. Les coenzymes appartiennent au groupe plus large appelé cofacteurs, qui comprend également les ions métalliques ; cofacteur est le terme plus général pour les petites molécules nécessaires à l’activité de leurs enzymes associées. La relation entre ces deux termes est la suivante
I. Cofacteurs
- Ions essentiels
- Liés de manière lâche (formant des enzymes activées par des métaux)
- Liés de manière étroite (formant des métalloenzymes
- Coenzymes
- Groupes prosthétiques liés de manière étroite
- 2 Cosubstrats liés de manière lâche
De nombreux coenzymes sont dérivés de vitamines . Le tableau 1 énumère les vitamines, les coenzymes qui en sont dérivés, le type de réactions auxquelles ils participent et la classe de coenzyme.
Les groupes prosthétiques sont étroitement liés aux enzymes et participent aux cycles catalytiques des enzymes. Comme tout catalyseur , un complexe enzyme-groupe prosthétique subit des modifications au cours de la réaction, mais avant de pouvoir catalyser une autre réaction, il doit revenir à son état initial.
La flavine adénine dinucléotide (FAD) est un groupe prosthétique qui participe à plusieurs réactions d’oxydo-réduction intracellulaires. Au cours du cycle catalytique de l’enzyme succinate déshydrogénase, le FAD accepte deux électrons du succinate, donnant du fumarate comme produit. Comme le FAD est étroitement lié à l’enzyme, la réaction est parfois représentée de cette façon
succinate + E-FAD → fumarate + E-FADH 2
où E-FAD représente l’enzyme étroitement liée au groupe prosthétique FAD. Dans cette réaction, le coenzyme FAD est réduit en FADH 2 et reste étroitement lié à l’enzyme tout au long de la réaction. Avant que l’enzyme puisse catalyser l’oxydation d’une autre molécule de succinate, les deux électrons appartenant maintenant à E-FADH 2 doivent être transférés à un autre accepteur d’électrons, l’ubiquinone. Le complexe E-FAD régénéré peut alors oxyder une autre molécule de succinate.
Les cosubstrats sont des coenzymes faiblement liés qui sont requis en quantité stœchiométrique par les enzymes. La molécule nicotinamide adénine dinucléotide (NAD) agit comme cosubstrat dans la réaction d’oxydoréduction qui est catalysée par la malate déshydrogénase, l’une des enzymes du cycle de l’acide citrique.
malate + NAD + → oxaloacétate + NADH
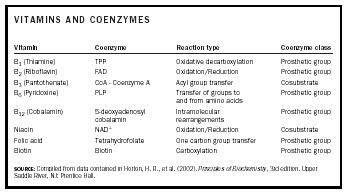
| VITAMINES ET COENZYMES | ||||
| Vitamine | Coenzyme | Type de réaction | Classe de coenzyme | |
| SOURCE : Compilation des données contenues dans Horton, H. R., et al. (2002). Principes de biochimie, 3e édition. Upper Saddle River, NJ : Prentice Hall. | ||||
| B 1 (Thiamine) | TPP | Décarboxylation oxydative | Groupe prothétique | |
| . B 2 (Riboflavine) | FAD | Oxydation/Réduction | Groupe prosthétique | |
| B 3 (Pantothénate) | CoA – Coenzyme A | Transfert de groupe acyle | Cosubstrat | |
| B 6 (Pyridoxine) | PLP | . | Transfert de groupes vers et depuis les acides aminés | Groupe prothétique |
| B 12 (Cobalamine) | 5-désoxyadénosyl cobalamine | Réarrangements intramoléculaires | Groupe prosthétique | |
| Niacine | NAD + | Oxydation/Réduction | Cosubstrat | |
| Acide folique | Tétrahydrofolate | Transfert d’un groupe carboné | Groupe prosthétique | |
| Biotine | Biotine | Carboxylation | Groupe prosthétique | |
Dans cette réaction, le malate et le NAD + diffusent dans le site actif de la malate déshydrogénase. Là, le NAD + accepte deux électrons du malate ; l’oxaloacétate et le NADH diffusent ensuite hors du site actif. Le NADH réduit doit ensuite être ramené à sa forme NAD +. Pour chaque cycle catalytique, une « nouvelle » molécule de NAD + est nécessaire pour que la réaction ait lieu ; des quantités stœchiométriques du cosubstrat sont donc nécessaires. La forme réduite de cette coenzyme (NADH) est reconvertie en forme oxydée (NAD + ) via un certain nombre de processus se déroulant simultanément dans la cellule, et le NAD + régénéré peut alors participer à un autre cycle de catalyse.
Les coenzymes sont donc un type de cofacteur. Ce sont de petites molécules organiques qui se lient de façon serrée (groupes prosthétiques) ou lâche (cosubstrats) aux enzymes lorsqu’elles participent à la catalyse.