Propriétés physiques des composés ioniques par rapport aux composés covalents
En général, les composés ioniques et covalents ont des propriétés physiques différentes. Les composés ioniques forment des solides cristallins durs qui fondent à haute température et sont résistants à l’évaporation. Ces propriétés découlent de la structure interne caractéristique d’un solide ionique, illustrée schématiquement dans la partie (a) de la figure 2.7.4 qui montre le réseau tridimensionnel d’ions positifs et négatifs alternés maintenus ensemble par de fortes attractions électrostatiques. En revanche, comme le montre la partie (b) de la figure 9.5.1, la plupart des composés covalents sont constitués de molécules discrètes maintenues ensemble par des forces intermoléculaires relativement faibles (les forces entre les molécules), même si les atomes de chaque molécule sont maintenus ensemble par des liaisons covalentes intramoléculaires fortes (les forces à l’intérieur de la molécule). Les substances covalentes peuvent être des gaz, des liquides ou des solides à température et pression ambiantes, selon la force des interactions intermoléculaires. Les solides moléculaires covalents ont tendance à former des cristaux mous qui fondent à basse température et s’évaporent facilement.
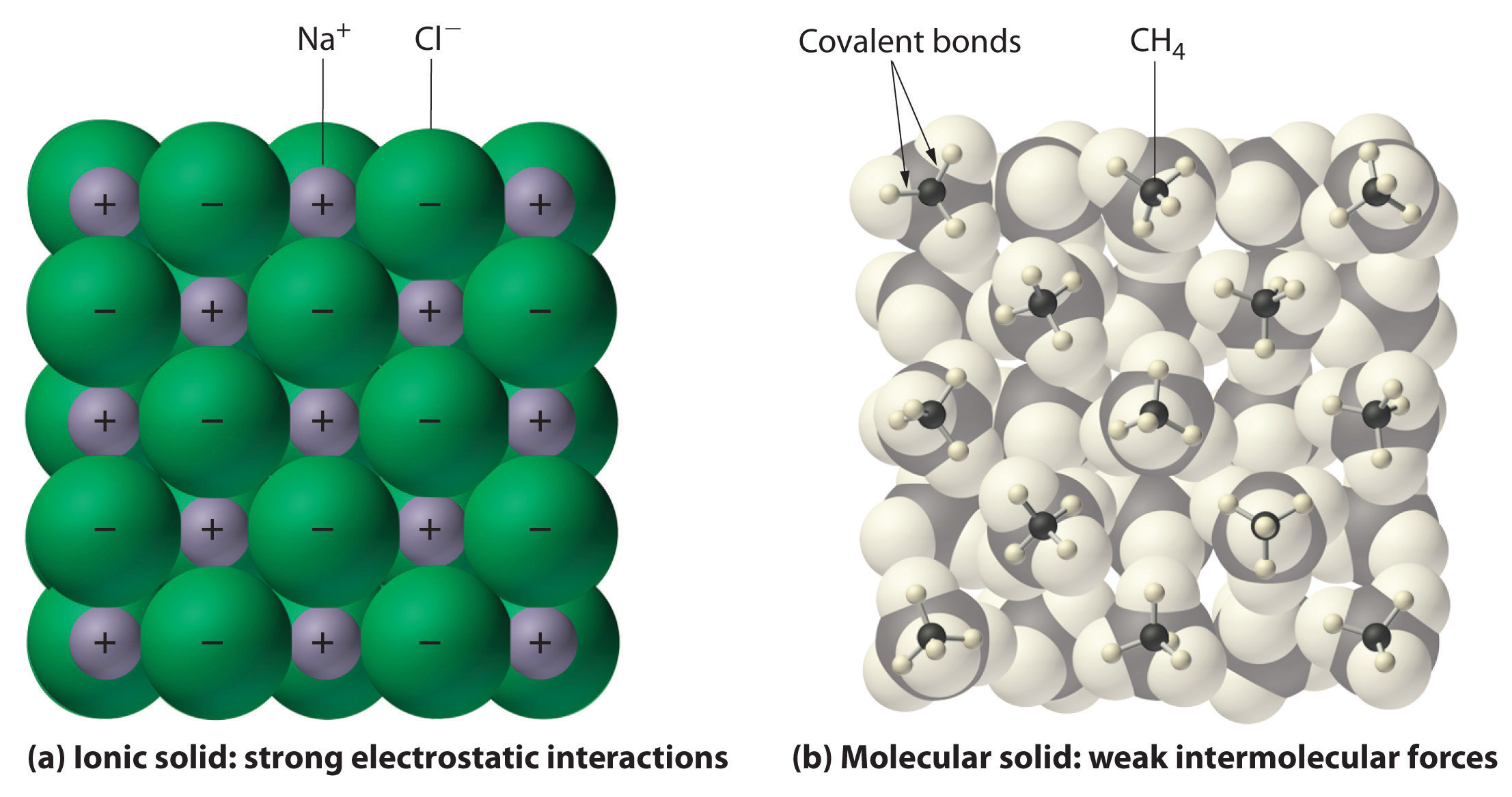
Figure 9.5.1 : Interactions dans les solides ioniques et covalents. (a) Les ions chargés positivement et négativement dans un solide ionique tel que le chlorure de sodium (NaCl) sont maintenus ensemble par de fortes interactions électrostatiques. (b) Dans cette représentation de l’empilement des molécules de méthane (\(CH_4\)) dans le méthane solide, un solide moléculaire prototypique, les molécules de méthane ne sont maintenues ensemble dans le solide que par des forces intermoléculaires relativement faibles, même si les atomes de chaque molécule de méthane sont maintenus ensemble par des liaisons covalentes fortes.
Hydrocarbures
Les solides moléculaires sont constitués d’atomes ou de molécules maintenus les uns aux autres par des interactions dipôle-dipôle, des forces de dispersion de London, ou des liaisons hydrogène, ou toute combinaison de ces éléments. L’arrangement des molécules dans le benzène solide est le suivant :

Figure 9.5.2 : La structure du benzène solide. Dans le benzène solide, les molécules ne sont pas disposées avec leurs plans parallèles les uns aux autres mais à des angles de 90°.
Parce que les interactions intermoléculaires dans un solide moléculaire sont relativement faibles par rapport aux liaisons ioniques et covalentes, les solides moléculaires ont tendance à être mous, à fondre faiblement et à se vaporiser facilement (\(ΔH_{fus}\) et \(ΔH_{vap}\) sont faibles). Pour des substances similaires, la force des forces de dispersion de Londres augmente régulièrement avec l’augmentation de la masse moléculaire. Par exemple, les points de fusion du benzène (C6H6), du naphtalène (C10H8) et de l’anthracène (C14H10), avec un, deux et trois cycles aromatiques fusionnés, sont respectivement de 5,5°C, 80,2°C et 215°C. Les enthalpies de fusion augmentent également de façon régulière au sein de la série : benzène (9,95 kJ/mol) < naphtalène (19,1 kJ/mol) < anthracène (28,8 kJ/mol). Cependant, si les molécules ont des formes qui ne peuvent pas s’entasser efficacement dans le cristal, alors les points de fusion et les enthalpies de fusion ont tendance à être étonnamment bas parce que les molécules sont incapables de s’arranger pour optimiser les interactions intermoléculaires. Ainsi, le toluène (C6H5CH3) et le m-xylène ont des points de fusion de -95°C et -48°C, respectivement, qui sont significativement inférieurs au point de fusion de l’analogue plus léger mais plus symétrique, le benzène.
Le caoutchouc autocicatrisant est un exemple de solide moléculaire ayant le potentiel d’applications commerciales importantes. Le matériau peut s’étirer, mais lorsqu’il est cassé en morceaux, il peut se recoller grâce au rétablissement de son réseau de liaison hydrogène sans montrer aucun signe de faiblesse. Entre autres applications, il est étudié pour son utilisation dans les adhésifs et les pneus de bicyclette qui s’auto-réparent.

Figure 9.5.3 : Le toluène et le m-xylène. Les groupes méthyles attachés au cycle phényle dans le toluène et le m-xylène empêchent les cycles de s’agglutiner aussi bien que dans le benzène solide.
.