24-6C Réactions des composés nitrés
Les composés nitrés sont assez instables au sens thermodynamique ; par exemple, la chaleur de décomposition du nitrométhane, selon la stœchiométrie suivante, est \(67.4 \ : \text{kcal mol}^{-1}\).
\
On tire parti des énergies considérables et des vitesses rapides de réactions de ce genre dans l’utilisation commerciale des composés nitrés comme explosifs. Avec certains composés nitrés, comme le TNT, il y a un autre avantage, celui d’une faible sensibilité aux chocs.
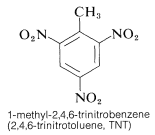
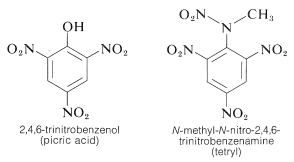
Le TNT ne détonne pas facilement par simple impact et brûle même sans exploser. Cependant, une fois que la détonation commence, la décomposition se propage rapidement. Les caractéristiques de stabilité de manipulation raisonnable et de potentiel thermodynamique élevé rendent les composés nitrés particulièrement utiles. D’autres composés polynitro qui sont utiles comme explosifs comprennent le PETN (section 17-3C), la cyclonite (section 16-4C), l’acide picrique et le tetryl:
Une caractéristique importante des composés polynitro aromatiques est leur capacité à former des complexes de « transfert de charge » avec des hydrocarbures aromatiques, en particulier ceux qui sont substitués par des groupes alkyle. Les complexes de 2,4,6-trinitrobenzénol (acide picrique) et d’hydrocarbures aromatiques sont souvent des solides cristallins, qui sont utiles pour la séparation, la purification et l’identification des hydrocarbures aromatiques. Ces substances sont appelées « picrates d’hydrocarbures », mais ce nom est trompeur car il ne s’agit pas réellement de sels. En outre, des complexes similaires sont formés entre les hydrocarbures aromatiques et le trinitrobenzène, ce qui démontre que les groupes nitro plutôt que le groupe hydroxyle sont essentiels à la formation du complexe. La liaison dans ces complexes ressemble à celle des complexes \(\pi\) des halogènes avec les alcènes et le benzène (sections 22-4D et 10-3C) et résulte de forces attractives entre les substances riches en électrons et les substances pauvres en électrons. Le nom descriptif – complexe de transfert de charge – suggère que le complexe présente des structures VB impliquant le transfert d’un électron de la molécule donneuse (riche en électrons) à la molécule acceptrice (pauvre en électrons). Le nom de complexe \(\pi\) est également utilisé parce que, généralement, au moins un composant du complexe possède un système \(\pi\)-électronique. Les complexes à transfert de charge ou \(\pi\) entre les composés polynitro et les hydrocarbures aromatiques semblent donner des structures de type sandwich avec les anneaux aromatiques dans des plans parallèles, bien que pas nécessairement centrés exactement l’un sur l’autre:
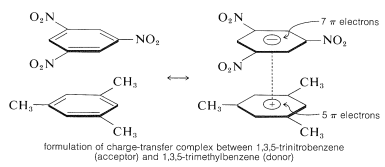
Les complexes à transfert de charge sont presque toujours plus fortement colorés que leurs composants individuels. Un exemple spectaculaire est celui du benzène et du tétracyanoéthène, dont chacun séparément est incolore, mais qui donnent un complexe orange vif lorsqu’ils sont mélangés. Un déplacement vers des longueurs d’onde d’absorption plus grandes, par rapport à leurs composants, est à prévoir pour les complexes à transfert de charge en raison de la possibilité accrue de stabilisation de l’état excité par délocalisation des électrons impliquant les deux composants.
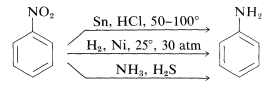
La réduction des composés nitrés se produit facilement avec une variété d’agents réducteurs et de telles réductions permettent une synthèse particulièrement utile des amines aromatiques (section 23-12B) :
La réduction d’un composé nitré en une amine nécessite six équivalents d’agent réducteur :
On ne s’attendrait pas à ce qu’une telle réduction se produise en une seule étape. En effet, la réduction se fait par étapes et procède par une chaîne d’intermédiaires qui, avec des agents réducteurs forts en solution acide, ont tout au plus une existence transitoire. Les intermédiaires formés successivement à partir de \(\ce{RNO_2}\) par des incréments de deux équivalents d’agent réducteur sont des composés nitroso, \(\ce{R-N=O}\), et des azanols substitués par \(\ce{N}\) (hydroxylamines), \(\ce{RNHOH}\):
\}{{\longrightarrow}} \ce{RN=O} \Nsurprise{2 \Ngauche}{\longueur-flèche} \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}\]
Ainsi, les azanols \(\ce{N}\)-aryl-substitués peuvent être obtenus directement à partir des composés nitro correspondants avec une solution de zinc et de chlorure d’ammonium. Cependant, le zinc et l’acide chlorhydrique donnent l’amine:
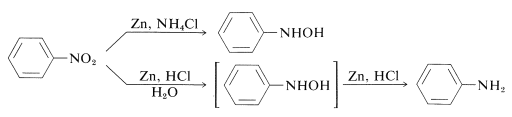
La différence entre ces réactions réside dans les vitesses de réduction associées à l’acidité de la solution. Le chlorure d’ammonium est un acide beaucoup plus faible que le \(\ce{HCl}\) ; le pH des solutions de chlorure d’ammonium est d’environ 6.
L’oxydation des \(\ce{N}\)-arylazanols dans des conditions contrôlées donne des composés nitroso. Cette réaction n’est pas sans rappeler l’oxydation des alcools en cétones (section 15-6B):
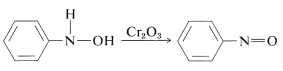
La réduction des composés nitro aryliques avec des agents réducteurs moins puissants, surtout en milieu alcalin, donne ce qui peut sembler être un conglomérat mystérieux de produits de réduction bimoléculaires. Par exemple, avec le nitrobenzène,
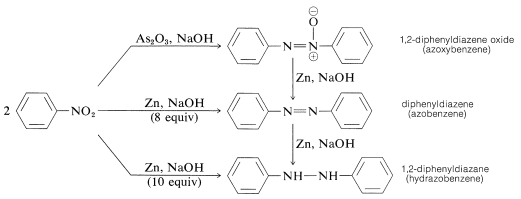
Toutes ces substances peuvent être réduites en benzénamine avec l’étain et l’acide chlorhydrique. Par conséquent, chacune pourrait être, mais n’est pas nécessairement, un intermédiaire dans la réduction des composés nitrés en amines. La formation des produits de réduction bimoléculaires est le résultat de réactions induites par des bases entre les composés nitroso et les azanols ou les amines et éventuellement d’une réduction supplémentaire des substances initialement produites.
Plusieurs dérivés du polynitrobenzène ont des utilisations herbicides importantes. Citons par exemple la \(\ce{N}^3\), \(\ce{N}^3\)-diéthyl-6-trifluorométhyl-2,4-dinitro-1,3-benzènediamine et la \(\ce{N}\),\(\ce{N}\)-dipropyl-4-trifluorométhyl-2,6-dinitrobenzènamine :
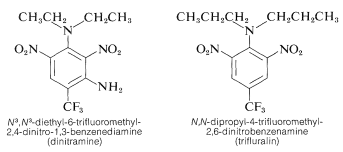
Ces substances, lorsqu’elles sont mélangées au sol, tuent les plantules de mauvaises herbes mais pas les plantes cultivées comme le coton, le soja et les arachides. L’activité est élevée ; normalement, seulement environ \(0,08 \ : \text{g m}^{-2}\) est nécessaire pour un bon contrôle des mauvaises herbes.
Les réactions les plus importantes des nitroalcanes sont celles impliquant les \(\alpha\) hydrogènes des composés primaires et secondaires. Par exemple, le nitrométhane est suffisamment acide pour se dissoudre dans des solutions aqueuses d’hydroxyde. L’anion ainsi produit a une structure électronique analogue à celle de l’anion nitrate :
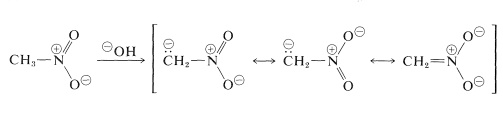
Une propriété intéressante de cet ion est que, lorsque des solutions de celui-ci sont acidifiées, un isomère instable et assez fortement acide du nitrométhane (appelé forme aci) est produit, qui revient lentement à la forme nitro plus stable :
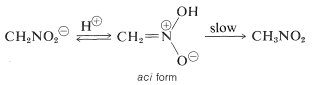
Des changements similaires ont lieu lors de l’acidification du sel énol d’un composé carbonyle, la principale différence étant la durée de vie beaucoup plus longue du composé aci-nitro par rapport à celle d’un énol d’une cétone simple (voir section 17-1B).
Les composés nitrés primaires et secondaires subissent des additions d’aldol et des additions de Michael avec des composés carbonylés appropriés et des catalyseurs basiques :
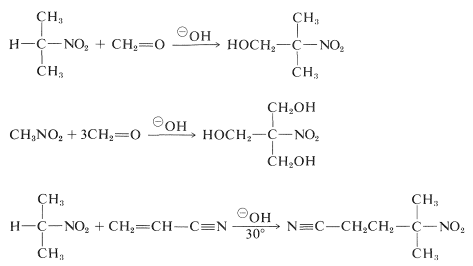
Malheureusement, les réactions d’alkylation analogues à l’alkylation des composés carbonylés catalysée par les bases ne sont généralement pas utiles pour la synthèse des composés nitrés supérieurs, car la \(\ce{C}\)-alkylation des bases conjuguées des composés nitrés primaires est plus lente que la \(\ce{O}\)-alkylation.