Objectifs d’apprentissage
- Définir et donner des exemples des principaux types de radioactivité.
Les atomes sont composés de particules subatomiques – protons, neutrons et électrons. Les protons et les neutrons sont situés dans le noyau et fournissent la majeure partie de la masse de l’atome, tandis que les électrons entourent le noyau dans des coquilles et des sous-coquilles et expliquent la taille de l’atome. Rappelez-vous, la notation pour représenter succinctement un isotope d’un atome particulier:
\
L’élément dans cet exemple, représenté par le symbole C, est le carbone. Son numéro atomique, 6, est l’indice inférieur gauche du symbole et représente le nombre de protons dans l’atome. Le nombre de masse, l’exposant en haut à gauche du symbole, est la somme du nombre de protons et de neutrons dans le noyau de cet isotope particulier. Dans ce cas, le numéro de masse est 12, ce qui signifie que le nombre de neutrons dans l’atome est 12 – 6 = 6 (c’est-à-dire que le numéro de masse de l’atome moins le nombre de protons dans le noyau est égal au nombre de neutrons). Parfois, le numéro atomique est omis dans cette notation parce que le symbole de l’élément lui-même transmet son numéro atomique caractéristique. Les deux isotopes de l’hydrogène, 2H et 3H, ont leur propre nom : deutérium (D) et tritium (T), respectivement. Une autre façon d’exprimer un isotope particulier est d’énumérer le numéro de masse après le nom de l’élément, comme le carbone-12 ou l’hydrogène-3.
La théorie atomique du 19e siècle présumait que les noyaux avaient des compositions fixes. Mais en 1896, le scientifique français Henri Becquerel a découvert qu’un composé d’uranium placé près d’une plaque photographique produisait une image sur la plaque, même si le composé était enveloppé dans un tissu noir. Il pensa que le composé d’uranium émettait une sorte de rayonnement qui traversait le tissu pour exposer la plaque photographique. D’autres recherches ont montré que le rayonnement était une combinaison de particules et de rayons électromagnétiques, dont la source ultime était le noyau atomique. Ces émanations ont finalement été appelées, collectivement, la radioactivité.
Il existe trois formes principales d’émissions radioactives. La première est appelée particule alpha,qui est symbolisée par la lettre grecque α.Une particule alpha est composée de deux protons et de deux neutrons, elle est donc identique à un noyau d’hélium. (On utilise souvent \(\ce{^{4}_{2}He}\) pour représenter une particule alpha). Elle a une charge de 2+. Lorsqu’un atome radioactif émet une particule alpha, le numéro atomique de l’atome d’origine diminue de deux (en raison de la perte de deux protons), et son nombre de masse diminue de quatre (en raison de la perte de quatre particules nucléaires). Nous pouvons représenter l’émission d’une particule alpha par une équation chimique. Par exemple, l’émission d’une particule alpha d’uranium 235 est la suivante :
\
Comment savons-nous que le produit de la réaction est \(\ce{^{231}_{90}Th}\) ? Nous utilisons la loi de conservation de la matière, qui dit que la matière ne peut pas être créée ou détruite. Cela signifie que nous devons avoir le même nombre de protons et de neutrons des deux côtés de l’équation chimique. Si notre noyau d’uranium perd 2 protons, il reste 90 protons, ce qui identifie l’élément comme étant du thorium. De plus, si nous perdons 4 particules nucléaires du 235 d’origine, il en reste 231. Ainsi, nous utilisons la soustraction pour identifier l’isotope de l’atome de thorium – dans ce cas, \(\ce{^{231}_{90}Th}\).
Les chimistes utilisent souvent les noms isotope parent et isotope fille pour représenter l’atome original et le produit autre que la particule alpha. Dans l’exemple précédent, \(\ce{^{235}_{92}U}\) est l’isotope parent, et \(\ce{^{231}_{90}Th}\) est l’isotope fille. Lorsqu’un élément se transforme en un autre de cette manière, il subit une désintégration radioactive.
Exemple : \(\PageIndex{1}\) : Radon-222
Écrire l’équation nucléaire qui représente la désintégration radioactive du radon-222 par émission de particules alpha et identifier l’isotope fille.
Solution
Le radon a un numéro atomique de 86, donc l’isotope parent est représenté par \(\ce{^{222}_{86}Rn}\). Nous représentons la particule alpha par \(\ce{^{4}_{2}He}\) et utilisons la soustraction (222 – 4 = 218 et 86 – 2 = 84) pour identifier l’isotope fille comme un isotope du polonium, \(\mathrm{^{218}_{84}Po}\) :
\N(\ce{_{86}^{222}Rn\rightarrow \, _2^4He + \, _{84}^{218}Po}\)
Exercice \(\PageIndex{1}\) : Polonium-209
Écrivez l’équation nucléaire qui représente la désintégration radioactive du polonium-209 par émission de particules alpha et identifiez l’isotope fille.
Réponse
\(\ce{_{84}^{209}Po\rightarrow \, _2^4He + \, _{82}^{205}Pb}\)
Le deuxième grand type d’émission radioactive est appelé particule bêta, symbolisée par la lettre grecque β. Une particule bêta est un électron éjecté du noyau (et non des coquilles d’électrons autour du noyau) et a une charge de 1-. On peut aussi représenter une particule bêta comme \(\ce{^0_{-1}e}\) ou β-. L’effet net de l’émission d’une particule bêta sur un noyau est qu’un neutron est converti en proton. Le nombre de masse global reste le même, mais comme le nombre de protons augmente d’une unité, le numéro atomique augmente d’une unité. Le carbone 14 se désintègre en émettant une particule bêta :
\
De nouveau, la somme des numéros atomiques est la même des deux côtés de l’équation, tout comme la somme des numéros de masse. (Notez que l’électron se voit attribuer un « numéro atomique » de 1-, égal à sa charge.)
Le troisième grand type d’émission radioactive n’est pas une particule mais plutôt une forme très énergétique de rayonnement électromagnétique appelé rayons gamma, symbolisé par la lettre grecque γ. Les rayons gamma eux-mêmes ne portent pas de charge électrique globale, mais ils peuvent faire tomber les électrons des atomes d’un échantillon de matière et le rendre électriquement chargé (pour lequel les rayons gamma sont appelés rayonnement ionisant). Par exemple, lors de la désintégration radioactive du radon 222, des rayonnements alpha et gamma sont émis, ces derniers ayant une énergie de 8,2 × 10-14 J par noyau désintégré :
\
Cela peut sembler peu d’énergie, mais si 1 mole d’atomes de radon se désintégrait, l’énergie du rayonnement gamma serait de 49 millions de kJ !
Exemple \(\PageIndex{2}\) : Bore-12
Écrivez l’équation nucléaire qui représente la désintégration radioactive du bore-12 par émission de particules bêta et identifiez l’isotope fille. Un rayon gamma est émis simultanément avec la particule bêta.
Solution
L’isotope parent est \(\ce{^{12}_{5}B}\) tandis qu’un des produits est un électron, \ce{^{0}_{\i1}-1}e}\). Pour que les numéros de masse et atomique aient la même valeur des deux côtés, le numéro de masse de l’isotope fille doit être 12, et son numéro atomique doit être 6. L’élément ayant un numéro atomique de 6 est le carbone. Ainsi, l’équation nucléaire complète est la suivante :
\
L’isotope fille est \(\ce{^{12}_6 C}\).
Exercice \(\PageIndex{2}\) : Iode-131
Écrivez l’équation nucléaire qui représente la désintégration radioactive de l’iode-131 par émission de particules bêta et identifiez l’isotope de filiation. Un rayon gamma est émis simultanément avec la particule bêta.
Réponse
\
Les émissions alpha, bêta et gamma ont des capacités différentes à pénétrer la matière. La particule alpha, relativement grosse, est facilement arrêtée par la matière (même si elle peut communiquer une quantité importante d’énergie à la matière qu’elle contacte). Les particules bêta pénètrent légèrement dans la matière, peut-être de quelques centimètres tout au plus. Les rayons gamma peuvent pénétrer profondément dans la matière et transmettre une grande quantité d’énergie à la matière environnante. Le tableau \(\PageIndex{1}\) résume les propriétés des trois principaux types d’émissions radioactives.
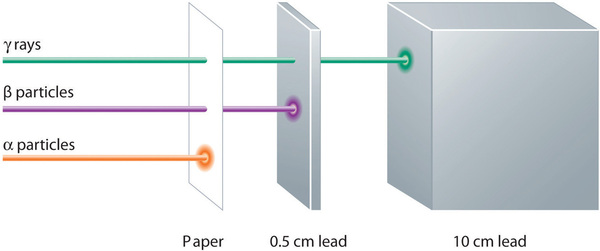
| Caractéristiques | Particules alpha | Particules bêta | Rayons gamma |
|---|---|---|---|
| symboles | α, \(\mathrm{_{2}^{4}He}\) | β, \(\ce{^{0}_{-1} e}\) | γ |
| identité | noyau d’hélium | électron | électromagnétique. électromagnétique |
| charge | 2+ | 1- | aucune |
| nombre de masse | 4 | 0 | 0 |
| pouvoir pénétrant | minimal (ne pénètre pas la peau) | court (pénètre légèrement la peau et certains tissus) | profond (pénètre profondément les tissus) |
Occasionnellement, un noyau atomique se brise en plus petits morceaux dans un processus radioactif appelé fission spontanée (ou fission). Généralement, les isotopes fils produits par la fission sont un mélange varié de produits, plutôt qu’un isotope spécifique comme dans le cas de l’émission de particules alpha et bêta. Souvent, la fission produit des neutrons en excès qui seront parfois capturés par d’autres noyaux, induisant éventuellement des événements radioactifs supplémentaires. L’uranium 235 subit une fission spontanée dans une faible mesure. Une réaction typique est
\
où \(\ce{_0^1n}\) est un neutron. Comme pour tout processus nucléaire, les sommes des numéros atomiques et des numéros de masse doivent être les mêmes des deux côtés de l’équation. La fission spontanée ne se produit que dans les gros noyaux. Le plus petit noyau qui présente une fission spontanée est le plomb-208.
La fission est le processus radioactif utilisé dans les centrales nucléaires et un type de bombe nucléaire.
Renseignements clés
Les principaux types de radioactivité comprennent les particules alpha, les particules bêta et les rayons gamma.
Exercice de révision des concepts
-
Quels sont les principaux types de radioactivité ? Ecrivez des équations chimiques démontrant chaque type.
Réponse
-
Les principaux types de radioactivité sont la désintégration alpha, la désintégration bêta et l’émission de rayons gamma ; la désintégration alpha avec émission gamma : \(\mathrm{_{86}^{222}Rn \rightarrow \, _{84}^{218}Po + \, ^4_2He + \gamma}\) ; désintégration bêta : \(\ce{_6^{14}C \rightarrow _7^{14}N + ^0_{-1}e}\) (les réponses peuvent varier)