Si je vous demande ce qui vous vient à l’esprit à l’instant où vous entendez le mot CHIMIE, je suis presque sûr que vous allez vous imaginer debout dans un laboratoire de chimie et tenant différents instruments de laboratoire. N’est-ce pas ? Mais si vous regardez attentivement le monde qui vous entoure, des réactions chimiques infinies se produisent à chaque instant. On peut donc dire à juste titre que la chimie fait partie intégrante de votre vie quotidienne. La chimie et les réactions chimiques ne se limitent pas seulement aux laboratoires, mais aussi au monde qui vous entoure. L’élément carbone constitue l’unité de base des composés organiques, inorganiques et organométalliques. Entre le moment où vous vous endormez et celui où vous vous réveillez, des processus chimiques infinis se déroulent dans chaque cellule de votre corps. Même les processus se produisent au réveil, toutes vos activités quotidiennes comme boire de l’eau, prendre une douche, cuisiner vos aliments, nettoyer votre voiture, rire ou pleurer sont guidées par différents processus chimiques. Discutons de quelques exemples de chimie qui se produisent autour de nous :
- 1. Composition du corps
- 2. La chimie des émotions
- 3. La chimie dans la production alimentaire
- 4. La chimie dans l’hygiène
- 5. La chimie d’un oignon
- 6. La chimie dans la cuisson
- 7. La chimie dans les conservateurs alimentaires
- 8. La chimie dans la digestion
- 9. Le fonctionnement d’une crème solaire
- 10. La chimie dans la formation de la rouille
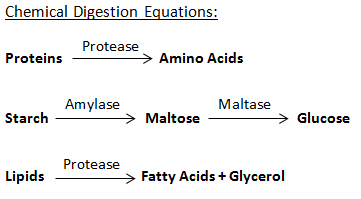
1. Composition du corps
Votre corps est un endroit fascinant. Le carbone et l’oxygène sont les deux éléments les plus essentiels du corps. Les autres éléments qui sont présents dans votre corps sont l’azote, le phosphore, l’hydrogène, l’oxygène, le calcium, le potassium, le soufre, le magnésium, etc.
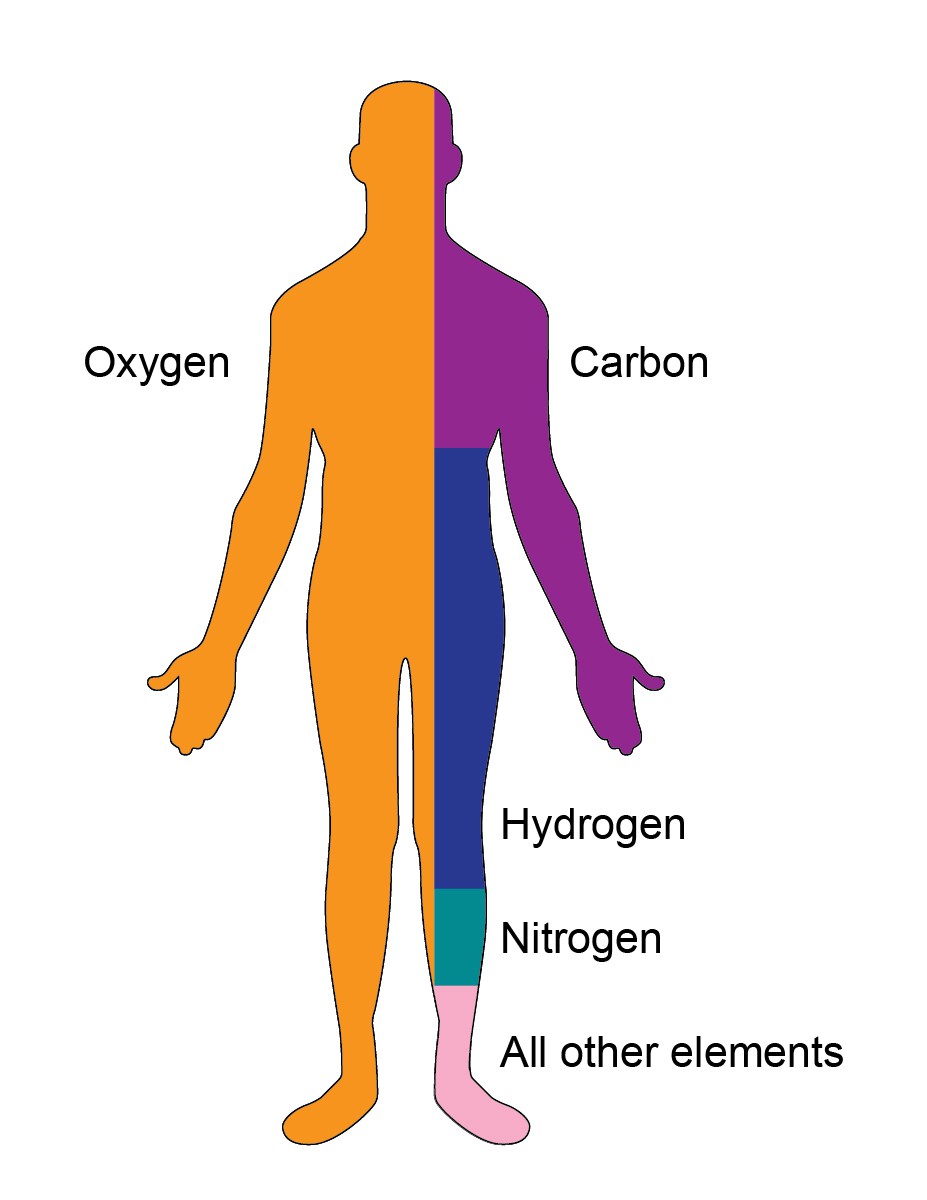
| ELEMENT | PERCENTAGE DANS LE CORPS | FONCTION |
|---|---|---|
| Oxygène. (O) | 65 | -Solvant primaire -Régulation de la température & pression osmotique |
| Carbone (C) | 18 | -Source d’énergie -Blocs de construction du corps |
| Hydrogène (H) | 10 | -Présent dans l’eau et toutes les molécules organiques. organiques |
| Azote (N) | 3 | -Fait partie des protéines et des acides nucléiques |
| Calcium (Ca) | 1.5 | -Critique pour la contraction musculaire |
| Phosphore (P) | 1.0 | -Agit comme un tampon -Fournit la force et la structure aux os et aux dents |
| Potassium (K) | 0.35 | -Electrolyte crucial -Aide à la transmission de l’influx nerveux -Régule le rythme cardiaque |
| Soufre (S) | 0.25 | -Redonne forme aux protéines qui aident au bon fonctionnement des protéines |
| Sodium (Na) | 0.15 | -Electrolyte important pour réguler la quantité d’eau -Aide à la signalisation nerveuse |
| Magnésium (Mg) | 0.05 | -Requiert dans plus de 300 réactions biochimiques -Constitue les muscles et les os -Chef cofacteur dans de nombreuses réactions enzymatiques |
| Fer (Fe) | 0.006 | -Aide à la production de sang |
| Cuivre (Cu), Zinc (Zn), Sélénium (Se), Molybdène (Mb), Fluor (F), Iode (I), Manganèse (Mn), Cobalt (Co) |
Total est inférieur à 0.70 | Le cuivre est un micronutriment pour la croissance et le développement, et également essentiel pour diverses fonctions métaboliques Le zinc joue un rôle important dans la croissance cellulaire, la division cellulaire, la cicatrisation des plaies, et la dégradation des glucides -Sélénium protège le corps des dommages oxydatifs -Molybdène élimine les toxines du métabolisme des acides aminés contenant du soufre -Fluor est responsable de la minéralisation et de la formation de l’émail des dents -Iode est essentiel pour la formation des hormones thyroïdiennes -Manganèse aide à la formation des tissus conjonctifs, des os, des facteurs de coagulation du sang, des hormones sexuelles en plus d’être critique dans le métabolisme des graisses et des glucides, l’absorption du calcium et la régulation de la glycémie |
| Lithium (Li), Strontium (Sr), Aluminium (Al), Silicium (Si), Plomb (Pb), Arsenic (As), Vanadium (V), Brome (Br) |
Présents à l’état de traces | -Le lithium est essentiel au maintien de la santé neurologique -Strontium aide à la formation des os et prévient leur perte ; la forme radioactive du strontium peut également tuer certaines cellules cancéreuses -Aluminium est responsable de la compaction de la chromatine -Silicium aide à promouvoir la fermeté et la force dans les artères, les tissus conjonctifs, les tendons, la peau et les yeux -Vanadium joue un rôle dans le métabolisme des enzymes |
2. La chimie des émotions

Lorsque vous vous sentez heureux, triste, extatique, détendu ou stressé, de nombreuses réactions chimiques ont lieu dans votre corps. C’est grâce aux messagers chimiques appelés neurotransmetteurs libérés dans le cerveau que vous pouvez tomber amoureux et pleurer des rivières à cause d’un chagrin d’amour. 
3. La chimie dans la production alimentaire
Les plantes produisent de la nourriture pour elles-mêmes par la photosynthèse ; ce qui est une réaction chimique complexe en soi. La réaction chimique qui a lieu dans la photosynthèse est la réaction chimique la plus commune et la plus vitale. Les animaux libèrent également de l’énergie pour effectuer leurs activités quotidiennes par des réactions chimiques respiratoires similaires.
6 CO2 + 6 H2O + lumière → C 6H12O6 + 6 O2

4. La chimie dans l’hygiène

5. La chimie d’un oignon


6. La chimie dans la cuisson


7. La chimie dans les conservateurs alimentaires


8. La chimie dans la digestion

9. Le fonctionnement d’une crème solaire


10. La chimie dans la formation de la rouille
Fe + O2 + H2O → Fe2O3. XH2O

.