De flesta medicinska behandlingar är utformade för den ”genomsnittliga patienten” som en ”one-size-fits-all”-metod, som kan vara framgångsrik för vissa patienter men inte för andra. Precisionsmedicin, som ibland kallas ”personaliserad medicin”, är ett innovativt tillvägagångssätt för att skräddarsy förebyggande och behandling av sjukdomar som tar hänsyn till skillnader i människors gener, miljöer och livsstil. Målet med precisionsmedicin är att rikta rätt behandlingar till rätt patienter vid rätt tidpunkt.
Framsteg inom precisionsmedicin har redan lett till kraftfulla nya upptäckter och FDA-godkända behandlingar som är skräddarsydda för specifika egenskaper hos individer, t.ex. en persons genetiska sammansättning eller den genetiska profilen hos en individs tumör. Patienter med olika cancerformer genomgår rutinmässigt molekylära tester som en del av patientvården, vilket gör det möjligt för läkare att välja behandlingar som förbättrar chanserna till överlevnad och minskar exponeringen för biverkningar.
- Nästa generationens sekvenseringstester (NGS)
- Den amerikanska läkemedelsmyndighetens roll för att främja precisionsmedicin
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Riktlinjer för kliniska databaser
- Analytical Validation Guidance
- FDA:s bioinformatikplattform
- Frågor?
- Vad FDA:s tjänstemän säger
- NGS Final Guidances
- Rapporter och diskussionsunderlag
- Past Meetings
Nästa generationens sekvenseringstester (NGS)
Precisionssjukvård kommer bara att vara lika bra som de tester som styr diagnos och behandling. NGS-tester (Next Generation Sequencing) kan snabbt identifiera eller ”sekvensera” stora delar av en persons arvsmassa och är viktiga framsteg i de kliniska tillämpningarna av precisionsmedicin.
Patienter, läkare och forskare kan använda dessa tester för att hitta genetiska varianter som hjälper dem att diagnostisera, behandla och förstå mer om mänskliga sjukdomar.
Den amerikanska läkemedelsmyndighetens roll för att främja precisionsmedicin
Den amerikanska läkemedelsmyndigheten FDA arbetar för att säkerställa noggrannheten hos NGS-testerna, så att patienter och kliniker kan få korrekta och kliniskt meningsfulla testresultat.
Den enorma mängden information som genereras med hjälp av NGS ställer FDA inför nya regleringsfrågor. Medan nuvarande regleringsmetoder är lämpliga för konventionell diagnostik som upptäcker en enda sjukdom eller ett enda tillstånd (t.ex. blodsocker- eller kolesterolnivåer), innehåller dessa nya sekvenseringstekniker motsvarande miljontals tester i ett. Därför har FDA samarbetat med intressenter inom industrin, laboratorier, den akademiska världen samt patient- och yrkessammanslutningar för att utveckla ett flexibelt regelverk för att tillgodose denna snabbt utvecklande teknik, som utnyttjar konsensusstandarder, data från allmänheten och den senaste datortekniken med öppen källkod för att stödja utvecklingen av NGS-tester. Detta tillvägagångssätt kommer att möjliggöra innovation inom testning och forskning och kommer att påskynda tillgången till exakta och tillförlitliga gentester.
Streamlining FDA’s Regulatory Oversight of NGS Tests
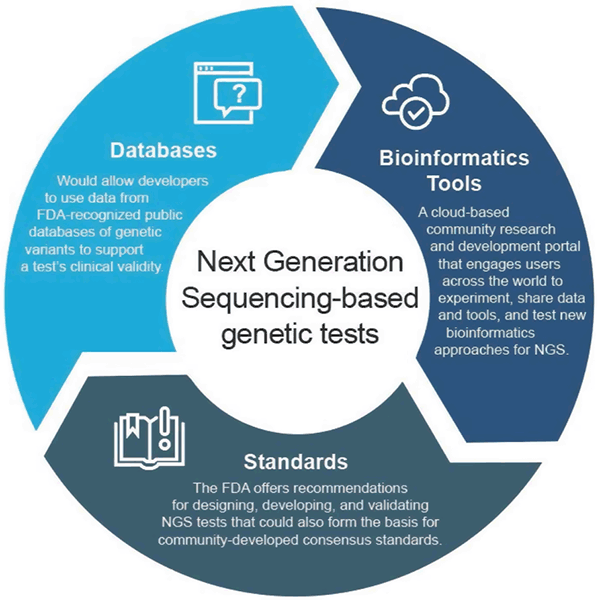
I april 2018 utfärdade FDA två slutgiltiga riktlinjer som rekommenderar tillvägagångssätt för att effektivisera inlämnandet och granskningen av data som stödjer den kliniska och analytiska giltigheten av NGS-baserade tester. Rekommendationerna är avsedda att ge ett effektivt och flexibelt tillvägagångssätt för tillsyn: i takt med att tekniken utvecklas kan standarderna snabbt utvecklas och användas för att fastställa lämpliga mått för snabbt växande områden som NGS. På samma sätt kan nya påståenden stödjas i takt med att de kliniska bevisen förbättras. Detta adaptiva tillvägagångssätt skulle i slutändan främja innovation bland testutvecklare och förbättra patienternas tillgång till dessa nya tekniker.
Riktlinjer för kliniska databaser
Den slutliga vägledningen ”Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” gör det möjligt för utvecklare att använda data från FDA-erkända offentliga databaser för genetiska varianter för att hjälpa till att stödja ett tests kliniska giltighet, och beskriver hur databasadministratörer kan söka erkännande för sina databaser om de uppfyller vissa kvalitetsrekommendationer. Detta tillvägagångssätt stimulerar datadelning och ger en effektivare väg till marknaden.
Mer information om erkännande av databaser finns på FDA:s webbsida Recognition of Public Human Genetic Variants Databases (erkännande av offentliga databaser för mänskliga genetiska varianter).
Analytical Validation Guidance
Den slutliga vägledningen ”Considerations for Design, Utveckling, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases” innehåller rekommendationer för utformning, utveckling och validering av NGS-tester. Vägledningen uppmuntrar också till att organisationer som utvecklar standarder (SDO) engagerar sig i utvecklingen av NGS-relaterade standarder, eftersom standarder snabbare kan utvecklas i takt med teknik- och kunskapsförändringar och därför kan användas för att fastställa lämpliga mått, t.ex. specifika prestandatrösklar, för områden som växer snabbt, t.ex. NGS.
FDA:s bioinformatikplattform
FDA skapade precisionFDA, en molnbaserad gemenskapsbaserad forsknings- och utvecklingsportal som engagerar användare över hela världen för att dela data och verktyg för att testa, pilotera och validera befintliga och nya bioinformatiska metoder för NGS-bearbetning. Individer och organisationer inom genomikgemenskapen kan hitta mer information och registrera sig för att delta på http://precision.fda.gov.
Frågor?
Vänligen kontakta oss med frågor om FDA:s insatser för precisionsmedicin på [email protected].
Vad FDA:s tjänstemän säger
- FDA slutför riktlinjer för att påskynda utvecklingen av tillförlitliga, fördelaktiga test baserade på nästa generations sekvensering
NGS Final Guidances
- Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 444KB)
- Considerations for Design, Development, och analytisk validering av nästa generations sekvensering (NGS) -baserade in vitro-diagnostik (IVD) som är avsedd att hjälpa till vid diagnos av misstänkta sjukdomar i arvsmassan – Vägledning för intressenter och personal vid livsmedels- och läkemedelsmyndigheten (PDF – 1,5 km). 869KB)
Rapporter och diskussionsunderlag
- Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests (PDF – 424KB)
- Rapport: Paving the Way for Personalized Medicine (Archived)
Past Meetings
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Konsekvenser för patienter och vårdgivare
- 07/27/16: Webinar – Utkast till riktlinjer för nästa generations sekvensering (NGS): Tekniska och rättsliga aspekter
- 13/11/2015: Offentligt seminarium – Användning av databaser för att fastställa den kliniska relevansen av humangenetiska varianter
- 11/12/2015: Standardbaserat tillvägagångssätt för utvärdering av den analytiska prestandan för nästa generations sekvensering av in vitro-diagnostiska tester
- 20.02.2015: Optimering av FDA:s tillsyn av diagnostiska test med nästa generations sekvensering Offentlig workshop