Av de mänskliga Neisseria- och besläktade arterna reducerar tre arter – N. mucosa, M. catarrhalis och K. denitrificans – nitrat. Nitratreduktionstestet är ett kritiskt test för att skilja mellan N. gonorrhoeae och K. denitrificans, särskilt när stammar av K. denitrificans verkar vara gramnegativa diplocker i färgade utstryk.
Princip
Bakteriearter kan särskiljas på grundval av deras förmåga att reducera nitrat till nitrit eller kvävehaltiga gaser. Bland Neisseriaceae av mänskligt ursprung reducerar stammar av Neisseria mucosa, Moraxella catarrhalis och Kingella denitrificans nitrat. Stammar av M. catarrhalis och K. denitrificans har felaktigt identifierats som N. gonorrhoeae. Nitratreduktionstestet gör det möjligt att skilja mellan dessa arter som är nitratpositiva och N. gonorrhoeae (nitratnegativ). Reduktionen av nitrat kan vara kopplad till anaerob respiration hos vissa arter.
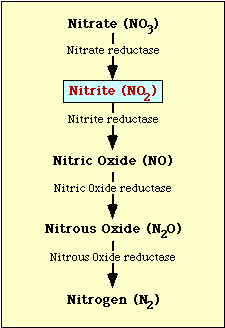
Den biokemiska vägen som är involverad i nitratreduktionen visas i figur 1. Nitrat reduceras till nitrit som sedan kan reduceras till kväveoxid, lustgas eller kväve (figur 1).
Figur l. Nitratreduktionsvägen.
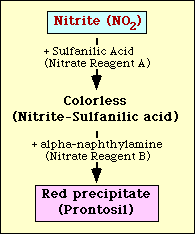
Nitratreduktionstestet baseras på detektion av nitrit i mediet efter inkubation med en organism. Om det finns i mediet kommer nitrit att reagera med sulfanilsyra (nitratreagens A) för att bilda ett färglöst komplex (nitrit-sulfanilsyra). Detta komplex ger sedan en röd utfällning (prontosil) när nitratreagens B (alfa-naftylamin) tillsätts till testet enligt figur 2.
Figur 2. Schematisk framställning av detektion av nitrit i medium.
En röd färg kommer att produceras i mediet endast när det finns nitrit i mediet. Avsaknad av röd färg i mediet efter tillsats av sulfanilsyra och alfa-naftylamin innebär endast att nitrit inte finns i mediet. Det kan finnas två förklaringar till denna observation.
- Nitratet kan inte ha reducerats; stammen är nitratnegativ.
Nitratet kan ha reducerats till nitrit som sedan har reducerats fullständigt till kväveoxid, lustgas eller kväve som inte reagerar med de reagenser som reagerar med nitrit; stammen är nitratpositiv.
Ett testmedium som ger ett negativt resultat efter tillsats av nitratreagenserna måste testas ytterligare för att avgöra vilken av de två tolkningarna som är korrekt.
Ett lyckat nitratreduktionstest är beroende av att testet utförs under korrekta förhållanden.
- Reaktionen kommer att ske bäst om basmediet stödjer organismens tillväxt. Även om vissa Neisseria-arter inte växer bra i buljongmedium kan nitratreduktionstestet dock utföras framgångsrikt i ett medium som inte stöder tillväxt genom att man inokulerar mediet kraftigt för att ge tillräckligt med förbildat enzym för att reaktionen ska kunna inträffa.
Nitratreaktionen inträffar endast under anaeroba förhållanden. Det nitratinnehållande mediet doseras i rör för att ge ett lågt förhållande mellan yta och djup som begränsar diffusionen av syre in i mediet, t.ex. 5 ml av mediet doseras i ett rör med en diameter på 13 mm. Neisseria och besläktade arter använder syret i mediet och skapar snabbt anaeroba förhållanden som är idealiska för att reducera nitrat.
Nitratreduktionstestet utförs i ett medium som innehåller 0,2 % kaliumnitrat. Mediet inokuleras kraftigt med en renkultur av den misstänkta organismen och inkuberas vid 35C till 36,5C i 48 timmar i en inkubator med eller utan tillägg av koldioxid.
Nitratreduktion påvisas med Griess Llosvay-reagenserna, sulfanilsyra och alfa-naftylamin. Sulfanilsyra (nitratreagens A) tillsätts till inkubationsblandningen och bildar ett komplex (nitrit-sulfanilsyra) med eventuell nitrit som finns i mediet. När alfa-naftylamin (nitratreagens B) tillsätts till det inkuberade mediet bildas en röd utfällning (prontosil) med eventuella nitrit-sulfankilyssyrakomplex som finns i mediet.
En organism kan rapporteras som nitratpositiv om en röd färg utvecklas i mediet efter att nitratreagens A och B har tillsatts till mediet, vilket indikerar att organismen har reducerat nitrat till nitrit.
Avvikelse av röd färg efter tillsats av båda reagenserna innebär inte automatiskt att organismen inte kan reducera nitrat. Stammar kan ha reducerat nitratet till nitrit och sedan reducerat nitritet helt och hållet till kvävegaser som inte upptäcks när nitratreagenserna A och B tillsätts till mediet. Om mediet inte ändrar färg efter tillsats av sulfanilsyra och alfa-naftylamin, tillsätts en liten mängd (”knivspets”) zinkdamm till det inkuberade mediet. Zinkstoftet kommer att katalysera den kemiska reduktionen av nitrat till nitrit. Om nitratet inte har reducerats av organismerna, dvs. om de är nitratnegativa, kommer det att reduceras av zinkstoftet och en röd färg kommer att utvecklas i det inkuberade mediet inom 15 minuter. Om ingen färg utvecklas i det inkuberade mediet efter tillsats av zinkdamm har organismerna inte bara reducerat nitrat till nitrit utan också reducerat nitrit till kvävegaser; dessa organismer är också nitratpositiva.
Trots att nitratmedium levereras med inverterade Durham-rör för att detektera gasproduktion, registreras inte gasproduktion för Neisseria-arter. Även om vissa arter kan reducera nitrat bortom nitrit till kvävehaltiga gaser, kan gas inte ackumuleras i röret. Gasansamlingen är beroende av hur snabbt den produceras. När gasen produceras mycket långsamt kan den lösas upp i mediet och inte ackumuleras i Durham-röret.
Krav på prover
Optimalt prov: En ren kultur av en misstänkt gramnegativ, oxidaspositiv diplocka (Neisseria spp. eller M. catarrhalis) på chokladagar som inkuberats i en koldioxidberikad atmosfär vid 35C till 36,5C i 18 till 24 timmar.
Oacceptabelt prov: Kulturen av isolat på chokladagar som inkuberats i en koldioxidberikad atmosfär vid 35C till 36,5C i mer än 24 timmar.
Komprometterande faktorer som påverkar testresultaten:
- Testmediet måste vara tillräckligt kraftigt inokulerat för att möjliggöra att reaktion med förbildade enzymer kan ske. Otillräckligt inokulum kanske inte tillåter organismerna att förbruka syre för att skapa anaeroba förhållanden där nitratreduktion kan ske.
För mycket zinkdamm som tillsätts i det inkuberade röret kan resultera i en mycket snabb reduktion av nitrat bortom nitrit till kvävehaltiga gaser, så att nitrit inte kan påvisas.
Provets stabilitet: Detektion av nitratreduktion för Neisseria och besläktade arter är beroende av närvaron av förbildade enzymer.
- Testerna bör endast utföras med inokulum som skördats från 24 timmars kulturer.
- Nitratmedium bör inokuleras inom 30 minuter efter det att kulturen avlägsnats från inkubatorn; långvarig exponering av kulturen vid rumstemperatur kan resultera i minskad enzymaktivitet.
Medium/Reagens
Medium: Nitratbuljong (Hjärtinfusionsbuljong innehållande 0,2 % kaliumnitrat)
Härtinfusionsbuljong (Difco), 25,0 g
Kaliumnitrat, 2,0 g
Destillerat vatten, 1000,0 ml
- Destillera ingredienserna i destillerat vatten; justera lösningen till pH 7.0.
- Dosera 5 ml alikvot av buljongen i 16 mm x 100-mm-rör med gasinsatser (Durham-rör, 6-mm x 50-mm).
Autoklavera i 15 min vid 121C.
Lagra mediet vid 4C till 10C (kylt) tills det används. Värm mediet till rumstemperatur före inokulering.
Reagens: Sulfanilsyrelösning (Nitratreagens A): 0,8 % i 5N ättiksyra
Kemiskt namn:
Sulfanilsyrelösning (Nitratreagens A): 0,8 % i 5N ättiksyra: Förvara nitratreagens A vid 15-30 °C (rumstemperatur) i upp till 3 månader i mörker. Reagenserna kan förvaras i mörkbruna glasbehållare; flaskorna kan lindas in i aluminiumfolie för att säkerställa mörker.
Alpha-naftylaminlösning (nitratreagens B): 0,6 % i 5N ättiksyra
Kemiskt namn: N,N-dimetyl-1 naftylamin
Lagra nitratreagens B vid 2-8 °C (i kylskåp) i upp till 3 månader i mörker. Reagenserna kan förvaras i mörkbruna glasbehållare; flaskorna kan lindas in i aluminiumfolie för att säkerställa mörker.
Zinkpulver, reagenskvalitet: Förvaras i rumstemperatur (15C till 30C)
Varning: Ättiksyra är frätande. Kontakt med huden kan orsaka blåsor och brännskador. Vid kontakt, spola ögon och hud omedelbart med rikligt med vatten (i minst 15 min.)
Kvalitetskontroll/Testförfarande
QC-stammar:
- Nitratreduktas-positiv kontroll: Kingella denitrificans, CDC 10 236
Nitratreduktas-negativ kontroll: Neisseria gonorrhoeae, ATCC 43069
QC-stammar förvaras vid -70C i en lösning av tryptisk sojabuljong innehållande 20 % glycerol. Kontrollstammarnas reaktioner bör bekräftas vid den tidpunkt då de frysta lagren förbereds. QC-stammar kan förvaras vid -70C i upp till 2 år.
Förfarande:
QC-stammar testas på samma sätt som kliniska isolat. QC-stammar ska subkultureras minst en gång efter den första odlingen från det frysta provet innan testet utförs. Kliniska isolat kan subkultureras från selektivt medium eller renade subkulturer. Se till att odlingarna är rena.
- Thaw flaskor med kontrollstammar som förvarats vid -70C.
- Sträck upp på plattor av chokladagar eller kompletterad GC-agar för isolering. Inkubera vid 35C till 36,5C i en koldioxidberikad atmosfär i 18 till 24 timmar.
- Inkubera inokulerade medier och ett oinokulerat kontrollmedium i ett rör med kontrollmedium vid 35C till 36,5 C i en koldioxidberikad atmosfär i 48 timmar.
-
Efter 48 timmars inkubation tillsätt med Pasteurpipetter 5 droppar av Reagens #A, följt av 5 droppar av Reagens #B till varje rör. Skaka röret väl för att blanda reagenserna med mediet.
Undersök suspensionen för att se om den har en rosa-röd färg som bör utvecklas inom några minuter om mediet fortfarande är varmt. Reaktionen kan ta lite längre tid om mediet är kallt när reagenserna tillsätts.
Om suspensionen blir rosaröd innan Zn-pulvret tillsätts är reaktionen positiv och testet är slutfört. Utför inte steg 4.
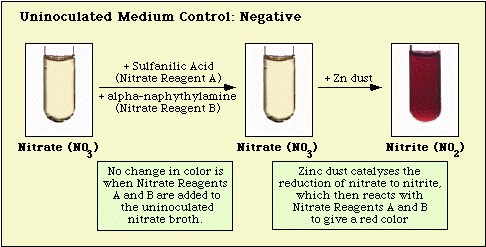
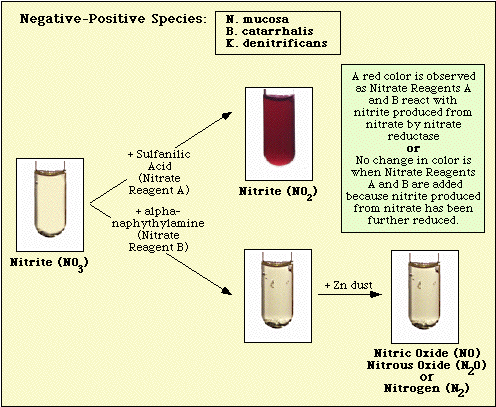
Reaktioner som observerats med den oinokulerade mediekontrollen samt nitratnegativa och nitratpositiva isolat illustreras i figur 3, figur 4 respektive figur 5.
-
Om suspensionen är färglös efter tillsats av reagenserna A och B, tillsätt en liten mängd (4 till 5 mg; ”vass knivspets”) zinkpulver till mediet. Skaka röret kraftigt och låt det stå i rumstemperatur i 10-15 min.
Om mediet förblir färglöst efter tillsats av Zn-pulver är testresultatet positivt.
Om mediet blir rosa efter tillsats av Zn-pulver är resultatet negativt.
Med en steril svabb, förbered en tung suspension av välisolerade kolonier från en renkultur av isolatet som inkuberats på chokladmedium vid 35C till 36C.5 C i en koldioxidberikad atmosfär i 18 till 24 timmar. Inokulera testmediet för att ge kraftig turbiditet.
Anmärkning: Stammar av N. gonorrhoeae och vissa andra Neisseria spp. kan inte växa i detta medium. Reaktionen kan således vara beroende av förbildat enzym.
Avläs och anteckna resultaten.
Figur 3. Reaktioner som observerats med oinokulerat nitratmedium.
Figur 4. Reaktion observerad med nitratnegativa arter.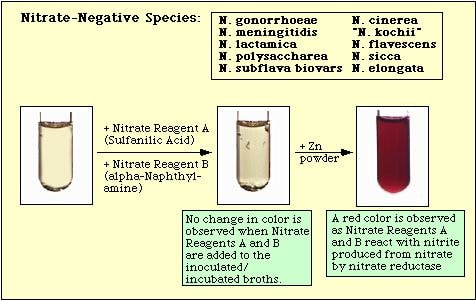
Figur 5. Reaktioner som observerats med nitratpositiva arter.
Skema för kvalitetskontroll:
- Ett QC-test för nitratreduktas utförs varje dag som kliniska isolat testas.
Problem & Lösningar
Nitratreduktionstestet kan ge falskt negativa eller falskt positiva resultat om mediet inte framställs på rätt sätt eller om testet inte utförs på rätt sätt. Reaktionen i detta test är beroende av ett antal faktorer.
- Om det inte går att upptäcka rosa färg i kontrollröret med oinokulerat medium efter tillsats av Zn-damm kan det bero på 1) att mediet inte innehåller nitrat eller 2) att för mycket zinkdamm har tillsatts, vilket har katalyserat reduktionen av nitrat bortom nitrit till kvävehaltiga gaser. Den enklaste lösningen är att skaffa mer nitratmedium och se till att nitrat har tillsatts till basmediet. Alternativt kan man inokulera mediet med en positiv kontrollstam, men testa för en reaktion efter en kortare inkubationstid; stammar av N. mucosa ger en positiv nitritreaktion efter några timmars inkubation. Om det bekräftas att mediet innehåller nitrat, upprepa testet tills du har bestämt rätt mängd zinkdamm att tillsätta. Det är viktigt att lära sig hur mycket zinkdamm som ska tillsättas i testet. Tillsats av för mycket zinkdamm kan resultera i ett falskt positivt resultat.
- När Reagens A tillsätts till testmediet kommer nitrit som produceras som ett resultat av reduktionen av nitrat att bilda ett komplex med sulfanilsyran som ger ett rött utfällningsprov tillsammans med alfa-naftylaminet i Reagens B. Förekomsten av en röd färg i testmediet indikerar att det finns nitrit som ett resultat av reduktionen av nitrat. Avsaknad av röd färg efter tillsats av reagens A och B betyder dock inte nödvändigtvis att nitratet inte reducerats. Om ingen röd färg utvecklas kan det betyda 1) att nitratet inte reducerades eller 2) att nitriten, som bildas som ett resultat av reduktionen av nitratet, i sig själv har reducerats till kvävehaltiga gaser. För att avgöra om nitriten har reducerats, lägg en liten mängd zinkstoft i inkubationsblandningen om den är färglös efter tillsats av reagens A och B. Zinkstoftet katalyserar reduktionen av nitrat till nitrit; en röd färg bör utvecklas i det medium som fortfarande innehåller oreducerat nitrat. Det är dock viktigt att inte tillsätta för mycket zinkdamm; överskott av zinkdamm kommer att katalysera reduktionen av nitrit som produceras från detta nitrat, vilket resulterar i ett färglöst medium och en felaktig tolkning av testet som positivt (ett falskt positivt resultat).
Om en rosa färg upptäcks i den oinokulerade mediekontrollen efter att nitratreagenserna A och B har tillsatts till mediet, är mediet kontaminerat med nitrit. Den enda lösningen är att skaffa ett nytt parti medium som inte är förorenat med nitrit. I medium som innehåller nitrat skulle misslyckandet för den positiva kontrollstammen Kingella denitrificans att ge en positiv reaktion endast inträffa om stammen inte är K. denitrificans. Kontrollera återigen identiteten hos den positiva kontrollstammen. Välj en ny kultur av kontrollstammen och upprepa testet. På samma sätt, om ett positivt nitratreduktas-test erhålls med den negativa kontrollstammen, N. gonorrhoeae, är antingen den negativa kontrollstammen inte N. gonorrhoeae eller så är kulturen kontaminerad med en nitratpositiv organism. Kontrollera återigen renheten och identiteten hos gonokockreferensstammen. Upprepa testet med en ren kultur av en bekräftad kultur av N. gonorrhoeae. Nitatreduktionsreaktionen indikerar organismernas förmåga att reducera nitrat, en reaktion som endast inträffar under anaeroba förhållanden; reaktionen kommer inte att inträffa om organismerna får kontinuerlig tillförsel av syre. Reaktionen kan således inte uppstå i stilla kulturer (särskilt av långsamväxande arter) där mediet är fördelat i grunda skikt som tillåter syre att diffundera in i mediet. Ett test för att avgöra om det finns syre i mediet kan göras genom att tillsätta en droppe oxidasreagens till mediet. Om mediet blir lila innehåller mediet syre och nitratreduktionsreaktionen kan inte ske. Om mediet förblir färglöst innehåller mediet inte syre och nitratreduktionsreaktionen kan ske. Det har noterats att N. gonorrhoeae-cellerna förbrukar syret snabbt om tillräckligt många celler inokuleras i mediet. Om oxidasreagens tillsätts efter cirka 1-2 timmars inkubation kommer mediet att förbli klart. Eftersom oxidasreagenset dödar de gonokocker som finns i mediet kommer mediet gradvis att bli lila, med början i toppen av röret, när syret diffunderar in i mediet. Om mediet distribueras i rör med andra dimensioner än de som föreslås ovan, se till att förhållandet mellan yta och djup är minst lika stort som eller mindre än de som föreslås ovan. Om diametern på det rör i vilket mediet distribueras är större än den som beskrivs ovan, använd en större volym medium för att bibehålla samma förhållande mellan yta och djup.
Nitratreduktionsreaktionen kanske inte inträffar om det medium i vilket testet utförs inte tillåter normal tillväxt av organismen. Testet kan dock utföras i ett medium som inte stödjer organismens tillväxt om inokulumet är tillräckligt tätt att förbildade enzymer kan uttömma den befintliga syretillgången och reducera nitratet i en snabbare takt än den som syret diffunderar in i mediet.
Anmärkning: För att kontrollera att syret har avlägsnats från mediet, tillsätt 2 till 3 droppar oxidasreagens till en dubblett av det inokulerade mediet. Om syret har avlägsnats tillräckligt från mediet kommer oxidasreagenset inte att bli lila omedelbart. Om mediet innehåller löst syre kommer oxidasreagenset att bli lila. Observera också att nitratreduktionstestet kan utföras i medium till vilket oxidasreagenset har tillsatts.
Ett positivt nitratreduktas-test som erhålls med den negativa kontrollstammen, N. gonorrhoeae, efter tillsats av zinkdamm indikerar att nitratet har reducerats till mer än nitrit, vilket troligen beror på tillsats av för mycket zinkdamm i testet. Upprepa testet och se till att tillsätta mycket lite zinkdamm. Den rosa färgen, som visar att organismen inte har reducerat nitratet, kan ta 10-15 minuter att utvecklas. Tillsätt inte mer zinkdamm! Vänta tills färgen utvecklas. Om ingen färg har utvecklats efter 30 min tolkar du testet som positivt.
Begränsningar av testet
Om testet utförs på rätt sätt och kvalitetskontrollstammarna ger lämpliga resultat bör det inte finnas några begränsningar för detta test. Försiktighet måste iakttas för att säkerställa att alla komponenter i testet utförs korrekt .
Ingen identifiering av släkte eller art kan göras enbart på grundval av nitratreduktionstestet.
Resultat, tolkning och rapportering
Isolat kan rapporteras som nitratpositivt om nitrit (rosa färg) påvisas i det inokulerade mediet efter tillsats av reagenserna A och B eller om ingen färg påvisas i mediet efter tillsats av zinkdamm.
Isolat kan rapporteras som nitratnegativt om nitrit inte påvisas (ingen färgförändring) efter tillsats av reagens A och B, eller om en rosa färg utvecklas efter tillsats av zinkdamm i det inokulerade mediet.
Bibliografi
Knapp JS, Clark VL. Anaerob tillväxt av Neisseria gonorrhoeae kopplad till nitritreduktion. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. En guide för identifiering av bakteriesläktena. The Williams & Wilkins Co., Baltimore, MD.