Mekaniska komplikationer av akut hjärtinfarkt (AMI) är ventrikelseptumdefekt (VSD), papillarmuskelruptur eller dysfunktion, ruptur av den fria väggen i hjärtat, ventrikelaneurysm, dynamisk obstruktion av vänster kammares utflödeskanal (OT) och högerkammarsvikt (RV). Alla dessa tillstånd kan potentiellt leda till LV-svikt med kardiogen chock.
En grundlig förståelse av de mekaniska komplikationerna vid AMI och deras riskfaktorer kan hjälpa kliniker att ställa en tidig diagnos. För gynnsamma patientutfall krävs snabb diagnos med lämplig medicinsk behandling och kirurgiskt ingrepp i rätt tid. Viktiga faktorer för dödlighet på sjukhus till följd av mekaniska komplikationer av MI är bland annat hög ålder, kardiogen chock och kardiorespiratorisk svikt.
Ventrikulär friväggsruptur
VFWR är den allvarligaste komplikationen vid AMI. VFWR är vanligtvis förknippad med stora transmurala infarkter och antecedent infarktexpansion. Det är den vanligaste dödsorsaken, näst efter LV-svikt, och står för 15-30 % av dödsfallen i samband med AMI. VFWR är den mest katastrofala mekaniska komplikationen och leder till akut hemoperikardium och död på grund av hjärttamponad.
Den totala incidensen av VFWR varierar mellan 0,8-6,2 %. Incidensen av denna komplikation har minskat under åren med bättre kontroll av det systoliska blodtrycket under 24 timmar, ökad användning av reperfusionsbehandling, betablockerare och ACE-hämmare samt minskad användning av heparin .
Data från National Registry of Myocardial Infarction (NRMI) visade på en förhöjd incidens av mortalitet på sjukhus bland patienter som fick trombolysbehandling (12,1 %) jämfört med patienter som inte fick det (6,1 %). I TIMI II-studien (Thrombolysis in Myocardial Infarction Phase II) dog 16 % av patienterna av hjärtruptur inom 18 timmar efter behandlingen. Patienter som genomgick perkutan transluminal koronarangioplastik (PTCA) hade en lägre incidens av friväggsruptur än patienter som fick trombolysbehandling.
Riskfaktorer för VFWR är bland annat hög ålder över 70 år, kvinnligt kön, inga tidigare MI, Q-vågor på EKG, högt blodtryck under den initiala fasen av STEMI, kortikosteroid- eller NSAID-användning och fibrinolytisk behandling mer än 14 timmar efter STEMI-debut. Patienter med angina pectoris i anamnesen, tidigare AMI, kranskärlssjukdom med flera kärl och kronisk hjärtsvikt är mindre benägna än andra att utveckla VFWR i LV eftersom de utvecklar kollateraler och ischemisk prekonditionering.
Klinisk presentation av VFWR
VFWR är dramatiska; de uppträder akut eller ibland subakut som pseudoaneurysm; och de involverar oftast LV:s främre eller laterala vägg. De flesta VFWR uppstår inom den första veckan efter AMI.
Becker et al klassificerade följande 3 typer av VFWRs :
-
Typ I – en plötslig slitsliknande reva som ofta är förknippad med främre infarkter och som uppträder tidigt (inom 24 timmar)
-
Typ II – en reva som är plötsligt uppkommen. en erosion av infarktmyokardiet vid gränsen mellan infarkt och livskraftigt myokard
-
Typ III – en tidig aneurysmbildning som korrelerar med äldre och kraftigt expanderade infarkter
Typ III uppträder vanligen senare än rupturer av typ I eller typ II. Trombolytisk behandling påskyndar förekomsten av hjärtruptur i Becker typ I och typ II VFWR. Vid kraftigt expanderade infarkter (typ III) minskar trombolytisk behandling förekomsten av hjärtruptur.
Ett pseudoaneurysm bildas när intilliggande perikard och hematom förseglar en myokardisk ruptur eller perforation. Väggen i ett pseudoaneurysm visualiseras oftast som en aneurysmisk utbuktning som kommunicerar med LV-hålan med hjälp av en smal hals. Denna vägg består av perikard och organiserad trombus och/eller hematom. Den saknar myokardiella element, medan ett äkta aneurysm har alla element från den ursprungliga myokardiella väggen och en relativt bred bas. Pseudoaneurysmet kan variera i storlek och löper stor risk att rupturera.
Kliniska presentationer av VFWR varierar beroende på rupturens skärpa, läge och storlek. Patienter med akut VFWR uppvisar svår bröstsmärta, plötslig elektromekanisk dissociation eller asystoli, hemodynamisk kollaps och eventuellt död. Hos ungefär en tredjedel av patienterna är förloppet subakut, och de presenterar symtom som synkope, hypotoni, chock, arytmi och långvarig och återkommande bröstsmärta.
Diagnos av VFWR
Främtidig diagnos av VFWR och ingripande är avgörande för patientens överlevnad. Ett högt index av misstankar krävs när patienter med AMI presenterar sig med svår bröstsmärta, chock eller arytmier och plötslig utveckling av elektromekanisk dissociation. EKG-tecken på hotande VFWR har begränsad specificitet men inkluderar sinustakykardi, intraventrikulär ledningsdefekt och persisterande eller återkommande ST-segmenthöjning.
Ekokardiografi är det diagnostiska verktyget att föredra. Det viktigaste diagnostiska fyndet är en måttlig till stor perikardutgjutning med kliniska och ekokardiografiska tecken på hotande perikardtamponad. Hos patienter med hjärttamponad och elektromekanisk dissociation ökar måttlig till svår perikardutgjutning mortalitetsrisken. De patienter som inte har någon initial hjärttamponad, även om de har en lägre dödlighet, bör ändå följas upp, eftersom en sen ruptur fortfarande kan inträffa. Avsaknad av perikardutgjutning på ekokardiografi har ett högt negativt prediktivt värde. Om möjligheten att erhålla transtorakala ekokardiogram är begränsad hos patienter som får mekanisk ventilation kan transesofageal ekokardiografi hjälpa till att bekräfta VFWR.
MRI ger överlägsen bildkvalitet och möjliggör identifiering av platsen för och anatomin hos ett ventrikulärt pseudoaneurysm (dvs. rupturerat LV som hålls tillbaka av perikardiet med innesluten blodpropp). MRT är dock av begränsad nytta i den akuta situationen på grund av den tid det tar och att bildgivningsenheterna inte kan transporteras.
Behandling av VFWR
Den viktigaste preventionsstrategin är tidig reperfusionsbehandling, där perkutan koronarintervention (PCI) är den föredragna modaliteten. Fibrinolytisk behandling är förknippad med en allmänt minskad risk för VFWR; dess användning mer än 14 timmar efter STEMI-debut kan dock öka risken för tidig ruptur.
Standardbehandlingen för VFWR är akut kirurgisk reparation efter att hemodynamisk stabilitet har uppnåtts. Patienterna kan först behöva intravenösa vätskor, inotropa medel och akut perikardiocentesis.
Pifarré och medarbetare rekommenderade användning av en intra-aortisk ballongpump för att minska den systoliska efterbelastningen och förbättra den diastoliska myokardperfusionen.
Flera kirurgiska tekniker har tillämpats, inklusive infarktomi, vidhäftning med biologiska limplåster av polyetentereftalatpolyesterfiber (Dacron; DuPont, Wilmington, DE) eller polytetrafluoretenfluorpolymerharts (Teflon; DuPont) samt användning av pledgeted suturer utan infarktomi.
Mortaliteten är betydligt hög och beror till stor del på patientens preoperativa hemodynamiska status. Tidig diagnos, snabbt införande av de åtgärder som beskrivs ovan för att uppnå hemodynamisk stabilitet och snabb kirurgisk reparation kan förbättra överlevnaden. En uppföljning av den randomiserade Acorn-studien visade på en långsiktig förbättring av vänsterkammarens struktur och funktion efter mitralisklaffkirurgi i så lång tid som 5 år. Dessa data ger bevis som stöder mitralisklaffreparation i kombination med Acorn CorCap-enheten för patienter med icke-ischemisk hjärtsvikt med allvarlig vänsterkammardysfunktion som har optimerats medicinskt men som fortfarande har symtom med betydande mitralisk regurgitation.
Ventrikulär septumruptur
VSR är en sällsynt men livshotande komplikation till AMI. Trots optimal medicinsk och kirurgisk behandling har patienter med VSR en hög dödlighet på sjukhus. Under den förtrombolytiska eran förekom VSR hos 1-3 % av individerna med MI. Incidensen minskade med trombolysbehandling (till 0,2-0,34 %) på grund av förbättringar i reperfusion och myokardräddning. Den bimodala fördelningen av VSR kännetecknas av en hög incidens under de första 24 timmarna, med en annan topp dag 3-5 och sällan mer än 2 veckor efter AMI.
I patienter som får trombolytika var mediantiden från början av symtom på AMI till septumruptur 1 dag i GUSTO-I-studien (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) och 16 timmar i GUSTO-I-studien (Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK).
Riskfaktorer för septumruptur är bland annat hög ålder (>65 år), kvinnligt kön, singelkärlssjukdom, omfattande MI och dålig septalkollateral cirkulation. Innan trombolytika kom till var hypertoni och avsaknad av anamnes på angina pectoris riskfaktorer för VSR. Omfattande infarktstorlek och RV-inblandning är andra kända riskfaktorer för septumruptur.
I patienter med AMI utan reperfusion utvecklas koagulationsnekros inom 3-5 dagar efter infarkten. Neutrofiler migrerar till den nekrotiska zonen och genomgår apoptos, frigör lytiska enzymer och påskyndar sönderfallet av nekrotiskt myokard. Vissa patienter har infarkter med stora intramurala hematom, som dissekerar in i vävnaden och resulterar i tidig septumruptur. Storleken på septumrupturen varierar från några millimeter till flera centimeter.
VSR kategoriseras som enkel eller komplex beroende på dess längd, förlopp och läge. Vid enkel septumruptur är perforationen på samma nivå på båda sidor av septum och en direkt genomgående kommunikation finns över septum. En komplex septumruptur kännetecknas av omfattande blödning med oregelbundna, serpiginösa drag i den nekrotiska vävnaden.
Septumrupturer är vanligast hos patienter med stora främre MIs på grund av ocklusion av LAD-arterien som orsakar omfattande septuminfarkter. Dessa infarkter är förknippade med ST-segmenthöjningar och Q-vågor i inferiora ledningar (II, III, aVF) och dessa EKG-förändringar ses därför oftare vid septumrupturer. Dessa rupturer är i allmänhet apikala och enkla.
Septalrupturer hos patienter med inferior MI förekommer relativt sällan. Dessa rupturer involverar det basala inferoposteriora septumet och är ofta komplexa.
Klinisk presentation av VSR
Symtomen på VSR som komplicerar AMI inkluderar bröstsmärta, andnöd, hypotoni, biventrikulär svikt och chock inom timmar till dagar. Patienterna presenterar sig ofta med ett nytt, högljutt och hårt holosystoliskt blåsljud. Detta muller är som mest högljutt längs nedre vänstra sternalgränsen och är förknippat med en palpabel parasternal systolisk spänning. RV- och LV S3-galopper är vanliga.
Hos patienter med kardiogen chock som komplikation till septumruptur kan mumlet och spänningen vara svåra att identifiera. Däremot har patienter med akut MR ofta ett mjukt systoliskt murr vid apex utan thrill.
Diagnostik av VSR
Ekokardiografi med färgflödesdopplerbild är det diagnostiska verktyget att föredra för att identifiera en VSR. (Se bilden nedan.) Dess sensitivitet och specificitet har rapporterats vara så höga som 100 %. Dessutom kan den användas för följande:
-
Detektera platsen och storleken på septumrupturen
-
Bedöm LV och RV. funktion
-
Beräkna RV systoliskt tryck
-
Kvantifiera det vänstra-till höger shunt
Hjärtekateterisering krävs vanligtvis för att bekräfta diagnosen, kvantifiera graden av vänster-höger-shunt, skilja VSR från andra tillstånd (t.ex. mitralinsufficiens) samt visualisera kranskärlen.
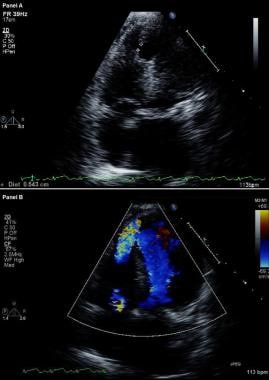 Komplikationer av hjärtinfarkt. Modifierat tvådimensionellt ekokardiogram (överst) och färgflödesdopplerbild (nederst). Apikala fyrakammarbilder visar en brytning i den interventrikulära septumseptum och fri kommunikation mellan ventriklarna genom en stor apikal septum ventrikulär septumdefekt hos en patient som nyligen haft en främre myokardinfarkt.
Komplikationer av hjärtinfarkt. Modifierat tvådimensionellt ekokardiogram (överst) och färgflödesdopplerbild (nederst). Apikala fyrakammarbilder visar en brytning i den interventrikulära septumseptum och fri kommunikation mellan ventriklarna genom en stor apikal septum ventrikulär septumdefekt hos en patient som nyligen haft en främre myokardinfarkt. Inför patienter med VSR visar högerhjärtkateterisering en upptrappning av syremättnaden från höger förmak till RV; däremot förekommer ingen upptrappning av syremättnaden bland patienter med MR. Förekomsten av stora V-vågor i den pulmonella kapillära kilspårningen stöder diagnosen svår akut MR.
Vänster ventrikulografi kan också användas för att identifiera platsen för ventrikelruptur (se Hjärtkateterisering ). Denna undersökning är dock vanligtvis onödig efter att en ekokardiografisk och dopplerundersökning av god kvalitet har utförts.
Behandling av VSR
Nyckeln till behandling av VSR är snabb diagnos och ett aggressivt tillvägagångssätt med hemodynamisk stabilisering, angiografi och kirurgi. Det optimala tillvägagångssättet omfattar hemodynamisk stabilisering med administrering av syre och mekaniskt stöd med användning av en intra-aortisk ballongpump samt administrering av vasodilatatorer (för att minska efterbelastningen och därmed LV-trycket och shunten från vänster till höger), diuretika och inotropa medel.
Hjärtekateterisering behövs för att definiera den koronära anatomin; detta följs av brådskande kirurgisk reparation.
I en studie av 52 konsekutiva patienter med ventrikelseptumruptur efter en infarkt som reparerades kirurgiskt fann utredarna att 30-dagars mortaliteten var 36 % (n = 19). De flesta patienter som överlevde i mindre än 30 dagar hade ett preoperativt chocktillstånd. Utredarna drar slutsatsen att för patienter med ventrikelseptumruptur är det nödvändigt med preoperativ förbättring av chockstatus och aggressiv koronar revaskularisering.
Medicinsk behandling är endast avsedd för tillfällig stabilisering före operation, eftersom de flesta patienters tillstånd försämras snabbt och de dör i avsaknad av kirurgiskt ingripande. I GUSTO-I-studien var 30-dagarsdödligheten lägre hos patienter med VSR som genomgick kirurgisk reparation än hos patienter som behandlades medicinskt (47 % vs 94 %), liksom 1-årsdödligheten (53 % vs 97 %). Lemery et al rapporterade en 30-dagarsöverlevnad på 24 % hos patienter som behandlades medicinskt jämfört med 47 % hos dem som behandlades kirurgiskt.
Riktlinjer från American College of Cardiology/American Heart Association (ACC/AHA) för behandling av patienter med septumruptur i samband med AMI belyser brådskande kirurgiskt ingrepp, oavsett deras kliniska status. Den kirurgiska behandlingen av septumruptur omfattar följande moment:
-
Snabbt införande av hypotermisk kardiopulmonell bypass
-
En ansats till septumrupturen genom infarktområdet och excision av alla nekrotiska, bräckliga marginaler av septum och ventrikelväggar för att undvika postoperativ blödning, kvarstående septumdefekt, eller båda
-
Rekonstruktion av septum och ventrikelväggar med hjälp av protesmaterial och bevarande av kamrarnas geometriska konfiguration och hjärtfunktionen
Perkutan stängning av septumruptur är ett relativt nytt tillvägagångssätt, som används hos utvalda patienter som ett alternativ till kirurgisk reparation eller för akut stabilisering av kritiskt sjuka patienter. Perkutan stängning är dock för närvarande inte tillgänglig på många institutioner och det finns inga uppgifter om långtidsresultat.
Flera studier har inte kunnat visa ett samband mellan perioperativ mortalitet och samtidig koronar revaskularisering (koronar bypass-transplantation). Patienter med kardiogen chock på grund av septumruptur har det sämsta resultatet. I SHOCK-studien var dödligheten på sjukhus högre hos patienter med kardiogen chock på grund av septumruptur (87,3 %) än hos patienter med kardiogen chock av alla andra orsaker (59,2 % med ren LV-svikt och 55,1 % med akut MR).
I patienter som överlever kirurgisk reparation rapporteras frekvensen av återkommande eller kvarvarande septumdefekt vara cirka 28 %, och den tillhörande dödligheten är hög.
Upprepat kirurgiskt ingrepp är indicerat hos patienter som har klinisk hjärtsvikt eller en pulmonal-systemisk fraktion som är större än 2.
Akut mitralregurgitation
MR är en vanlig komplikation till AMI som beror på lokal och global LV-remodellering och som är en oberoende prediktor för hjärtsvikt och död. MR uppträder vanligtvis 7-10 dagar efter en AMI, även om denna debut kan variera beroende på mekanismen för MR. Papillarmuskelruptur som resulterar i MR inträffar inom 1-14 dagar (median, 1 d).
Mild till måttlig MR är ofta kliniskt tyst och upptäcks på dopplerechokardiografi som utförs under den tidiga fasen av AMI. I sådana fall orsakar MR sällan hemodynamisk kompromiss.
Speckle tracking och tredimensionell ekokardiografi visade sig vara viktiga bilddiagnostiska verktyg för att bedöma omvänd LV-remodellering efter kirurgi för degenerativ mitralisklaffregurgitation. Subtila regionala preoperativa förändringar i den diastoliska funktionen hos septal- och lateralväggen kunde identifieras preoperativt, vilket hjälpte till att optimera remisstidpunkten och känna igen potentiella syndare som indikatorer på sjukdomsåterfall efter mitralreparation.
Svår akut MR som beror på ruptur av papillarmuskel eller chordae tendineae resulterar i plötslig hemodynamisk försämring med kardiogen chock. Snabb diagnos, hemodynamisk stabilisering och snabb kirurgisk intervention behövs eftersom akut svår MR är förknippad med hög dödlighet.
Den rapporterade incidensen av MR kan variera på grund av flera faktorer, bland annat de diagnostiska metoder som används, förekomst eller avsaknad av hjärtsvikt, graden av MR som rapporteras, vilken typ av terapi som utförs och tiden från infarktdebut till testning.
Under GUSTO-I-försöket var incidensen av MR hos patienter som fick trombolysbehandling 1,73 %. I SHOCK-studien, som omfattade MI-patienter med kardiogen chock, noterades en 39,1 % incidens av måttlig till svår MR. Kinn et al rapporterade att reperfusion med angioplastik resulterade i en 82-procentig minskning av akut MR jämfört med trombolysbehandling (0,31 % jämfört med 1,73 %).
Riskfaktorer för MR är hög ålder, kvinnligt kön, stor infarkt, tidigare AMI, återkommande ischemi, flerkärls kranskärlssjukdom och hjärtsvikt.
Flera mekanismer kan orsaka MR efter AMI. Ruptur av papillarmuskeln är den vanligaste rapporterade mekanismen.
En sådan ruptur inträffar hos 1 % av patienterna med AMI och involverar ofta den posteromediala papillarmuskeln snarare än den anterolaterala papillarmuskeln, eftersom den förstnämnda har en enda blodtillförsel jämfört med den dubbla tillförseln för den senare. Papillarmuskelruptur kan leda till att bladbladen flaxar eller prolasterar, vilket resulterar i allvarlig MR. Papillarmuskelns dysfunktion på grund av ärrbildning eller återkommande ischemi kan också leda till MR i den subakuta och kroniska fasen efter MI; detta tillstånd kan lösa sig spontant.
Stora posteriora infarkter ger upphov till akut MR på grund av asymmetrisk annulär dilatation och förändrad funktion och geometri hos papillarmuskeln.
Klinisk presentation av MR
Patienter med funktionell mild eller måttlig MR är ofta asymtomatiska. Svårighetsgraden av symtomen varierar beroende på ventrikelfunktionen. Kliniska kännetecken för akut svår MR är bland annat andfåddhet, trötthet, ett nytt apikalt holosystoliskt muller, blixtrande lungödem och chock.
Det nya systoliska mullret kan endast vara tidig- till mellansystoliskt, inte holosystoliskt. Det kan vara mjukt eller till och med frånvarande på grund av den plötsliga ökningen av trycket i vänster förmak, vilket minskar tryckgradienten mellan vänster förmak och LV, jämfört med kronisk MR. Muren hörs bäst vid apex snarare än vid den nedre vänstra sternalgränsen, och den är sällan förknippad med en kick. S3- och S4-gallringar förväntas.
Diagnos av MR
Klinikern kan inte förlita sig på ett nytt holosystoliskt murr för att diagnostisera MR eller bedöma dess allvarlighetsgrad på grund av den varierande hemodynamiska statusen. Hos en patient med AMI som presenterar sig med ett nytt apikalt systoliskt muller, akut lungödem och kardiogen chock är ett högt index för klinisk misstanke om allvarlig MR nyckeln till diagnosen.
Röntgen av bröstkorgen kan visa tecken på lungödem i det akuta läget utan kliniskt signifikant hjärtförstoring.
Ekokardiografi med färgflödesdopplerbild är det diagnostiska standardverktyget för att upptäcka MR. Transtorakal ekokardiografi är det föredragna initiala screeningverktyget, men transesofageal ekokardiografi är ovärderlig för att definiera allvarlighetsgraden och den exakta mekanismen för akut MR, särskilt när misstanken om papillarmuskelruptur är hög. Hjärtkateterisering bör utföras på alla patienter för att fastställa omfattningen och svårighetsgraden av kranskärlssjukdom.
Behandling av MR
Fastställande av hemodynamisk stabilitet, klarläggande av den exakta mekanismen för akut MR och snabb behandling är alla nödvändiga för ett gynnsamt resultat. Medicinsk behandling omfattar reduktion av efterlast med användning av diuretika, natriumnitroprussid och nitrater hos patienter som inte är hypotensiva.
I patienter som har hemodynamisk kompromiss bör intra-aortisk ballongmotpulsering sättas in snabbt. Detta ingrepp minskar vanligtvis väsentligt efterbelastning och regurgitant volym, vilket förbättrar hjärtminutvolymen som förberedelse för kirurgisk reparation. Utan kirurgisk reparation resulterar enbart medicinsk behandling hos patienter med papillarmuskelruptur i otillräcklig hemodynamisk förbättring och en dålig prognos på kort sikt.
En akut kirurgisk intervention är den bästa behandlingen vid papillarmuskelruptur. Kirurgiska tillvägagångssätt kan omfatta reparation eller byte av mitralisklaffen. I avsaknad av papillarmuskelnekros förbättrar mitralisklaffreparation överlevnaden mer än mitralisklaffbyte. Denna skillnad beror på att den subvalvulära apparaten vanligtvis bevaras. Mitralklaffreparation eliminerar också komplikationer relaterade till felfunktion hos protesen.
I patienter med omfattande nekros av papillarmuskel och/eller ventrikelfri vägg är mitralklaffbyte den föredragna modaliteten. Koronar bypassoperation (CABG) som utfördes vid tidpunkten för operationen visade sig i en studie förbättra överlevnaden på kort och lång sikt.
Den enda situation där akut kirurgi säkert kan undvikas är vid intermittent MR på grund av återkommande ischemi. Hos dessa patienter kan framgångsrik myokardiell revaskularisering vara effektiv. Detta förfarande åstadkoms antingen med hjälp av angioplastik eller koronar bypass-transplantation.
Dynamisk LVOTO
Originellt trodde man att den endast förekom vid hypertrofisk kardiomyopati, men olika utredare har rapporterat förekomsten av dynamisk LVOTO som en komplikation vid akut främre MI. Förekomsten av dynamisk LVOTO har också postulerats vara en av etiologierna för myokardruptur.
Dynamisk LVOTO orsakas mekaniskt av kompensatorisk hyperkinesi av LV:s basala och mellersta segment hos patienter med distala LAD-infarkter. Prediktorer för förbättrad regional väggrörelse i icke-infarktzoner är frånvaro av multikärlssjukdom, kvinnligt kön och högre flöde i det infarktrelaterade kärlet. Den ökade kontraktila kraften hos det basala myokardiet orsakar mitralregurgitation via Venturi-effekten. Detta resulterar i ökad OTO, vilket leder till ytterligare minskning av LV-produktionen i samband med redan befintlig systemisk hypoperfusion.
Denna ökade LVOTO i samband med skadat transmuralt myokard bildar en perfekt miljö där det finns ett ökat end-systoliskt intraventrikulärt tryck, vilket inducerar ökad väggspänning i den försvagade, nekrotiska infarktzonen. Denna ofta dödliga komplikation inträffar oftast hos kvinnor, äldre patienter (>70 år) och patienter utan tidigare MI.
Klinisk presentation av LVOTO
De drabbade patienterna kan ha de vanliga symtomen på ett förhöjt autonomt symtomkomplex, såsom andningssvårigheter, diaphores och svala, kladdiga extremiteter, utöver de typiska tecknen och symtomen på AMI.
Dessa patienter kan snabbt utvecklas till kardiogen chock med svår ortopné, dyspné och oliguri, och de kan ha förändrad mental status på grund av cerebral hypoperfusion. Patienterna kan uppvisa ett nytt systoliskt ejektionsmurr, ett nytt holosystoliskt murr som strålar till axillan till följd av systolisk främre rörelse (SAM) av mitralbladet. Det kan också förekomma S3-gallop, lungrallor, hypotoni och takykardi. De sistnämnda fysiska tecknen kan vara helt frånvarande i det akuta skedet.
Endera transtorakal eller transesofageal ekokardiografi (TTE/TEE) är det diagnostiska testet att föredra och kan noggrant karakterisera det hyperkinetiska segmentet, LVOTO och SAM i mitralbladet.
Behandling av LVOTO
Överväg att reducera myokardiets hyperkontraktilitet genom att använda ett försiktigt tillägg av betablockad. Även långsam volymåterupplivning genom efterbelastningsökning (fenyleferin) kan öka förbelastningen och minska LVOTO och SAM. Det vore bäst att undvika efterlastförstärkande läkemedel. Vasodilatorer, inotropa medel och ballongpumpar bör också undvikas eftersom de kan öka LVOTO.
RV-svikt
Ofta ses i samband med inferiör MI, post-MI mild RV-dysfunktion är vanlig; i de flesta fall är dock effekten på LV minimal.
Signifikant RV-hypokinesi inträffar när det finns proximal högra corinaarterieocklusion med lite kollateraler från den vänstersidiga cirkulationen. Det antas att eftersom RV är tunnväggig och har ett lägre syrebehov finns det koronar perfusion under hela hjärtcykeln; därför är utbredd irreversibel infarkt sällsynt.
Typisk RV-svikt kan uppvisas med hypotension (på grund av avsaknad av LV-preload) och jugularvenös distension med ett fritt lungfält. Även om den klassiskt beskrivs i samband med RV-svikt ses denna triad sällan i sin rena form i den kliniska miljön. De flesta patienter presenterar sig med kardiogen chock med låg produktion eller LV-svikt med associerade autonoma symtom.
Närvaron av jugularvenöst tryck över 8 cm H2O och Kussmaul-tecken är mycket känslig och specifik för allvarlig RV-svikt.
Ibland orsakar höger-till-vänster-shunt via en öppen foramen ovale persisterande hypoxemi. Tänk på denna märkliga komplikation.
Elektrokardiografiskt uppvisar patienterna inferiör ST-höjning i samband med ST-höjning i V4R-ledaren. Röntgenbilden av bröstkorgen ser vanligtvis intetsägande ut, utan någon venös distension i övre loberna.
Diagnostik av RV-svikt
Två-dimensionell (2D) ekokardiografi och magnetisk resonanstomografi (MRI) är mycket användbara. Oftast hjälper ekokardiografi till att fastställa diagnosen.
Swan-Ganz-kateteriseringsfynd tyder vanligtvis på höga RA-tryck med ett lågt PCWP.
Behandling av RV-svikt
Volymåterupplivning för att hålla PCWP på eller omkring 15 mmHg kan hjälpa till att temporisera genom att temporärt öka RV-prelasten. Den definitiva behandlingen innebär dock att den koronära cirkulationen återupprättas. I sällsynta fall av allvarlig RV-svikt bör man överväga mekaniskt cirkulatoriskt stöd med hjälp av RV-assistansanordningar (AD) antingen tillfälligt eller som överbryggningsbehandling vid omfattande biventrikulär involvering.