
J-kopplingens ursprung kan åskådliggöras genom en vektormodell för en enkel molekyl som vätefluorid (HF). I HF har de två atomkärnorna spinn 1/2. Fyra tillstånd är möjliga, beroende på den relativa inriktningen av H- och F-kärnornas spinn i förhållande till det yttre magnetfältet. Urvalsreglerna för NMR-spektroskopi föreskriver att ΔI = 1, vilket innebär att en given foton (inom radiofrekvensområdet) kan påverka (”vända”) endast ett av de två kärnspinnena.J-koppling ger tre parametrar: multipliciteten (”antalet linjer”), kopplingens storlek (stark, medel, svag) och kopplingens tecken.
MultiplicitetRedigera
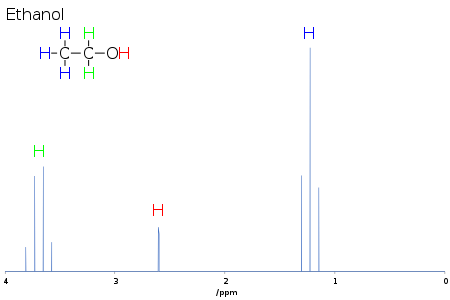
Multiplikatorn ger information om antalet centra som är kopplade till den aktuella signalen, och deras kärnspinn. För enkla system, som vid 1H-1H-koppling i NMR-spektroskopi, är multipliciteten en mer än antalet intilliggande protoner som inte är magnetiskt likvärdiga med de berörda protonerna. För etanol är varje metylproton kopplad till de två metylenprotonerna, så metylsignalen är en triplett. Och varje metylenproton är kopplad till de tre metylprotonerna, så metylsignalen är en kvartett.
Kärnor med spins större än 1/2, som kallas fyrpoliga, kan ge upphov till större splittring, även om koppling till fyrpoliga kärnor i många fall inte observeras. Många grundämnen består av kärnor med kärnspin och kärnor utan. I dessa fall är det observerade spektrumet summan av spektrum för varje isotopomer. En av de stora fördelarna med NMR-spektroskopi för organiska molekyler är att flera viktiga kärnor med lättare spinn 1/2 antingen är monoisotopiska, t.ex. 31P och 19F, eller har mycket hög naturlig förekomst, t.ex. 1H. En ytterligare fördel är att 12C och 16O inte har något kärnspin, så dessa kärnor, som är vanliga i organiska molekyler, orsakar inte splittringsmönster i NMR.
Storleken på J-kopplingenRedigera
För 1H-1H-koppling ger storleken på J information om kopplingspartnernas närhet till varandra. Generellt sett är koppling med två bindningar (dvs. 1H-C-1H) starkare än koppling med tre bindningar (1H-C-C-C-1H). Kopplingens storlek ger också information om de dihedrala vinklarna mellan kopplingspartnerna, vilket beskrivs av Karplus-ekvationen för kopplingskonstanter för trebindningar.
För heteronukleär koppling är J:s storlek relaterad till kopplingspartnernas kärnmagnetiska moment. 19F, med ett högt kärnmagnetiskt moment, ger upphov till stor koppling till protoner. 103Rh, med ett mycket litet kärnmagnetiskt moment, ger endast små kopplingar till 1H. För att korrigera för effekten av det kärnmagnetiska momentet (eller motsvarande det gyromagnetiska förhållandet γ) diskuteras ofta den ”reducerade kopplingskonstanten” K, där
K = 4π2J/hγxγy.
För koppling av en 13C-kärna och en direktbunden proton är den dominerande termen i kopplingskonstanten JC-H Fermi-kontaktinteraktionen, som är ett mått på s-karaktären hos bindningen vid de två atomkärnorna.
När det yttre magnetfältet är mycket lågt, t.ex. som jordfält-NMR, dominerar J-kopplingssignaler i storleksordningen hertz vanligen kemiska skift som är i storleksordningen millihertz och som normalt inte kan lösas upp.
Tecken på J-kopplingRedigera
Värdet på varje kopplingskonstant har också ett tecken, och kopplingskonstanter av jämförbar storleksordning har ofta motsatta tecken. Om kopplingskonstanten mellan två givna spinn är negativ är energin lägre när dessa två spinn är parallella, och omvänt om deras kopplingskonstant är positiv. För en molekyl med en enkel J-kopplingskonstant är NMR-spektraets utseende oförändrat om kopplingskonstantens tecken är omvänt, även om spektrallinjer vid givna positioner kan representera olika övergångar. Det enkla NMR-spektrumet anger därför inte kopplingskonstantens tecken, vilket det inte finns något enkelt sätt att förutsäga.
För vissa molekyler med två olika J-kopplingskonstanter kan dock de relativa tecknen på de två konstanterna experimentellt bestämmas genom ett experiment med dubbelresonans. Till exempel i dietyltalliumjonen (C2H5)2Tl+ visade denna metod att metyltalliumjonen (CH3-Tl) och metylentalliumjonen (CH2-Tl) kopplingskonstanter har motsatta tecken.
Den första experimentella metoden för att bestämma det absoluta tecknet på en J-kopplingskonstant föreslogs 1962 av Buckingham och Lovering, som föreslog att man skulle använda ett starkt elektriskt fält för att rikta in molekylerna i en polar vätska. Fältet ger upphov till en direkt dipolär koppling av de två spinnarna, vilket adderar till den observerade J-kopplingen om deras tecken är parallella och subtraherar från den observerade J-kopplingen om deras tecken är motsatta. Denna metod tillämpades först på 4-nitrotoluen, för vilken J-kopplingskonstanten mellan två intilliggande (eller ortho) ringprotoner visade sig vara positiv eftersom uppdelningen av de två topparna för varje proton minskar med det applicerade elektriska fältet.
Ett annat sätt att rikta in molekyler för NMR-spektroskopi är att lösa upp dem i ett nematiskt flytande kristallösningsmedel. Denna metod har också använts för att bestämma det absoluta tecknet på J-kopplingskonstanter.