Guanosintrifosfat (guanosin-5′-trifosfat, för att vara exakt, eller för enkelhetens skull även förkortat GTP) är en högenerginukleotid (inte att förväxla med nukleosid) som finns i cytoplasman eller som polymeriseras till guaninbasen.
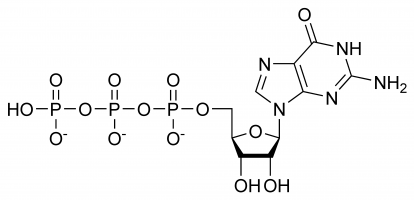
GTP har selektiva roller vid bildandet av RNA-strängar, fungerar som en energibärarmolekyl för proteinsyntes, ett koenzym, en föregångare till cGMP – en sekundär budbärarmolekyl eller som en effektmolekyl. De två sistnämnda visas vanligen genom modulering av G-proteiner. Allt detta är ett resultat av dess komplexa tredimensionella struktur och den mängd olika kemiska grupper som den består av. För enkelhetens skull kan man därför betrakta den som en blandning av olika funktionella grupper som praktiskt taget utför olika funktioner isolerade (även om strukturen ibland är inblandad, t.ex. när den interagerar med ett enzym och ett annat substrat), t.ex. är endast trifosfatet inblandat i frigörandet av energi för polymerisation medan endast guaninbasen är inblandad i dess deaminering. Det är viktigt att notera att den lista som gavs i början inte visar alla kemiska interaktioner, utan är bara en demonstration av dess olika möjligheter.
I GTP är ribosesockret centralt i det tredimensionella arrangemanget av de kovalent bundna guanin- och trifosfatmolekylerna. Denna monosackarid tillhandahåller hydroxylgrupper för kondensationsreaktioner och nukleofila angrepp, varav det senare är viktigt för förstörelsen av RNA-molekyler och därmed regleringen av genuttrycket. Guaninmolekylen och trifosfatet bildar kovalenta bindningar vid C’1- respektive C’5-atomerna, men det är också möjligt för dem att utnyttja andra hydroxylgrupper så länge den resulterande strukturen inte orsakar kollisioner. Ur purinens perspektiv är den bunden som ett resultat av en kondensationsreaktion vid dess 9’N, som tidigare var kovalent bunden till en väteatom. Eftersom guanin är en purinbas klassificeras det som en purintrifosfat tillsammans med adenintrifosfat (ATP) och bildas genom modifiering av inosinmonofosfat.
Innehåll
- 1 Missuppfattning: GTP, en grundläggande byggsten
- 2 En av många RNA-baspredecesorer
- 3 GTP; en kusin till universell ATP
- 4 En resurs för signalering
- 5 Referenser
Missuppfattning: GTP, en grundläggande byggsten
Levern är det viktigaste organet som syntetiserar purin- och pyramidinnukleotider. Purinnukleotider (GTP och ATP) syntetiseras genom att först skapa inosinmonofosfat från ATP, glutamin, glycin, CO2, aspartat och format. IMP
kan sedan modifieras för att ge någon av molekylerna.
I fallet med GTP-bildning omvandlas IMP först till XMP av IMP-dehydrogenas. Den resulterande kemiska och strukturella förändringen möjliggör verkan av GTP-syntas som snabbt omvandlar XMP till GMP. GMP är dock inte en högenergimolekyl eftersom den inte har någon trifosfat, så den fosforyleras sedan av nukleosidfosfatkinaser för att först ge en difosfat och slutligen en trifosfat.
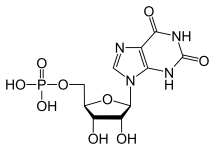
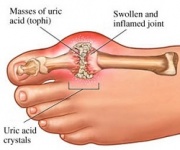
GTP kataboliseras normalt till olöslig urinsyra som sedan kan uppstå i urinen som natriumuratkristaller. Denna process anses vara onormal om den sker i synoviallederna och resulterar i urinsyra som sedan omvandlas till skadligt mononatriumurat eller kalciumpyrofosfatdihydrat. Närvaron av sådana kemikalier möjliggör utveckling av inflammation och artrit och de kombinerade symptomen leder till att sjukdomen klassificeras som gikt. Ett annat exempel på vikten av lämplig katabolism av purinnukleotider är svår kombinerad immunbristsjukdom som leder till att viktiga B- och T-lymfocyter förstörs
One Of Many RNA Base Predecesors
Det finns flera skillnader mellan RNA och DNA, men den primära skillnaden ligger i strukturen av de nukleobaser som bygger upp varje polymer. RNA-nukleobaser innehåller en 2’OH-grupp på sitt ribosesocker, vilket gör att de är betydligt mer kemiskt reaktiva, katalytiska och instabila. Det är viktigt att notera att guanosintrifosfat endast har att göra med produktionen av guaninbasen i RNA. Analogt till GTP för bildandet av en guaninbas i DNA är desoxyguanosintrifosfat. Denna trifosfat innehåller ett deoxyribosesocker utan
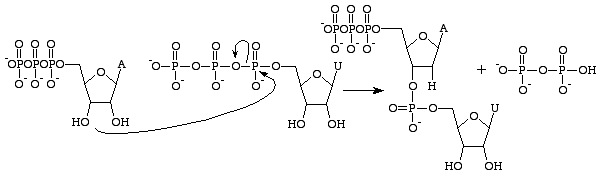
2’OH-grupp, vilket gör den betydligt stabilare – den förhindrar nukleofila angrepp som skulle klyva fosfodiesterbindningarna mellan nukleobaserna. Detta är idealiskt eftersom RNA bör sönderdelas efter det att det har översatts till ett protein medan DNA måste förbli intakt för överföring av genetisk information till dottercellen.
Guanosintrifosfat kommer att resultera i bildandet av en guaninbas som ett resultat av klyvningen av en anhydridbindning och frigör alfa- och gammafosfater som fria fosfater. GMP bildar sedan en fosfodiesterbindning med den närliggande basen som innehåller en 3’OH-grupp och tillhandahåller en 3’OH-grupp för nästa RNA-bas. Denna reaktion sker endast om den motsatta basen till GMP är cytosin med vilken den kan bilda vätebindningar och dess hastighet ökas av RNA-polymeras. RNA-polymeras anpassar inte trifosfaterna. Det katalyserar endast den reaktion som inträffar efter att detta har skett oberoende av varandra. Efter katalysen ingår molekylen i en polynukleotidkedja och kallas inte längre för GTP utan för basen guanin.
GTP; en kusin till universell ATP
Den underliggande mekanismen för att ge energi från klyvning av anhydridbindningar är densamma i alla trifosfater. Trifosfaternas höga energistatus uppnås genom tre olika mekanismer. Den första beror på de repulsiva krafterna
på var och en av fosfatgrupperna. Detta bidrar till en hög instabilitet hos de bundna trifosfaterna och en hög ”önskan” att uppnå en lägre energistatus. Den andra beror på resonansstabilisering. När GTP
omvandlas till GDP ökar antalet möjliga positioner för de existerande elektronparen, vilket bidrar till en högre stabilitet. Detta argument bekräftas också när GDP omvandlas till GMP. Det tredje beror på den ogynnsamma entropiska effekt som en ökad mängd fosfater har på konformationen hos de vattenmolekyler som omger molekylen.
Då GTP-koncentrationen i cytoplasman är betydligt lägre än ATP används den för specifika funktioner i cellens metaboliska processer.
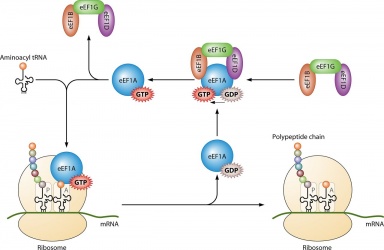
Dess huvudsakliga användning är i proteinsyntesen när den kopplas till IF2 under ribosomal initiering, Ef-Tu och Ef-G under förlängning och ;RF3 under terminering. Alla GTP-molekyler som binds med de angivna proteinerna avfosforyleras, vilket resulterar i GDP och en fri fosfat
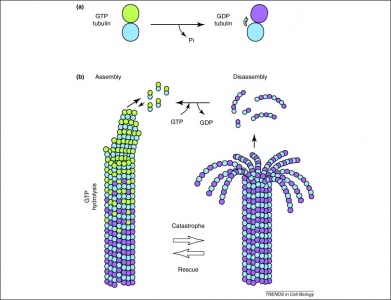
Det är dessutom så att GTP även utnyttjas av tubulindimerer i deras bildande av mikrotubuli. Tubulindimerer består av alfa- och betatubulin, som var och en har GTP-bindningsställen. Eftersom betatubulin finns i filamentets plusände hydrolyseras GTP alltid här när ytterligare en dimer läggs till den förlängande polymeren. Det är viktigt att hydrolysen av GTP försvagar de icke-kovalenta interaktionerna mellan tubulindimerer, vilket gör det lättare att lösa upp mikrotubulerna vid behov. Observera att alfa-tubulinproteinet GTP inte avfosforyleras, så det kan anses vara beständigt genom hela mikrotubulstrukturen.
En resurs för signalering
Användningen av GTP:s specifika kemi och rumsliga konformation demonstreras effektivt genom dess användning vid signalöverföring. Främst kan det binda och reglera aktiviteten hos olika signalvägsproteiner som klassificeras i två olika grupper. Den första gruppen är heterotrimera GTP-bindande proteiner (även kallade heterotrimera G-proteiner) som använder GTP vid aktivering av G-proteinkopplade receptorer för att modifiera aktiviteten hos andra proteiner i signalvägen. De andra är monomera GTP-bindande proteiner (även kallade monomera G-proteiner). Dessa reagerar på andra receptorer än G-proteinkopplade receptorer. Ett typiskt exempel som nämns i deras förklaring är Ras-proteinet. Observera att de kan binda GTP selektivt, inte bara på grund av dess specifika kemi utan också på grund av det inducerade passningsfenomenet. Det bundna GTP:t kommer sedan att hydrolyseras efter en viss tidsperiod, vilket leder till en automatisk inaktivering av proteinet och förhindrar överdriven stimulering av en signalväg. Efter att GTP har hydrolyserats kommer GDP att förbli bundet eftersom konformationsförändringen kommer att resultera i en förändring av affiniteten till GTP-molekylen och GDP-molekylen. Detta är dock en oföränderlig förändring och kan upphävas genom efterföljande aktivering av den G-proteinkopplade receptorn.
GTP kan också användas som reaktant för att producera cGMP som är en relativt vanlig sekundär signalmolekyl. Katalysen utlöses av frisättning av NO som aktiverar guanylatcyklas, ett enzym som producerar cGMP från GTP. cGMP kan sedan fungera som en effektor för proteinkinaser som fosforylerar och ändrar specifika proteiners verkan.
- J Koolman och KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell och P A Weil. Harpers illustrerade biokemi. 28th Edition. Peking, Kina. 2009.
- J Dow, G Lindsay och J Morrison, Biochemistry: Molekyler, celler och kroppen. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay och J Morrison, Biochemistry: Molekyler, celler och kroppen. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay och J Morrison, Biochemistry: Molekyler, celler och kroppen. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman och KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- M W King. Sidan om medicinsk biokemi. September 2016. Citerat: 11:31. 03.12.2016. Tillgänglig från: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell och P A Weil. Harpers illustrerade biokemi. 28th Edition. Peking, Kina. 2009.
- M W King. Sidan om medicinsk biokemi. September 2016. Citerat: 11:31. 03.12.2016. Tillgänglig från: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Sidan för medicinsk biokemi. September 2016. Citerat: 11:31. 03.12.2016. Tillgänglig från: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Sidan för medicinsk biokemi. September 2016. Citerat: 11:31. 03.12.2016. Tillgänglig från: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Sidan för medicinsk biokemi. September 2016. Citerat: 11:31. 03.12.2016. Tillgänglig från: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay och J Morrison, Biochemistry: Molekyler, celler och kroppen. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay och J Morrison, Biochemistry: Molekyler, celler och kroppen. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay och J Morrison, Biochemistry: Molekyler, celler och kroppen. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman och KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto och R Stryer. Biokemi. Åttonde upplagan. Stad och land oidentifierat. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto och R Stryer. Biochemistry. Åttonde upplagan. City and Country Unidentified. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto och R Stryer. Biochemistry. Åttonde upplagan. City and Country Unidentified. Freeman and Co. 2015.
- T E Dever och R Green. Elongations-, terminerings- och återvinningsfaserna i eukaryoter. CSHPB. Juli 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Tyskland. Thieme 2013.