Introduktion: Migränkliniken
Migrän består av ensidig huvudvärk som åtföljs av ett kluster av andra sensoriska, autonoma och kognitiva symtom och har identifierats av den globala studien om sjukdomsbördan (GBD) 2016 som den sjätte vanligaste sjukdomen och en av de viktigaste orsakerna till funktionsnedsättning i hela världen, och förekommer ofta i arbetsför ålder och hos unga vuxna och medelålders kvinnor (Collaborators, 2018). Därför utgör migrän en mycket allvarlig social fråga när det gäller antalet levnadsår med funktionsnedsättning (YLD) och den viktigaste orsaken till YLD inom 15-49 års ålder (se Steiner et al., 2018). Den börda som en sådan sjukdom innebär har inte identifierats förrän nyligen eftersom: migrän inte är en orsak till permanent funktionsnedsättning eller dödsfall; huvudvärk förekommer ibland i den allmänna befolkningen (Collaborators, 2018). Även om en definitiv patogenes för migrän inte är känd, är den extrakraniella cirkulationen involverad (Drummond och Lance, 1983). Det kliniska förloppet av migrän artikuleras i olika följande eller samtidiga stadier: premonitärt, aura, huvudvärk och postdrome (som liknar den premonitära fasen) (Goadsby et al., 2017a). Den premonitära fasen inkluderar irritabilitet, matbegär, stel nacke och kan inträffa från 2 till 72 timmar före attacken och fortsätter över de andra faserna. Enligt definitionerna i International Classification of Headache Disorders third edition (ICHD-3):
– aura kännetecknas av en eller flera övergående, reversibla neurologiska brister, varav minst en måste vara ensidigt lokaliserad, som utvecklas under 5 minuter eller mer och där varje brist varar mellan 5 och 60 minuter;
– migrän består av huvudvärksattacker som varar 4-72 timmar och som åtföljs av illamående, fotofobi och fonofobi, eller båda (se Goadsby et al., 2017a).
Kutan allodyni, som definieras som upplevelsen av smärta efter icke-smärtsamma stimuli, förekommer hos mer än 70 % av patienterna (Lambru et al., 2018). Svår huvudvärk dämpas till att upphöra under postdromefasen, medan andra symtom som asteni, somnolens och fotofobi fortsätter att påverka patienten, vilket visar den komplexa neurala grunden som ligger till grund för migrän (Lambru et al., 2018). Beroende på hur många dagar per månad som påverkas klassificeras migrän som episodisk (färre än 15 migrän- eller huvudvärkdagar) eller kronisk (minst 15 dagar, varav 8 eller fler är migrändagar) (se Goadsby et al., 2017b). Denna aspekt påverkar på ett anmärkningsvärt sätt sjukdomens inverkan och behandlingsmöjligheterna (Giamberardino et al., 2017). Vid 1 till 3 attacker per månad är det möjligt att endast använda abortiva symtomatiska läkemedel, medan det vid 4 till 14 attacker per månad är obligatoriskt att lägga till förebyggande behandlingar; de sistnämnda behandlingarna är nödvändiga för att undvika kronifiering av sjukdomen (Giamberardino och Martelletti, 2015; Giamberardino et al, 2017) och för att minska risken för överanvändningshuvudvärk av läkemedel och refraktär migrän (Martelletti, 2017).
Patofysiologi för migrän och Calcitonin Gene-Related Peptide (CGRP)
Den exakta orsaken till migränattacker är ännu inte välkänd, men den aktuella forskningen har lyft fram betydelsen av sensibiliseringsprocesser inom det trigeminovaskulära systemet och hela hjärnstammen, samt iakttagandet av minskad grå substans i smärtbearbetningsområden (se Goadsby et al, 2017a). Från det trigeminala ganglion som innehåller cellkroppen synapsar pseudo-unipolära primära afferenter på blodkärlen och på det trigeminocervikala komplexet, från vilket fibrer av andra ordningen synapsar på thalamokortikala neuroner av tredje ordningen och på locus coeruleus, periaqueductal grey och hypothalamus (Goadsby et al., 2017a). De nociceptiva fibrerna från trigeminusganglionet och de cervikala dorsalrotsganglierna innerverar dura mater-kärlen och deras terminaler frigör vasoaktiva neuropeptider såsom calcitonin genrelaterad peptid (CGRP) som inducerar vasodilatation. Uttryck av CGRP, CLR och RAMP1 i mänskliga dura mater kärl visas i figurerna 1A-C. De autonoma nervfibrerna som innerverar extracerebrala kärl innehåller flera vasoaktiva neurotransmittormolekyler: noradrenalin, serotonin, acetylkolin, neuropeptid Y (NPY), vasoaktiv intestinal polypeptid (VIP), substans P (SP), neurokinin A (NU) och CGRP (Goadsby et al., 1990). CGRP-receptorantagonisterna verkar blockerande på den nociceptiva informationen från dura mater: den bearbetas i de thalamiska kärnorna varifrån den når högre kortikala regioner. Dessa inflöden från det trigeminovaskulära systemet moduleras av hjärnstammens nedåtgående väg: 5-hydroxytryptamin (5HT)1B/1D-receptoragonisterna, dvs. triptaner, antas verka via detta system och motverka den inträffade vasodilatationen. Medan propranolol och topiramat används som förebyggande behandling, används de sistnämnda läkemedlen vid akuta episoder av migrän. Förutom sin vasokonstriktoriska aktivitet hämmar triptaner, som verkar direkt på 5HT1B/D presynaptiska receptorer, frisättningen av mediatorer som CGRP som är inblandade i nociception. Dessutom har sumatriptan experimentellt visats hämma den inåtriktade ström som medieras av transient receptor potential vanilloid 1 (TRPV1) i trigeminusganglier (Evans et al., 2012). CGRP frisätts under migränattacker och uppvisar flera roller som den mest vasoaktiva neuropeptiden vars craniovaskulära nivåer ökar under sjukdomens förlopp (Goadsby et al., 1990). CGRP har visat sig genomgå förändringar även i cerebrospinalvätska (van Dongen et al., 2017). De utlösande faktorerna till förändrad central excitabilitet och det följande genombrottet av migränesmärtepisoder har länge undersökts. Stimulering av nervfibrer kan främja både ortodromiska och antidromiska aktionspotentialer och i synnerhet aktivering av durala peptidergiska primära sensoriska afferenter som uttrycker den transienta receptorpotentialen (TRP) kan inducera frisättning av flera molekyler, inklusive CGRP, som utlöser inflammatoriska vävnadsreaktioner som kallas neurogen inflammation (Xanthos och Sandkuhler, 2014). I synnerhet är CGRP involverat i kranial nociception och i epifenomenet vasodilatation som binder sina receptorer på meningeala och cerebrala blodkärl (Deen et al., 2017). Dessa processer främjar sensibiliseringen av de trigeminala fibrerna av andra ordningen som tar förstärkta smärtsamma stimuli till högre regioner som thalamus, hypotalamus och cortex, vilket ger upphov till migrän (Dussor et al., 2014). TRPs aktiveras som svar på flera irriterande miljöstimuli, t.ex. temperatur- och pH-variationer, som hos personer som är predisponerade för detta kan utlösa migränsmärta. CGRP produceras genom vävnadsspecifik alternativ splicing av kalcitoningenen CALC I på kromosom 11, som också kodar för kalcitonin. Däremot produceras β CGRP av CALC II-genen som ligger på en annan plats på kromosom 11. α CGRP neuropeptid finns i det centrala nervsystemet som α-isoform med 37 aminosyror och dess signaltransduktion förmedlas av två receptorer.
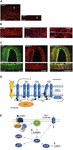
Figur 1. CGRP-förekomst och väg vid migrän. Uttryck av CGRP, CLR och RAMP1 i mänskliga durakärl: (A) CGRP-immunoreaktivitet finns i tunna fibrer i adventitia, (B) tvär- och längdsnitt som visar RAMP1-uttryck i cytoplasman hos glatta muskelceller, (C) samexpression av CLR och RAMP1 i det glatta muskelcellskiktet. (D) CGRP-receptorkomponenter och viktiga rester för receptorsignalering och internalisering. CGRP-receptorn utgörs av CLR (blått), RAMP1 (gult) och RCP (orange). Funktionellt viktiga rester visas som förkortningar med en bokstav. Aminosyraresterna är numrerade från början av den förutspådda N-terminala signalpeptiden (Swiss-Prot Q16602). Flera aminosyror inom CLR:s C-terminus (∼N400-C436) och I312 vid ICL3/TM5-övergången krävs för effektiv CGRP-medierad internalisering. Viktiga egenskaper hos CGRP-receptorn, inklusive TM6 ”kink” (P343) och den förmodade åttonde helixen (∼G388-W399) i CLR illustreras. C′, C-terminal; ECL, extracellulär slinga; ICL, intracellulär slinga; N′, N-terminal; TM, transmembran. (E) CGRP-receptormedierad intracellulär signalering: Gαs-signalering ökar AC-aktiviteten (grönt), vilket höjer det intracellulära cAMP, aktiverar PKA och därefter många potentiella nedströms effektorer. Panelerna (A-C) är anpassade från Eftekhari et al. (2013) respektive panel (D,E) från Walker et al. (2010), med tillstånd.
Den första är känd som den kanoniska CGRP-receptorn och är en Gαs-proteinkopplad receptor som kräver det receptoraktivitetsmodifierande proteinet (RAMP) 1 för att vara funktionell (Goadsby et al., 2017a). Den andra är den humana amylin subtyp 1-receptorn (AMY1): amylin tillhör kalcitonin-genfamiljen och har hormonell aktivitet. När CGRP binder till sin receptor utsätts den för dynamin/clathrin-beroende internalisering efter att ha komplexerats med β-arrestin (se Walker et al., 2010). Konformationsförändringar uppstår som inducerar aktivering av adenylatcyklas (AC), ökning av cAMP och aktivering av proteinkinas A (PKA) som kan främja vasodilatation genom direkt aktivering av endotelial kväveoxidsyntas och smärtreaktioner. Den sistnämnda receptorn kan kopplas till Gαq/11 med aktivering av fosfolipas C (PLC), till mitogenaktiverat proteinkinas (MAPK) och till frisättning av NO (se Walker et al., 2010) (se figurerna 1D, E för en schematisk representation av CGRP-receptormedierad intracellulär signalering). Administrering av CGRP till migräniker utlöser attacker och dessa bevis stöder dess centrala roll i migränens patogenes (Lassen et al., 2002). Ett signalavslutningssystem har ännu inte identifierats: CGRP metaboliseras av neprilysin, insulinnedbrytande enzym och endotelin-konverterande enzym-1 och ett aktivt transportsystem för återupptag har antagits (se Russell et al., 2014). När receptorn aktiveras övergående av CGRP internaliseras den dessutom i endosomer och återförs snabbt tillbaka till cellmembranet, medan kronisk stimulering av receptorn inducerar desensibilisering och lysosomal nedbrytning (se Russell et al, 2014).
Farmakologiska interventioner på CGRP-banan
Migrän är en mångfacetterad handikappande neurovaskulär sjukdom och den nuvarande terapin med orala triptaner är effektiv vid akuta attacker, även om cirka 40 % av patienterna är resistenta mot behandlingen (Ferrari et al., 2001; Edvinsson, 2015). Dessa selektiva 5-HT1B/1D-agonister, av vilka den mest använda är sumatriptan som oftast är aktiv för subkutan väg, utövar sin terapeutiska verkan genom vasokonstriktion av kraniala kärl och hämning av det trigeminala och trigeminocervikala systemet (se Ferrari et al., 2001). Vasokonstriktionen utgör dock en gräns för de kardiovaskulära biverkningarna av dessa läkemedel. Dessutom kan behandlingen med triptaner inte pågå längre än 9 dagar per månad på grund av risken för läkemedelsinducerad huvudvärk. År 2010 godkändes botulinumtoxin typ A (BoNT-A) av Food and Drug Administration (FDA) för förebyggande av migrän hos kroniska migränpatienter som inte reagerar, men dess komplicerade administrering (det kräver injektion på 31 ställen) begränsar patienternas följsamhet. På grund av den centrala roll som CGRP spelar i migränens patofysiologi har antagonister till dess receptor utvecklats. Dessa läkemedel hör till klassen av geparanter. Telgecepant, det första orala gepant, tolererades väl av migränpatienter med kranskärlssjukdom (ClinicalTrials.gov NCT00662818, Ho et al., 2012), men det uppvisade hepatotoxicitet. Trots kontinuerlig forskning om dessa små molekyler föreslogs därför ett nytt tillvägagångssätt som bestod i utveckling av monoklonala antikroppar (mAbs) mot CGRP (nezumabs) eller CGRP-receptorn (numabs). Dessa läkemedel tros hämma verkan av de cirkulerande CGRP-molekylerna för att förhindra migränattacker och eftersom de inte passerar blod-hjärnbarriären (BBB) på grund av sin storlek bör verkningsställena vara i trigeminussystemet (Edvinsson, 2015). I synnerhet ingår inte durala kärl i BBB. Dessutom korsar CGRP sannolikt inte BBB och fungerar som en parakrin regulator eftersom det uttrycks av hälften av neuronerna i trigeminusganglion som inte presenterar CGRP-receptorn, uttrycks av satellitgliaceller och 30 % av neuronsoman i trigeminusganglion (se Yuan et al., 2017). För närvarande finns det fyra mAbs, eptinezumab, fremanezumab, galcanezumab och erenumab som studeras i kliniska prövningar för episodisk och kronisk migrän. De tre första mAbs är humaniserade antikroppar riktade mot CGRP, medan erenumab är en human antikropp mot dess kanoniska receptor. Halveringstiden för dessa läkemedel är ganska lång, vilket gör att de inte kan administreras mer än en gång per månad, vilket är av intresse eftersom mAbs måste administreras intravenöst eller subkutant. I synnerhet eptinezumab administreras endast intravenöst (Israel et al., 2018). I fas III-studien PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) utvärderades eptinezumabs effektivitet vid förebyggande av frekvent episodisk migrän. Resultaten visade en signifikant minskning av den primära endpunkten bestående av minskning av månatliga migränedagar (MMD) från genomsnittlig baslinje på 8,5 dagar under veckorna 1-12 till 4,3 MMD med dosen 300 mg, 3,9 med 100 mg och 4,0 med 30 mg avseende 3,2 dagar med placebo (Saper et al., 2018). För utvärdering av eptinezumab i förebyggande av kronisk migrän har 1121 deltagare rekryterats till PROMISE 2 (ClinicalTrials.gov NCT02974153). Galcanezumab utvärderades för effektivitet i förebyggande av episodisk migrän i den dubbelblinda, randomiserade, placebokontrollerade fas 3-studien EVOLVE-1 (ClinicalTrials.gov NCT02614183) som dissekerades i 4 perioder och i den randomiserade, kontrollerade, dubbelblinda 6-månaders-kliniska studien EVOLVE-2 fas 3 (ClinicalTrials.gov NCT02614196). I EVOLVE-1 uppfyllde båda doserna av galcanezumab (120 och 240 mg) det primära resultatet av en signifikant minskning av antalet dagar med månadsvis migränhuvudvärk med 4,7 dagar respektive 4,6 dagar i jämförelse med placebos 2,8 dagar (Stauffer et al., 2018). I EVOLVE-2 fick patienterna en månatlig injektion av 120 eller 240 mg galcanezumab. De genomsnittliga månatliga dagarna med migränhuvudvärk reducerades med 4,3 respektive 4,2 dagar jämfört med den minskning på 2,3 dagar som erhölls med placebo (p < 0,001) (Skljarevski et al., 2018). Även de sekundära effektmåtten minskning av funktionsnedsättning bedömd med hjälp av R-FR-poängen (Role Function-Restrictive) i MSQ (Migraine-Specific Quality of Life Questionnaire) och förbättring av poängen i PGI-S (Patient Global Impression of Severity) och MIDAS (Migraine Disability Assessment; tidpunkt = månad 6) uppnåddes (Skljarevski et al., 2018). 147 (65,0 %) och 163 (71,5 %) av de patienter som behandlades med galcanezumab, 120 respektive 240 mg, och 287 (62,3 %) med placebo uppvisade biverkningar, bland annat akut hjärtinfarkt och transitorisk ischemisk attack inom en grupp av sju patienter under behandling med galcanezumab 240 mg (Skljarevski et al., 2018). Det fanns inga statistiskt signifikanta skillnader i genomsnittlig förändring från baslinjen för systoliskt/diastoliskt blodtryck. De 19 (8,6 %), 11 (5,1 %) och 2 (0,5 %) patienterna i galcanezumab 120 mg-, galcanezumab 240 mg- respektive placebogrupperna uppvisade behandlingsframkallande antikroppar mot läkemedel (ADA). I fas III-studien REGAIN som utvärderade galcanezumab mot kronisk migrän minskade MMD:erna med 4,8 dagar med 120 mg-dosen och med 4,6 dagar med 240 mg-dosen jämfört med 2,7 med placebo (se Yuan et al., 2017). Dessutom visade sig behandlingen med galcanezumab vara begåvad med statistiskt signifikant persistens av effekten (Forderreuther et al., 2018). Fremanezumab undersöktes i fas III-studien HALO för förebyggande behandling av migrän (ClinicalTrials.gov NCT02638103). Det minskade MMDs av episodisk migrän efter 12 veckor med 3,7 dagar vid 225 mg månadsvis i 3 månader och med 3,4 dagar vid 675 mg en gång i kvartalsvis dosregim jämfört med minskningen på 2,2 dagar för placebo (se Yuan et al., 2017). Effekten av erenumab vid förebyggande av episodisk migrän studerades i den randomiserade, dubbelblinda, placebokontrollerade fas 3-studien ARISE (ClinicalTrials.gov NCT02483585). MMD:er minskade med 70 mg subkutant erenumab per månad med 2,9 dagar i jämförelse med 1,8 dagar med placebo (p < 0,001) och det var effektivt i de sekundära effektmåtten minst 50 % minskning av MMD:er och förändring av antalet månatliga migränspecifika läkemedelsbehandlingsdagar (MSMD) (Dodick et al., 2018). Andelen patienter som uppvisade biverkningar var likartad mellan gruppen som behandlades med mAb och placebo. 4,3 % testade positivt för anti-erenumab-bindande antikroppar fram till vecka 12, varav en av dem var övergående positiv för neutraliserande antikroppar, men endast vid vecka 4 (Dodick et al., 2018). Även den kliniska fas III-studien STRIVE (ClinicalTrials.gov NCT02456740) utvärderade effekten av erenumab för förebyggande av episodisk migrän. Erenumab administrerades med 70 eller 140 mg per månad i 6 månader (Goadsby et al., 2017b). Det genomsnittliga antalet MMDs vid baslinjen var 8,3 och doserna 70 mg och 140 mg minskade det med 3,2 respektive 3,7, jämfört med 1,8 dagar med placebo (med p < 0,001 för varje dos jämfört med placebo) (Goadsby et al., 2017b). Även under de sista 3 månadernas behandling uppfyllde varje dos erenumab de sekundära effektmåtten på minst 50 % minskning från baslinjen av det genomsnittliga antalet migränedagar per månad och minskning från baslinjen av både Migraine Physical Function Impact Diary (MPFID) vardagliga aktiviteter (MPFID-EA) och fysisk försämring (MPFID-PI) (Goadsby et al., 2017b). Hos de patienter som hade anti-erenumab-antikroppar testade endast en i den grupp som behandlades med 70 mg positivt för neutraliserande antikroppar och mAb:et tolererades överlag väl när det gäller kreatininnivåer, levertoxicitet, totalt antal neutrofiler och elektrokardiografisk funktion (Goadsby et al., 2017b). Enligt författarna är en av begränsningarna i denna studie att patienter som inte hade visat terapeutiskt svar på mer än två klasser av migränförebyggande läkemedel exkluderades (Goadsby et al., 2017b). Vidare finns det kliniska studier som undersöker effektiviteten av fremanezumab (NCT02945046 och NCT02964338) och galcanezumab (NCT 02397473 och NCT02438826) i förebyggande av klusterhuvudvärk (se Israel et al., 2018), det vill säga primär huvudvärk som kännetecknas av svår ensidig smärta i det periorbitala området som åtföljs av tårar, konjunktival rodnad och rhinorré (Vollesen et al., 2018). Det visades faktiskt att kontinuerlig intravenös infusion via en infusionspump av 1,5 μg/min av CGRP i 20 minuter (under 2 dagar åtskilda av minst 7 dagar) till patienter med episodisk (aktiv eller remissionsfas) eller kronisk klusterhuvudvärk framkallade klusterliknande attacker hos patienter i aktiv fas eller med kronisk klusterhuvudvärk, men inte i remissionsfasen (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). De viktigaste PK-fördelarna med mAbs representeras av lång elimineringshalveringstid vilket begränsar behovet av daglig dosering och clearance genom proteolys. På grund av gepants effekter på levern och på grund av CGRP:s vasodilaterande egenskaper består de mest fruktade riskerna med hämning av CGRP-signalering i den hypoteserade hepatotoxiciteten och den kardiovaskulära teoretiska risken (Yuan et al., 2017). European Headache Federation (EHF) har tagit fram riktlinjer för användningen av anti-CGRP mAbs som tillämpar Grading of Recommendation, Assessment, Development and Evaluation (GRADE)-metoden och, när det inte är möjligt, förlitar sig på yttrandet från en expertpanel (Sacco et al., 2019).
Farmakokinetik (PK)/farmakodynamik (PD)-förhållandet mellan mAbs mot migrän
Utvecklingen av mAbs har representerat ett helt nytt tillvägagångssätt för att hämma CGRP-signaleringen. Den viktigaste PD-förbättringen som uppnås genom att använda mAbs istället för små molekyler är att det är lättare att rikta in sig på den breda CGRP-receptor-ligandbindningsstället (Taylor, 2018). De viktigaste PK-fördelarna med mAbs representeras av lång eliminationshalveringstid utan behov av daglig dosering och clearance genom proteolys och de mest fruktade riskerna med inhiberingen av CGRP-signalering består i den hypoteserade hepatotoxiciteten, på grund av gepants effekter på levern, och den kardiovaskulära teoretiska risken, på grund av de vasodilaterande egenskaperna hos CGRP. Det första hinder som dessa molekyler möter på vägen från produktion till måltavla är dock administrationen, eftersom de har en begränsad oral biotillgänglighet. Därför krävs en parenteral administreringsväg och för att gynna följsamhet till behandlingen måste halveringstiden vara lång (Taylor, 2018). Immunoglobuliner (Ig)G1, 2 eller 4 är möjligheterna (Wang et al., 2008; Taylor, 2018). Förutom IgG:s ursprung kan eventuell korsreaktivitet och individuella modifieringar av katabolismen påverka halveringstiden (Bonilla, 2008; Taylor, 2018). Den teknik som används för att producera mAbs bygger på användningen av hybridom som består av celler i kontinuerlig delning som producerar bestämda kloner av en enda typ av antikropp, med ingen eller låg variabilitet (Taylor, 2018). Baserat på ursprunget av de aminosyror som utgör mAb:n är det möjligt att skilja mellan chimära (immunisering av gnagare; upprätthållande av gnagarfragmentets antigenbindande region Fab, men införande av det mänskliga fragmentets kristalliserbara region Fc), humaniserade (zumabs, med musens Complementarity Determining Regions, CDR:s, som är ympade till mänskliga Fab-regioner) och humana (införande av hela sekvensen av den humana antikroppsgenen i musen som blir humaniserad, som till exempel XenoMouse) mAb:er (se Taylor, 2018). CDR:erna påverkar anpassningen till målet. Bland de fyra mAbs mot migrän är endast erenumab mänskligt, medan de ympade CDR:erna är från mus för fremanezumab, kanin för eptinezumab och sannolikt mus för galcanezumab (se Taylor, 2018). I synnerhet är det enda mAb mot CGRP-receptorn erenumab, som är ett humant IgG2λ, och de andra tre mAbs som är riktade mot platser för CGRP är: eptinezumab, ett genetiskt framställt humaniserat IgG1k; fremanezumab, ett humaniserat IgG2k; galcanezumab, ett humaniserat IgG4 (Edvinsson et al., 2018). Erenumab (Tmax 3-14 dagar) kräver månatlig subkutan administrering, liksom fremanezumab (Tmax 3-20 dagar) och galcanezumab (Tmax 7-14 dagar) (Taylor, 2018). Däremot administreras eptinezumab (Tmax 4,8 h) intravenöst en gång var tredje månad; det associerar snabbare och dissocierar långsammare än fremanezumab och galcanezumab. Eftersom mAbs är stora proteiner kan de inte lätt passera BBB. Vissa CGRP-receptorer befinner sig utanför BBB, vilket gör att anti-CGRP mAbs kan verka (Edvinsson, 2018). Före bindningen kommer antikroppen in i vaskulära endotelceller via pinocytos. Stora skenbara distributionsvolymer kan bero på vävnaden och den relaterade bindningskapaciteten hos mAb:n (Lobo et al., 2004; Taylor, 2018). Erenumab är det mest nya tillvägagångssättet, eftersom det är det enda som riktar sig mot ett fusionsprotein av de extracellulära domänerna av den humana G-proteinkopplade receptorn calcitoninreceptorliknande receptorn CALCRL (som krävs i receptorerna för CGRP och adrenomedullin) och RAMP1 inklusive CGRP-bindningsfickan (Edvinsson et al., 2018). Det har visats att det konkurrerande hämmar bindningen av -CGRP till den humana CGRP-receptorn i humana neuroblastomceller (SK-N-MC) med en Ki på 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab utövade en potent och fullständig antagonism av CGRP-stimulerad cAMP-ackumulering med en IC50 på 2,3 ± 0,9 nM i funktionella analyser utförda i SK-N-MC (Shi et al., 2016). Dessutom resulterade det 5000 gånger mer selektivt för CGRP-receptorn som inte visade någon agonistisk/antagonistisk effekt på andra receptorer i den humana kalcitoninfamiljen, inklusive adrenomedullin-, kalcitonin- och amylinreceptorer, upp till den högsta testade koncentrationen på 10 μM (Shi et al., 2016). Fremanezumab kan utöva sin effekt på olika kärl; faktum är att det orsakar koncentrationsberoende hämning av CGRP-inducerad vasodilatation i prekontraherade humana cerebrala, meningeala och perifera bukarterier (Ohlsson et al., 2018). Dessutom kan CGRP även verka på neuroner och gliaceller och på glymphatiska (lymfatiska), där de senare är inblandade i uttrycket av aura (se Messlinger, 2018). Den troliga avsaknaden av metabolism genom leverenzymer skulle kunna undvika läkemedelsinteraktioner. Eliminering sker genom renal proteolys av aminosyror. Även om kliniska prövningar rapporterar att dessa antikroppar överlag tolereras väl, bortsett från den framhävda smärtan vid injektionsstället, finns det oro för deras immunogenicitet genom produktion av ADA (Taylor, 2018). Under en dubbelblind, randomiserad, placebokontrollerad klinisk prövning (ClinicalTrials.gov NCT 01337596) som utvärderade behandlingen med olika regimer av enstaka och flera doser galcanezumab, uppvisade 11 av de behandlade patienterna (26 %) låga titrar (1:10 – 1:80) av behandlingsupptäckt ADA (hos 3 patienter ökade de redan existerande antikropparna i titer), utan att det fanns dosrespons och påvisade effekter på PK och PD (Monteith et al., 2017). Undersökningen av immunogenicitet är väsentlig eftersom närvaron av ADA kan påskynda läkemedelsborttagningen eller, värre, främja skador på slutorganen (Taylor, 2018). De viktigaste egenskaperna hos mAbs mot migrän sammanfattas i tabell 1.

Tabell 1. Huvudsakliga egenskaper hos fremanezumab, eptinezumab, galcanezumab och erenumab.
Slutsats
Migrän är ett handikappande och försvagande neurovaskulärt smärtsamt tillstånd som representerar mer än 90 % av fallen av återkommande huvudvärk och mot vilket tendensen kan vara ärftlig (MacGregor, 2017). Divalproexnatrium, natriumvalproat, topiramat, metoprolol, propranolol och timolol har visat starka bevis, nivå A, för migränprevention (American Academy of Neurology och American Headache Society, 2015). Alla klassiska orala förebyggande behandlingar, inklusive tricykliska antidepressiva, betablockerare, 5-HT2-antagonister ergot och antiepileptika, utvecklades dock inte för migrän och ger en 50-procentig minskning av antalet månadsdagar med migränsmärta endast upp till 45 % av migränpatienterna (D’Amico och Tepper, 2008), även på grund av låg följsamhet på grund av bristande tolerabilitet. Läkemedelsföljsamhet och avbrytande undersöktes i en retrospektiv amerikansk skadeanalys (Hepp et al., 2017) och resultaten tyder på låg följsamhet till det första använda läkemedlet och hög grad av avbrytande efter sex månader oberoende av läkemedelsklass. På grund av CGRP:s grundläggande roll för att upprätthålla neuroinflammation och central sensibilisering i vägen från trigeminusganglion och hjärnstammen till högre regioner som är involverade i migränens fysiopatologi har nya mAbs mot CGRP och dess receptor utvecklats. De första småmolekylära CGRP-antagonisterna visade sig inducera levertoxicitet, men mAbs producerade varken toxiska metaboliter eller kardiovaskulära biverkningar på grund av hämning av vasodilatation (se Deen et al., 2017). Centrala biverkningar lyftes inte heller fram. De potentiella långtidseffekterna av att blockera CGRP måste fortfarande studeras, men en grundläggande fördel med dessa antikroppar härrör från deras långa halveringstid som möjliggör månatliga eller mindre frekventa injektioner, vilket kan förbättra följsamheten till behandlingen och dess efterföljande effektivitet på ett anmärkningsvärt sätt (Deen et al., 2017). Anti-CGRP mAbs skulle således kunna utgöra effektiva verktyg i den terapeutiska arsenalen mot icke-responsiv migrän; det är dock obligatoriskt med en djupgående övervakning av effekt och säkerhet (dvs. produktion av toxiska metaboliter, immunogenicitet med ADA, neutraliserande antikroppar och vävnadskorsreaktivitet och biverkningar) (Taylor, 2018). Faktum är att bevis från äldre biotekniska produkter visar att terapier med mAbs mot tumörnekrosfaktor α (TNFα) kan utsättas för sekundärt misslyckande (i motsats till primära non-responders) av det initiala terapeutiska svaret eftersom dessa läkemedel inducerar produktion av antikroppar som kan bryta ned mAb:et men också neutralisera dess verkan innan det binder till målet (se Prado et al., 2017). Immunogeniciteten kan påverkas av glykosylering, typen av mAb, antalet epitoper och föroreningar i formuleringen (se Prado et al., 2017). Dessutom är flera till synes oförklarliga allvarliga biverkningar förknippade med immunogenicitet hos anti-TNFα. Lokala och systemiska överkänslighetsreaktioner, immunbrist med ökad infektionskänslighet och immunkomplexbildning som kan leda till och med till döden har lyfts fram (se Prado et al., 2017). Därför kan användningen av terapeutisk diagnostik (theranostics) förbättra kunskapen och korrekt hantering av dessa farmakologiska hjälpmedel (Bendtzen, 2013; Prado et al., 2017).
Författarbidrag
MTC, LAM, PT och GB utformade studien. DS samlade in försöksresultaten, analyserade litteraturen och skrev manuskriptet. AA, LR och MN deltog i litteraturstudien. Alla författare läste och godkände det slutliga manuskriptet.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
American Academy of Neurology och American Headache Society (2015). Bilaga a: Sammanfattning av evidensbaserad riktlinje för kliniker, uppdatering: farmakologisk behandling för förebyggande av episodisk migrän hos vuxna. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Personaliserad medicin: teranostik (terapeutisk diagnostik) nödvändig för rationell användning av tumörnekrosfaktor-alfa-antagonister. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmakokinetik för immunglobulin som administreras via intravenösa eller subkutana vägar. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Global, regional och nationell börda av migrän och huvudvärk av spänningstyp, 1990-2016: en systematisk analys för Global burden of disease study 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Profylax av migrän: allmänna principer och patientens acceptans. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Blockering av CGRP hos migränpatienter – en genomgång av för- och nackdelar. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: en randomiserad fas 3-studie av erenumab för episodisk migrän. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Extrakraniella kärlförändringar och smärtkällan vid migränhuvudvärk. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W. och Porreca, F. (2014). Målinriktning på TRP-kanaler för nya migränterapier. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). CGRP-receptorantagonister och antikroppar mot CGRP och dess receptor vid migränbehandling. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). CGRP-banan vid migrän som ett livskraftigt mål för terapier. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K. och Krause, D. N. (2018). CGRP som måltavla för nya migränterapier – framgångsrik översättning från bänk till klinik. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W. och Edvinsson, L. (2013). Differentiering av nervfibrer som lagrar CGRP och CGRP-receptorer i det perifera trigeminovaskulära systemet. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E. och Premkumar, L. S. (2012). Sumatriptan hämmar TRPV1-kanaler i trigeminala neuroner. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B. och Goadsby, P. J. (2001). Orala triptaner (serotonin 5-HT(1B/1D)-agonister) vid akut migränbehandling: en metaanalys av 53 försök. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Förebyggande effekter av galcanezumab hos vuxna patienter med episodisk eller kronisk migrän är bestående: data från de fas 3, randomiserade, dubbelblinda, placebokontrollerade studierna EVOLVE-1, EVOLVE-2 och REGAIN. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F. och Martelletti, P. (2017). Calcitonin gene-related peptide receptor som ett nytt mål för behandling av personer med episodisk migrän: aktuella bevis och säkerhetsprofil för erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A. och Martelletti, P. (2015). Nya läkemedel för behandling av migrän. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L. och Ekman, R. (1990). Frisättning av vasoaktiva peptider i den extracerebrala cirkulationen hos människor under migränhuvudvärk. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C. och Akerman, S. (2017a). Patofysiologi för migrän: en störning av sensorisk bearbetning. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). En kontrollerad studie av erenumab för episodisk migrän. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistens och bytesmönster av orala migränprofylaktiska läkemedel bland patienter med kronisk migrän: en retrospektiv skadeanalys. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomiserad, kontrollerad studie av telcagepant hos patienter med migrän och kranskärlssjukdom. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L. och Reuter, U. (2018). Monoklonala CGRP-antikroppar för förebyggande behandling av migrän. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M. och Martelletti, P. (2018). Nya läkemedel för migränbehandling: en uppdatering. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B. och Olesen, J. (2002). CGRP kan spela en orsakande roll vid migrän. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Farmakokinetik och farmakodynamik för antikroppar. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migrän. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC20170404040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). Tillämpningen av monoklonala CGRP(r)-antikroppar inom migränespektrum: behov och prioriteringar. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Den stora CGRP-floden – källor, sänkor och signalplatser i det trigeminovaskulära systemet. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Säkerhet, tolerabilitet, farmakokinetik och farmakodynamik för den CGRP-bindande monoklonala antikroppen LY2951742 (Galcanezumab) hos friska frivilliga. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). Fremanezumab blockerar CGRP-inducerad dilatation i humana cerebrala, mellersta meningeal- och bukarterier. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K. och Andrade, L. E. C. (2017). Biologiska anti-TNF-läkemedel: immunogenicitet som ligger till grund för behandlingssvikt och biverkningar. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X. och Brain, S. D. (2014). Calcitonin genrelaterad peptid: fysiologi och patofysiologi. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primära resultat av PROMISE-1-studien (prevention of migraine via intravenous eptinezumab safety and efficacy-1): en fas 3, randomiserad, dubbelblind, placebokontrollerad studie för att utvärdera effekten och säkerheten av eptinezumab för förebyggande av frekvent episodisk migrän (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Farmakologisk karakterisering av AMG 334, en potent och selektiv human monoklonal antikropp mot den kalcitonin genrelaterade peptidreceptorn. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K. och Yang, J. Y. (2018). Effekt och säkerhet av galcanezumab för förebyggande av episodisk migrän: resultat av den randomiserade kontrollerade kliniska fas 3-studien EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). Utvärdering av galcanezumab för förebyggande av episodisk migrän: den randomiserade kliniska studien EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R. och Katsarava, Z. (2018). Migrän är den första orsaken till funktionsnedsättning hos personer under 50 år: kommer hälsopolitikerna nu att uppmärksamma detta? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amylin, immunologi och huvudvärksmedicin. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Biomarkörer för migrän i cerebrospinalvätska: en systematisk genomgång och metaanalys. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Effekten av infusion av calcitonin genrelaterad peptid på klusterhuvudvärksattacker: en randomiserad klinisk studie. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R. och Hay, D. L. (2010). Reglering av signaltransduktion av calcitonin genrelaterade peptidreceptorer. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Farmakokinetik och farmakodynamik för monoklonala antikroppar. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogen neuroinflammation: inflammatoriska CNS-reaktioner som svar på neuronal aktivitet. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). Monoklonala CGRP-antikroppar mot migrän: motivering och framsteg. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar