Fysiska egenskaper hos joniska och kovalenta föreningar
I allmänhet har joniska och kovalenta föreningar olika fysiska egenskaper. Joniska föreningar bildar hårda kristallina fasta ämnen som smälter vid höga temperaturer och är resistenta mot avdunstning. Dessa egenskaper härrör från den karakteristiska inre strukturen hos en jonisk fast substans, som illustreras schematiskt i del (a) i figur 2.7.4 som visar den tredimensionella ordningen av omväxlande positiva och negativa joner som hålls samman av starka elektrostatiska attraktioner. Som visas i del (b) i figur 9.5.1 består de flesta kovalenta föreningar däremot av diskreta molekyler som hålls samman av jämförelsevis svaga intermolekylära krafter (krafterna mellan molekylerna), även om atomerna inom varje molekyl hålls samman av starka intramolekylära kovalenta bindningar (krafterna inom molekylen). Kovalenta ämnen kan vara gaser, vätskor eller fasta ämnen vid rumstemperatur och tryck, beroende på styrkan i de intermolekylära interaktionerna. Kovalenta molekylära fasta ämnen tenderar att bilda mjuka kristaller som smälter vid låga temperaturer och avdunstar lätt.
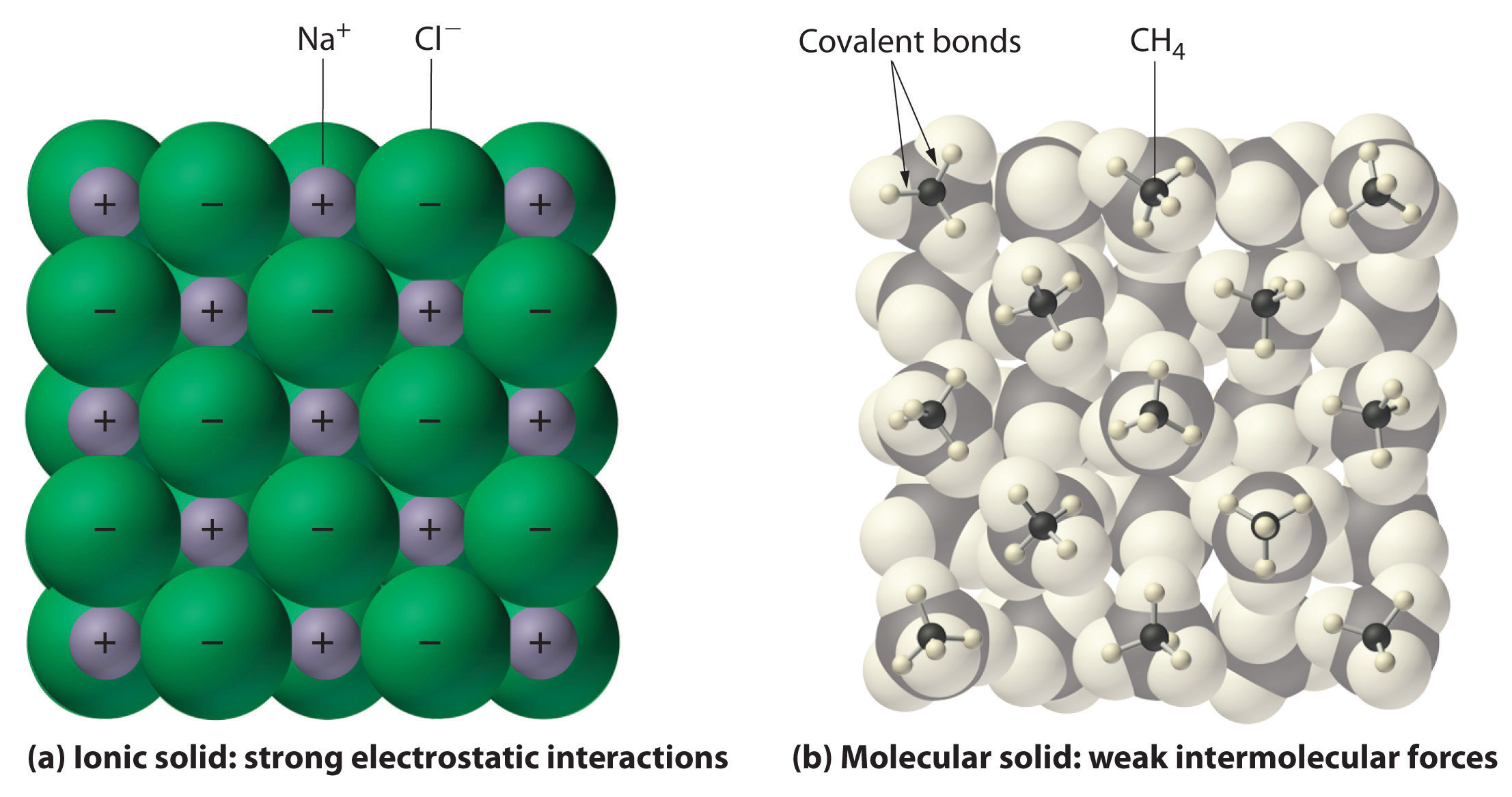
Figur 9.5.1: Interaktioner i joniska och kovalenta fasta ämnen. (a) De positivt och negativt laddade jonerna i en jonisk fast substans som t.ex. natriumklorid (NaCl) hålls samman av starka elektrostatiska interaktioner. (b) I denna representation av packningen av metanmolekyler (\(CH_4\)) i fast metan, en prototypisk molekylär fast substans, hålls metanmolekylerna samman i fast substans endast av relativt svaga intermolekylära krafter, trots att atomerna i varje metanmolekyl hålls samman av starka kovalenta bindningar.
Kolväten
Molekylära fasta ämnen består av atomer eller molekyler som hålls ihop med varandra genom dipol-dipolinteraktioner, Londons dispersionskrafter eller vätebindningar, eller någon kombination av dessa. Molekylernas arrangemang i fast bensen är följande:

Figur 9.5.2: Strukturen hos fast bensen. I fast bensen är molekylerna inte arrangerade med sina plan parallellt med varandra utan i 90° vinklar.
Då de intermolekylära interaktionerna i en molekylär fast substans är relativt svaga jämfört med joniska och kovalenta bindningar, tenderar molekylära fasta substanser att vara mjuka, lågt smältande och lätt förångade (\(ΔH_{fus}\) och \(ΔH_{vap}\) är låga). För liknande ämnen ökar styrkan hos Londons dispersionskrafter jämnt med ökande molekylmassa. Exempelvis är smältpunkterna för bensen (C6H6), naftalen (C10H8) och antracen (C14H10), med en, två och tre kondenserade aromatiska ringar, 5,5 °C, 80,2 °C respektive 215 °C. Fusionsenthalpierna ökar också jämnt inom serien: bensen (9,95 kJ/mol) < naftalen (19,1 kJ/mol) < antracen (28,8 kJ/mol). Om molekylerna har former som inte kan packas ihop effektivt i kristallen tenderar dock smältpunkterna och fusionsenthalpierna att bli oväntat låga eftersom molekylerna inte kan ordna sig så att intermolekylära interaktioner optimeras. Således har toluen (C6H5CH3) och m-xylen smältpunkter på -95°C respektive -48°C, vilket är betydligt lägre än smältpunkten för den lättare men mer symmetriska analogen bensen.
Självläkande gummi är ett exempel på en molekylär fast substans med potential för betydande kommersiella tillämpningar. Materialet kan sträcka sig, men när det knäcks i bitar kan det binda ihop sig igen genom att återupprätta sitt vätebindningsnätverk utan att visa några tecken på svaghet. Bland andra tillämpningar studeras det för användning i lim och cykeldäck som läker sig själva.

Figur 9.5.3: Toluen och m-xylen. Metylgrupperna som är knutna till fenylringen i toluen och m-xylen förhindrar att ringarna packar ihop sig lika bra som i fast bensen.