24-6C Reaktioner av nitroföreningar
Nitroföreningar är ganska instabila i termodynamisk bemärkelse; t.ex. är nedbrytningsvärmen för nitrometan, enligt följande stökiometri, \(67.4 \: \text{kcal mol}^{-1}\).
\
Den avsevärda energin och de snabba hastigheterna hos reaktioner som denna utnyttjas vid kommersiell användning av nitroföreningar som sprängämnen. För vissa nitroföreningar, t.ex. TNT, finns ytterligare en fördel i form av låg stötkänslighet.
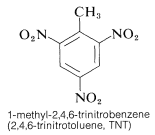
TNT detonerar inte så lätt vid en enkel stöt och brinner till och med utan att explodera. När detonationen väl startar fortplantar sig dock nedbrytningen snabbt. Egenskaperna rimlig hanteringsstabilitet och hög termodynamisk potential gör nitroföreningar särskilt användbara. Andra polynitroföreningar som är användbara som sprängämnen är PETN (avsnitt 17-3C), cyklonit (avsnitt 16-4C), pikrinsyra och tetryl:
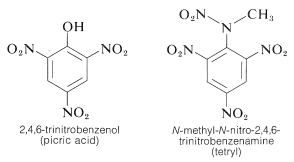
En viktig egenskap hos aromatiska polynitroföreningar är deras förmåga att bilda ”laddningsöverförings ”komplex med aromatiska kolväten, särskilt sådana som är substituerade med alkylgrupper. Komplex av 2,4,6-trinitrobenzenol (pikrinsyra) och aromatiska kolväten är ofta kristallina fasta ämnen som är användbara för separation, rening och identifiering av aromatiska kolväten. Dessa ämnen kallas ”kolvätepikrater”, men namnet är missvisande eftersom de egentligen inte är salter. Dessutom bildas liknande komplex mellan aromatiska kolväten och trinitrobenzen, vilket visar att det är nitrogrupperna snarare än hydroxylgruppen som är avgörande för komplexbildningen. Bindningen i dessa komplex liknar den i \(\pi\)-komplex av halogener med alkener och bensen (avsnitt 22-4D och 10-3C) och beror på attraktiva krafter mellan elektronrika och elektronfattiga ämnen. Det beskrivande namnet – laddningsöverföringskomplex – antyder att komplexet har VB-strukturer som innebär överföring av en elektron från donatormolekylen (elektronrik molekyl) till acceptatormolekylen (elektronfattig molekyl). Namnet \(\pi\)-komplex används också eftersom minst en komponent i komplexet vanligtvis har ett \(\pi\)-elektronsystem. Laddningsöverförings- eller \(\pi\)-komplex mellan polynitroföreningar och aromatiska kolväten tycks ge sandwichliknande strukturer med de aromatiska ringarna i parallella plan, även om de inte nödvändigtvis är centrerade exakt över varandra:
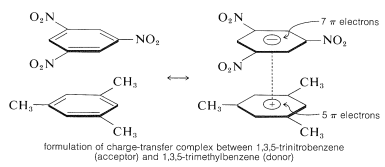
Laddningsöverföringskomplex är nästan alltid mer högfärgade än deras enskilda komponenter. Ett spektakulärt exempel är bensen och tetracyanoeten, som var och en för sig är färglösa, men som ger ett starkt orangefärgat komplex när de blandas. En förskjutning mot längre våglängder av absorptionen, i förhållande till deras komponenter, är att vänta för laddningsöverföringskomplex på grund av den ökade möjligheten till stabilisering av det exciterade tillståndet genom elektrondelokalisering som involverar båda komponenterna.
Reduktion av nitroföreningar sker lätt med en mängd olika reduktionsmedel och sådana reduktioner ger möjlighet till en särskilt användbar syntes av aromatiska aminer (avsnitt 23-12B):
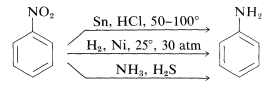
Reduktionen av en nitroförening till en amin kräver sex ekvivalenter av reduktionsmedlet:
\
Man skulle inte förvänta sig att en sådan reduktion sker i ett enda steg. Reduktionen sker i själva verket stegvis och genom en rad intermediärer som, med starka reduktionsmedel i sur lösning, har högst en övergående existens. De mellanprodukter som bildas successivt från \(\ce{RNO_2}\) med två ekvivalenter reduktionsmedel är nitrosoföreningar, \(\ce{R-N=O}\), och \(\ce{N}\)-substituerade azanoler (hydroxylaminer), \(\ce{RNHOH}\):
\}{\longrightarrow}}} \ce{RN=O} \overset{2 \left}{\longrightarrow} \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}\]
Så kan \(\ce{N}\)-arylsubstituerade azanoler erhållas direkt från motsvarande nitroföreningar med zink- och ammoniumkloridlösning. Zink och saltsyra ger dock amin:
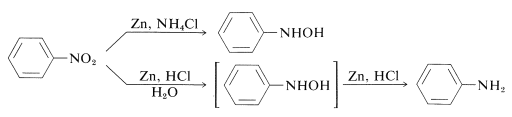
Skillnaden mellan dessa reaktioner ligger i reduktionshastigheten i samband med lösningens surhet. Ammoniumklorid är en mycket svagare syra än \(\ce{HCl}\); pH-värdet för ammoniumkloridlösningar är omkring 6.
Oxidation av \(\ce{N}\)-arylazanoler under kontrollerade förhållanden ger nitrosoföreningar. Denna reaktion är inte olik oxidationen av alkoholer till ketoner (avsnitt 15-6B):
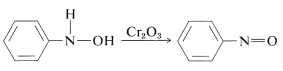
Reduktion av arylnitroföreningar med mindre kraftfulla reduktionsmedel, särskilt i alkaliska medier, ger vad som kan tyckas vara ett mystiskt konglomerat av bimolekylära reduktionsprodukter. Till exempel med nitrobenzen,
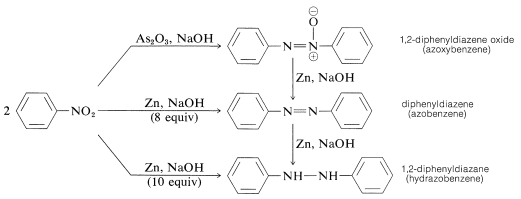
Alla dessa ämnen kan reduceras till bensenamin med tenn och saltsyra. Alla kan därför vara, men är inte nödvändigtvis, en mellanprodukt vid reduktionen av nitroföreningar till aminer. Bildandet av de bimolekylära reduktionsprodukterna är resultatet av basinducerade reaktioner mellan nitroföreningar och azanoler eller aminer och eventuellt ytterligare reduktion av de ursprungligen producerade ämnena.
Vissa polynitrobenzenderivat har viktiga herbicidala användningsområden. Exempel är \(\ce{N}^3\), \(\ce{N}^3\)-dietyl-6-trifluormetyl-2,4-dinitro-1,3-benzendiamin och \(\ce{N}\),\(\(\ce{N}\)-dipropyl-4-trifluormetyl-2,6-dinitrobenzenamin:
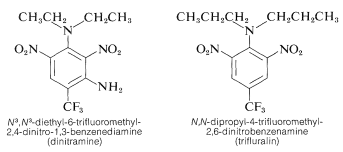
Dessa ämnen dödar ogräsfröplantor när de blandas med jord, men inte kulturväxter som bomull, sojabönor och jordnötter. Aktiviteten är hög; normalt krävs endast ca \(0,08 \(0,08 \: \text{g m}^{-2}\) för god ogräsbekämpning.
De viktigaste reaktionerna av nitroalkaner är de som involverar \(\alpha\) väteämnena i de primära och sekundära föreningarna. Nitrometan är till exempel tillräckligt surt för att lösas upp i vattenhaltiga hydroxidlösningar. Den anjon som bildas på detta sätt har en elektronisk struktur som är analog med nitratanjonen:
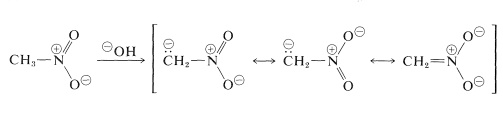
En intressant egenskap hos denna jon är att när lösningar av den försuras bildas en instabil, ganska starkt sur isomer av nitrometan (kallad aci-formen), som långsamt återgår till den mer stabila nitroformen:
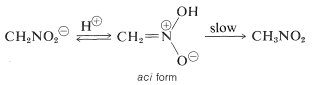
Samma förändringar sker vid försurning av enolsaltet av en karbonylförening, där den huvudsakliga skillnaden är den mycket längre livslängden för aci-nitroföreningen jämfört med den för en enol av en enkel keton (se avsnitt 17-1B).
Primära och sekundära nitroföreningar genomgår aldoladditioner och Michaeladditioner med lämpliga karbonylföreningar och basiska katalysatorer:
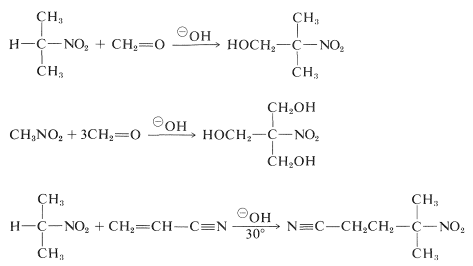
Olyckligtvis är alkyleringsreaktioner som är analoga med den baskatalyserade alkyleringen av karbonylföreningar i allmänhet inte användbara för syntesen av högre nitroföreningar, eftersom \(\ce{C}\)-alkylering av de konjugerade baserna av primära nitroföreningar är långsammare än \(\ce{O}\)-alkylering.