
Wpisz tutaj swoje przykłady.
- 9.1 Molekuły sygnalizacyjne i receptory komórkowe
- 9.2 Propagacja sygnału
- 9.3 Odpowiedź na sygnał
Wyobraź sobie, jak wyglądałoby życie, gdybyś ty i ludzie wokół ciebie nie mogli się komunikować. Nie mógłbyś wyrażać innym swoich życzeń, ani zadawać pytań, aby dowiedzieć się więcej o swoim środowisku. Organizacja społeczna zależy od komunikacji między jednostkami, które składają się na to społeczeństwo.
Jak z ludźmi, to jest istotne dla poszczególnych komórek, aby być w stanie współdziałać z ich środowiska i ze sobą. Jest to prawda, czy komórka rośnie sama w stawie lub jest jedną z wielu komórek, które tworzą większy organizm. W celu prawidłowego reagowania na bodźce zewnętrzne, komórki rozwinęły złożone mechanizmy komunikacji, aby mogły odbierać wiadomości, przekazywać informacje przez błonę plazmatyczną, a następnie wytwarzać zmiany w komórce w odpowiedzi na wiadomość.
W organizmach wielokomórkowych, komórki stale wysyłają i odbierają wiadomości chemiczne, aby koordynować działania innych narządów, tkanek i komórek. Zdolność do wysyłania wiadomości szybko i skutecznie umożliwia komórkom koordynować i dostroić swoje funkcje. Podczas gdy konieczność komunikacji komórkowej w większych organizmach wydaje się oczywista, nawet organizmy jednokomórkowe komunikują się między sobą. Komórki drożdży sygnalizują się nawzajem, aby ułatwić sobie kojarzenie. Niektóre formy bakterii koordynują swoje działania, aby tworzyć duże kompleksy zwane biofilmami lub aby zorganizować produkcję toksyn w celu usunięcia konkurencyjnych organizmów. Zdolność komórek do komunikowania się za pomocą sygnałów chemicznych powstała w pojedynczych komórkach i była niezbędna do ewolucji organizmów wielokomórkowych. Wydajna, bezbłędna komunikacja jest niezbędna dla całego życia.
- 9.1 | Molekuły sygnalizacyjne i receptory komórkowe
- 9.1.1 Formy sygnalizacji
- Sygnalizacja parakrynna
- Sygnalizacja autokrynna
- Sygnalizacja endokrynna
- Sygnalizacja bezpośrednia
- 9.1.2 Rodzaje receptorów
- Receptory wewnętrzne
- Receptory powierzchni komórki
- 9.1.3 Molekuły sygnalizacyjne
- Małe ligandy hydrofobowe
- Ligandy rozpuszczalne w wodzie
- 9.2 | Propagacja sygnału
- 9.2.1 Ścieżki sygnałowe i wzmacnianie sygnału
- 9.2.2 Metody sygnalizacji wewnątrzkomórkowej
- Fosforylacja
- Second Messengers
- 9.3 | Odpowiedź na sygnał
- 9.3.1 Odpowiedzi na szlak sygnałowy
- Ekspresja genów
- Wzrost metabolizmu komórkowego
- Wzrost komórek
- Śmierć komórki
- 9.3.2 Zakończenie szlaków sygnałowych
9.1 | Molekuły sygnalizacyjne i receptory komórkowe
Do końca tego rozdziału będziesz w stanie:
- Opisać cztery typy sygnalizacji występujące w organizmach wielokomórkowych.
- Porównać receptory wewnętrzne z receptorami na powierzchni komórki.
- Rozpoznać związek między chemią liganda a jego mechanizmem działania.
W świecie żywych komórek istnieją dwa rodzaje komunikacji. Komunikacja między komórkami nazywana jest sygnalizacją międzykomórkową, a komunikacja w obrębie komórki nazywana jest sygnalizacją wewnątrzkomórkową. Łatwym sposobem na zapamiętanie tego rozróżnienia jest zrozumienie, że przedrostek inter- oznacza „pomiędzy” (autostrada międzystanowa przecina stany), a intra- oznacza „wewnątrz” (IV oznacza dożylnie lub „wewnątrz żyły”).
Sygnały chemiczne są uwalniane przez komórkę sygnalizującą i odbierane przez komórkę docelową. Komórki docelowe mają białka zwane receptorami, które wiążą się z cząsteczkami sygnalizacyjnymi i powodują odpowiedź. Cząsteczki sygnalizujące, które wiążą się z receptorami nazywane są ligandami. Ligandy i receptory są specyficzne dla siebie nawzajem; receptor zazwyczaj wiąże się tylko z określonym ligandem. Istnieją jednak różne rodzaje sygnalizacji.
9.1.1 Formy sygnalizacji
W organizmach wielokomórkowych występują cztery kategorie sygnalizacji chemicznej: sygnalizacja autokrynna, sygnalizacja parakrynna, sygnalizacja endokrynna i bezpośrednia sygnalizacja przez połączenia szczelinowe (rysunek 9.2). Główną różnicą między różnymi kategoriami sygnalizacji jest odległość, jaką pokonuje sygnał, aby dotrzeć do komórki docelowej.
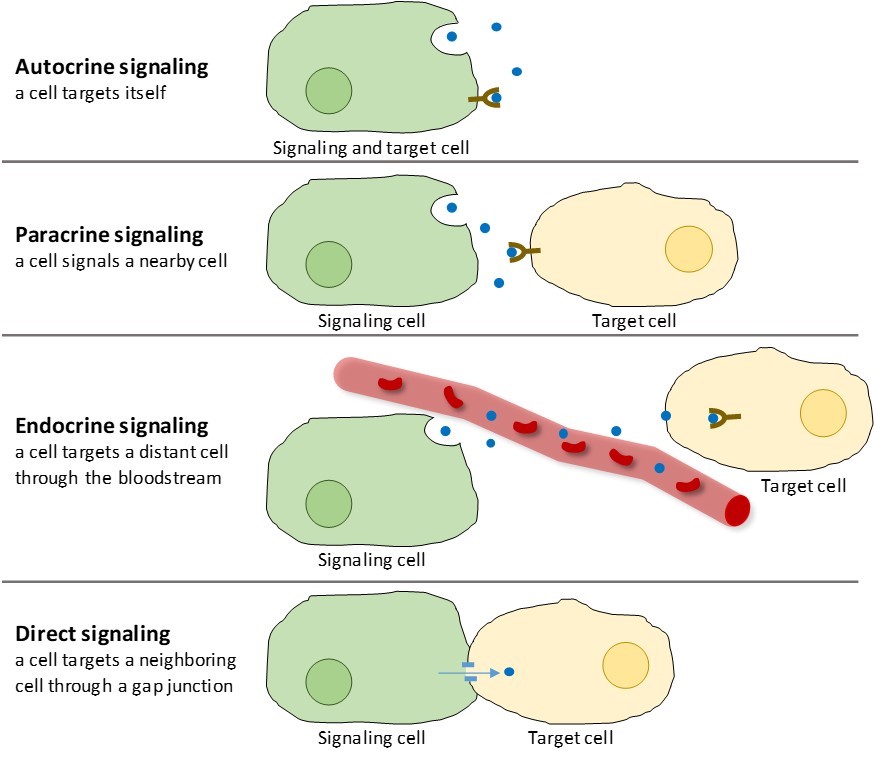
Sygnalizacja parakrynna
Sygnały, które działają lokalnie między komórkami, które są blisko siebie, są nazywane sygnałami parakrynnymi. Sygnały parakrynne przemieszczają się poprzez dyfuzję przez macierz zewnątrzkomórkową (rysunek 9.2). Tego typu sygnały zwykle wywołują szybkie odpowiedzi, które trwają tylko przez krótki czas. Aby utrzymać odpowiedź w miejscu, ligandy parakrynne są zwykle szybko degradowane przez enzymy lub usuwane przez sąsiednie komórki. Usunięcie sygnałów przywraca gradient stężenia dla cząsteczek sygnałowych, umożliwiając im szybką dyfuzję przez przestrzeń wewnątrzkomórkową, jeśli zostaną ponownie uwolnione.
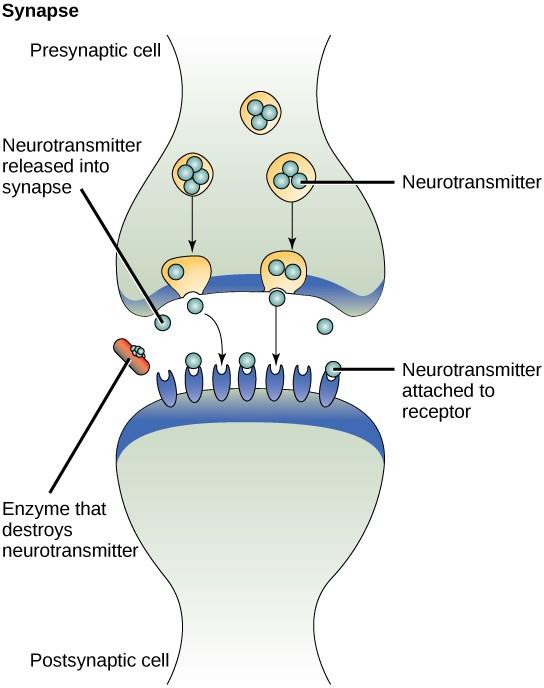
Jednym z przykładów sygnalizacji parakrynnej jest przekazywanie sygnałów między komórkami nerwowymi. Maleńka przestrzeń między komórkami nerwowymi, w której dochodzi do przekazywania sygnałów, nazywana jest synapsą. Sygnały są propagowane wzdłuż komórek nerwowych przez szybko poruszające się impulsy elektryczne. Kiedy impulsy te docierają do końca jednej komórki nerwowej, komórka presynaptyczna (komórka wysyłająca sygnał) uwalnia do synapsy chemiczne ligandy zwane neuroprzekaźnikami. Neuroprzekaźniki rozpraszają się po synapsie (rysunek 9.3). Mała odległość między komórkami nerwowymi pozwala na szybkie przemieszczanie się sygnału, co umożliwia natychmiastową reakcję, np. „zdejmij rękę z pieca!”. Gdy neuroprzekaźnik zwiąże się z receptorem na powierzchni komórki postsynaptycznej, uruchomiony zostaje kolejny impuls elektryczny. Neuroprzekaźniki są degradowane szybko lub są ponownie wchłaniane przez komórkę presynaptyczną, tak że komórka nerwowa odbiorcy może szybko odzyskać siły i być przygotowana do szybkiej odpowiedzi na następny sygnał synaptyczny.
Sygnalizacja autokrynna
Gdy komórka odpowiada na własną cząsteczkę sygnalizacyjną, nazywa się to sygnalizacja autokrynna (auto = „sam”). Sygnalizacja autokrynna często występuje z innymi typami sygnalizacji. Na przykład, gdy uwalniany jest sygnał parakrynny, komórka sygnalizująca może odpowiedzieć na sygnał wraz ze swoimi sąsiadami (rysunek 9.2).
Sygnalizacja autokrynna często występuje podczas wczesnego rozwoju organizmu, aby zapewnić, że komórki rozwijają się w prawidłowe tkanki. Sygnalizacja autokrynna reguluje również odczuwanie bólu i reakcje zapalne. Ponadto, jeśli komórka jest zainfekowana wirusem, może ona zasygnalizować, że poddaje się programowanej śmierci komórki, zabijając wirusa w procesie.
Sygnalizacja endokrynna
Sygnały z odległych komórek są nazywane sygnałami endokrynnymi i pochodzą z komórek endokrynnych. (W organizmie, wiele komórek endokrynnych znajduje się w gruczołach dokrewnych, takich jak tarczyca, podwzgórze i przysadka mózgowa). Sygnały tego typu zwykle wywołują wolniejszą reakcję, ale mają bardziej długotrwały efekt. Ligandy uwalniane w sygnalizacji endokrynnej nazywane są hormonami, cząsteczkami sygnalizującymi, które są produkowane w jednej części ciała, ale wpływają na inne regiony ciała w pewnej odległości (rysunek 9.2).
Hormony pokonują duże odległości między komórkami endokrynnymi a komórkami docelowymi za pośrednictwem krwiobiegu, który jest stosunkowo powolnym sposobem przemieszczania się po organizmie. Ze względu na ich formę transportu, hormony dostać rozcieńczony i są obecne w niskich stężeniach, gdy działają na ich komórek docelowych. Różni się to od sygnalizacji parakrynnej, w której lokalne stężenia cząsteczek sygnalizacyjnych mogą być bardzo wysokie.
Sygnalizacja bezpośrednia
Złącza szczelinowe u zwierząt i plazmodesmy u roślin to połączenia między błonami plazmatycznymi sąsiadujących komórek. Te wypełnione wodą kanały pozwalają na dyfuzję małych cząsteczek sygnałowych pomiędzy dwoma komórkami. Małe cząsteczki, takie jak jony wapnia (Ca2+), są w stanie przemieszczać się między komórkami, ale duże cząsteczki, takie jak białka i DNA, nie mogą przejść przez kanały. Specyficzność kanałów zapewnia, że komórki pozostają niezależne, ale mogą szybko i łatwo przekazywać sygnały. Bezpośrednia sygnalizacja pozwala grupie komórek skoordynować ich odpowiedź na sygnał, który mogła otrzymać tylko jedna z nich. U roślin plazmodesmy są wszechobecne, czyniąc z całej rośliny gigantyczną sieć komunikacyjną.
9.1.2 Rodzaje receptorów
Receptory to cząsteczki białka w komórce docelowej lub na jej powierzchni, które wiążą się z ligandami. Istnieją dwa rodzaje receptorów, receptory wewnętrzne i receptory na powierzchni komórki.
Receptory wewnętrzne
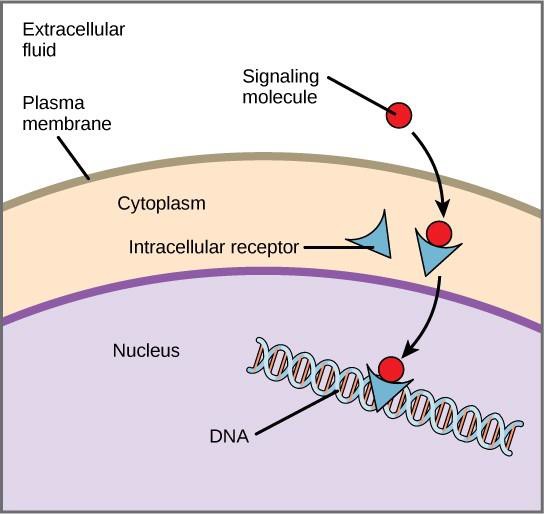
Receptory wewnętrzne, znane również jako receptory wewnątrzkomórkowe lub cytoplazmatyczne, znajdują się w cytoplazmie komórek docelowych i reagują na hydrofobowe cząsteczki ligandów, które są w stanie przemieszczać się przez błonę plazmatyczną. Po wejściu do komórki wiele z tych cząsteczek wiąże się z białkami, które działają jako regulatory syntezy mRNA (transkrypcji) w celu pośredniczenia w ekspresji genów.
Ekspresja genów jest komórkowym procesem przekształcania informacji w DNA komórki w sekwencję aminokwasów, która ostatecznie tworzy białko. Kiedy ligand wiąże się z wewnętrznym receptorem, wywołana zostaje zmiana konformacyjna, która odsłania miejsce wiążące DNA na białku receptora. Kompleks ligand-receptor przemieszcza się do jądra, a następnie wiąże się ze specyficznymi regionami regulatorowymi chromosomalnego DNA i promuje inicjację transkrypcji (rysunek 9.4). Transkrypcja jest procesem kopiowania informacji zawartych w DNA komórki do specjalnej formy RNA zwanej messenger RNA (mRNA); komórka wykorzystuje informacje zawarte w mRNA do łączenia określonych aminokwasów w odpowiedniej kolejności, tworząc białko. Tak więc, gdy ligand wiąże się z wewnętrznym receptorem, może bezpośrednio wpływać na ekspresję genów w komórce docelowej.
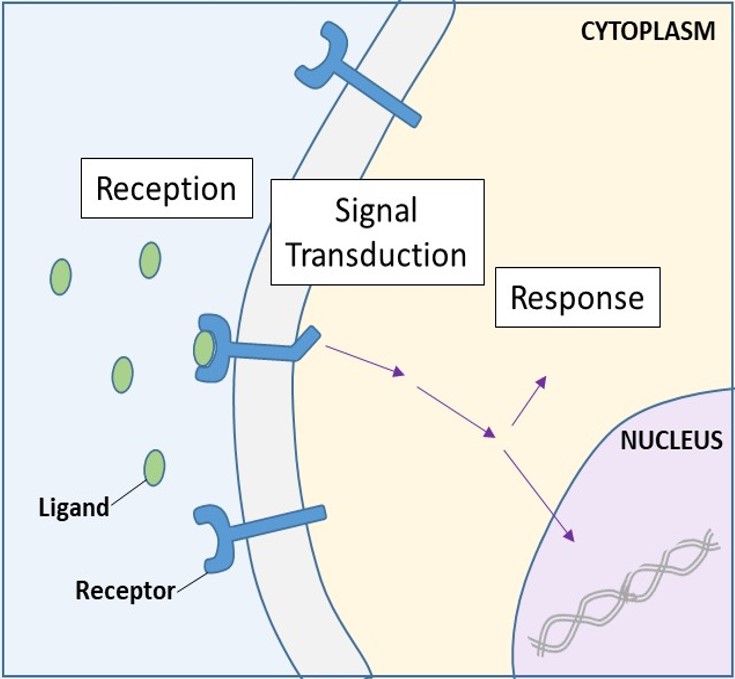
Receptory powierzchni komórki
Receptory powierzchni komórki, znane również jako receptory transmembranowe, są integralnymi białkami, które wiążą się z zewnętrznymi cząsteczkami sygnalizacyjnymi. Receptory te rozciągają się na błonę plazmatyczną i dokonują transdukcji sygnału, w której sygnał zewnątrzkomórkowy jest przekształcany w sygnał międzykomórkowy. (Rysunek 9.5). Ponieważ białka receptorowe powierzchni komórki mają fundamentalne znaczenie dla normalnego funkcjonowania komórki, nie powinno dziwić, że nieprawidłowe działanie któregokolwiek z tych białek może mieć poważne konsekwencje. Wykazano, że błędy w strukturze białek niektórych cząsteczek receptorowych odgrywają rolę w nadciśnieniu (wysokim ciśnieniu krwi), astmie, chorobach serca i nowotworach.
Każdy receptor na powierzchni komórki ma trzy główne elementy: zewnętrzną domenę wiążącą ligand lub domenę zewnątrzkomórkową; hydrofobowy region rozprzestrzeniający się w błonie oraz domenę wewnątrzkomórkową. Receptory powierzchniowe biorą udział w większości procesów sygnalizacyjnych w organizmach wielokomórkowych. Istnieją trzy ogólne kategorie receptorów powierzchni komórki: receptory związane z enzymami, receptory związane z kanałami jonowymi i receptory związane z białkami G.
Receptory związane z enzymami to receptory powierzchni komórki z domenami wewnątrzkomórkowymi, które są związane z enzymem. W niektórych przypadkach domena wewnątrzkomórkowa samego receptora jest enzymem. Inne receptory związane z enzymami mają małą domenę wewnątrzkomórkową, która oddziałuje bezpośrednio z enzymem. Receptory związane z enzymami zwykle mają duże domeny zewnątrzkomórkowe i wewnątrzkomórkowe, ale region rozprzestrzeniający się w błonie składa się z pojedynczej helisy alfa w nici peptydowej.
Gdy ligand wiąże się z zewnątrzkomórkową domeną receptora związanego z enzymami, sygnał jest przenoszony przez błonę, aktywując enzym. Aktywacja enzymu uruchamia łańcuch zdarzeń w komórce, który ostatecznie prowadzi do odpowiedzi.
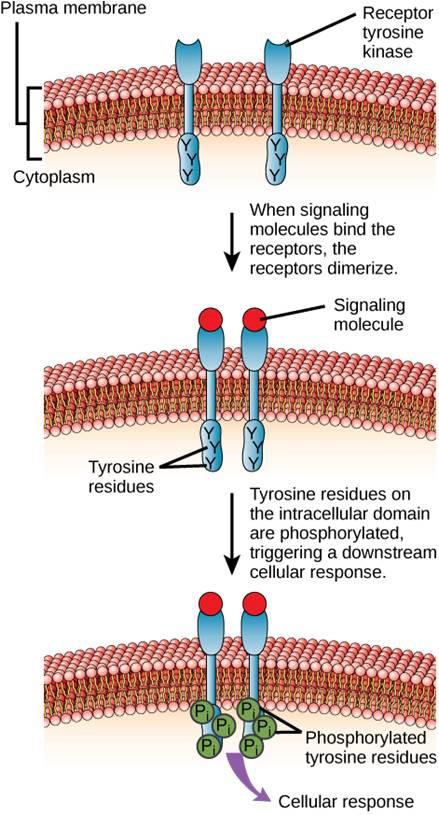
Jednym z przykładów receptora związanego z enzymem jest receptor kinazy tyrozynowej (rysunek 9.6). Kinaza jest enzymem, który przenosi grupy fosforanowe z ATP na inne białko. Receptor kinazy tyrozynowej przenosi grupy fosforanowe na cząsteczki tyrozyny. Najpierw cząsteczki sygnalizujące wiążą się z zewnątrzkomórkową domeną dwóch pobliskich receptorów kinazy tyrozynowej. Następnie dwa sąsiadujące receptory łączą się ze sobą, czyli dimeryzują. Następnie fosforany są dodawane do reszt tyrozynowych w domenie wewnątrzkomórkowej receptorów (fosforylacja). Fosforylowane reszty mogą następnie przekazać sygnał do następnego posłańca w cytoplazmie.
Receptory naskórkowego czynnika wzrostu są przykładem receptorowych kinaz tyrozynowych, które podążają tym trybem sygnalizacji. Defekty w sygnalizacji ErbB w tej rodzinie mogą prowadzić do chorób nerwowo-mięśniowych, takich jak stwardnienie rozsiane i choroba Alzheimera.
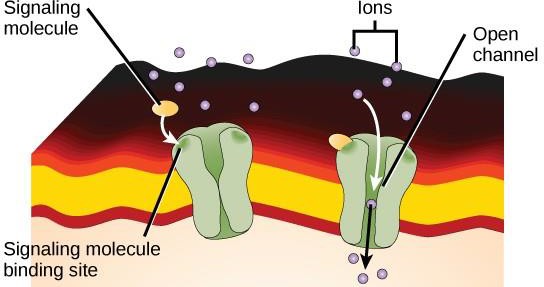
Receptory związane z kanałami jonowymi wiążą się z ligandem i otwierają kanał przez błonę, który pozwala na przejście określonych jonów. Ten typ receptora powierzchni komórki ma rozległy region rozprzestrzeniający się w błonie z hydrofobowymi aminokwasami. I odwrotnie, aminokwasy, które pokrywają wnętrze kanału są hydrofilowe, aby umożliwić przepływ jonów. Kiedy ligand wiąże się z zewnątrzkomórkowym regionem kanału, następuje zmiana konformacyjna w strukturze białka, która umożliwia przejście jonów takich jak sód, wapń, magnez lub wodór (rysunek 9.7).
Receptory związane z białkiem G wiążą się z ligandem i aktywują związane z nim białko G. Następnie aktywowane białko G oddziałuje z nim. Aktywowane białko G oddziałuje następnie z pobliskim białkiem błonowym, którym może być kanał jonowy lub enzym (rysunek 9.8). Wszystkie receptory związane z białkiem G mają siedem domen transmembranowych, ale każdy receptor ma specyficzną domenę zewnątrzkomórkową i miejsce wiązania z białkiem G.
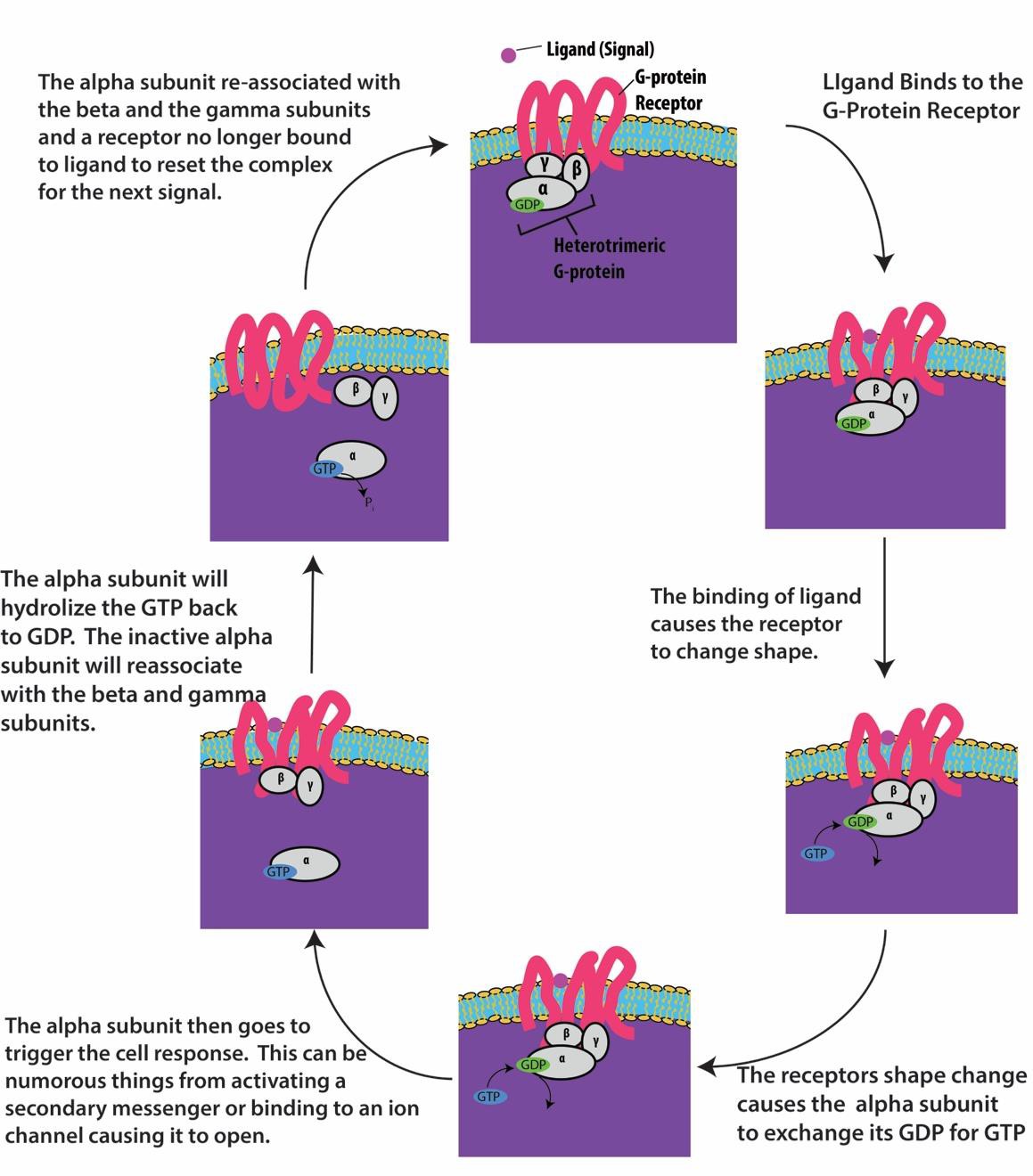
Sygnalizacja komórkowa za pomocą receptorów powiązanych z białkami G zachodzi jako cykl. Gdy ligand zwiąże się z receptorem, wynikająca z tego zmiana kształtu aktywuje białko G, które uwalnia GDP i odbiera GTP. Następnie podjednostki białka G rozdzielają się na podjednostki α i βγ. Jeden lub oba te fragmenty białka G mogą być zdolne do aktywacji innych białek w komórce. Po pewnym czasie GTP na aktywnej podjednostce α białka G jest hydrolizowany do GDP, a podjednostka βγ ulega dezaktywacji. Podjednostki ponownie się asocjują, tworząc nieaktywne białko G i cykl zaczyna się od nowa (rysunek 9.8).
Receptory związane z białkiem G są wykorzystywane w wielu procesach fizjologicznych, w tym do transdukcji wizji, smaku oraz regulacji układu odpornościowego i stanu zapalnego.

HER2 jest receptorową kinazą tyrozynową. W 30 procentach ludzkich raków piersi, HER2 jest stale aktywowany, co powoduje nieuregulowany podział komórek. Lapatynib, lek stosowany w leczeniu raka piersi, hamuje proces, w którym receptor ulega fosforylacji, zmniejszając w ten sposób wzrost guza o 50 procent. Który z następujących etapów zostałby zahamowany przez lapatynib?
- Wiązanie cząsteczek sygnałowych, dimeryzacja i odpowiedź komórkowa
- Dimeryzacja i odpowiedź komórkowa
- Odpowiedź komórkowa
- Aktywność fosfatazy, dimeryzacja i odpowiedź komórkowa
9.1.3 Molekuły sygnalizacyjne
Produkowane przez komórki sygnalizacyjne, ligandy są sygnałami chemicznymi, które wędrują do komórek docelowych i wywołują odpowiedź. Rodzaje cząsteczek, które służą jako ligandy są niezwykle zróżnicowane i wahają się od małych białek do małych jonów. Ligandy są kategoryzowane jako małe ligandy hydrofobowe, które mogą przekraczać błony plazmatyczne, lub ligandy rozpuszczalne w wodzie, które nie mogą tego robić.
Małe ligandy hydrofobowe
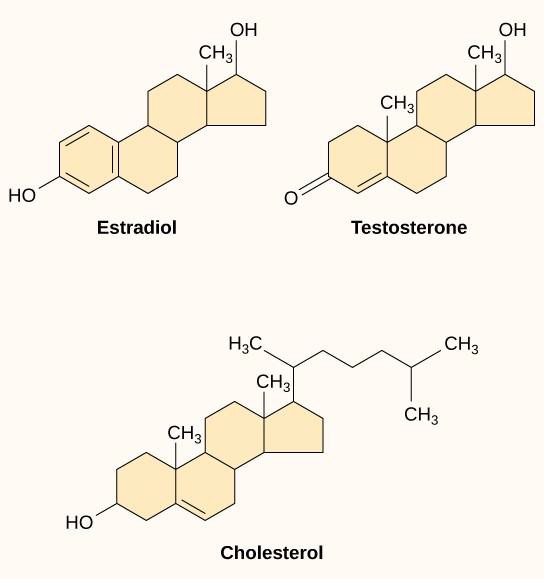
Małe ligandy hydrofobowe, zwane również ligandami rozpuszczalnymi w lipidach, mogą bezpośrednio dyfundować przez błonę plazmatyczną i oddziaływać z wewnętrznymi receptorami. Ważnymi przedstawicielami tej klasy ligandów są hormony steroidowe. Steroidy są lipidami, które mają szkielet węglowodorowy z czterema połączonymi pierścieniami; różne steroidy mają różne grupy funkcyjne dołączone do szkieletu węglowego. Hormony steroidowe obejmują żeński hormon płciowy estradiol, który jest rodzajem estrogenu; męski hormon płciowy testosteron; oraz cholesterol, który jest ważnym składnikiem strukturalnym błon biologicznych i prekursorem hormonów steroidowych (rysunek 9.10). Do innych hydrofobowych hormonów należą hormony tarczycy i witamina D. Aby być rozpuszczalnymi we krwi, hydrofobowe ligandy muszą wiązać się z białkami nośnikowymi podczas transportu przez krwiobieg.
Ligandy rozpuszczalne w wodzie
Ponieważ ligandy rozpuszczalne w wodzie są polarne, nie mogą bez pomocy przejść przez błonę plazmatyczną. Czasami są one zbyt duże, aby w ogóle przejść przez błonę. Zamiast tego, większość ligandów rozpuszczalnych w wodzie wiąże się z zewnątrzkomórkowymi domenami receptorów na powierzchni komórki (patrz Rysunek 9.5). Ta grupa ligandów jest dość zróżnicowana i obejmuje małe cząsteczki, peptydy i białka.
9.2 | Propagacja sygnału
Do końca tego rozdziału będziesz w stanie:
- Wyjaśnić, w jaki sposób wiązanie ligandu inicjuje transdukcję sygnału w komórce.
- Rozpoznać, że sygnały wewnątrzkomórkowe są przekazywane dzięki roli fosforylacji lub drugich posłańców.
Gdy rozpuszczalny w wodzie ligand zwiąże się ze swoim receptorem, sygnał jest przekazywany przez błonę i do cytoplazmy. Kontynuacja sygnału w ten sposób nazywana jest transdukcją sygnału (rysunek 9.5). Transdukcja sygnału zachodzi tylko w przypadku receptorów na powierzchni komórki, ponieważ receptory wewnętrzne są w stanie wejść do komórki.
Gdy ligand wiąże się ze swoim receptorem, zachodzą zmiany konformacyjne, które wpływają na wewnątrzkomórkową domenę receptora. Te zmiany konformacyjne prowadzą do aktywacji domeny wewnątrzkomórkowej lub związanych z nią białek. W niektórych przypadkach związanie liganda powoduje dimeryzację receptora, co oznacza, że dwa receptory łączą się ze sobą tworząc stabilny kompleks zwany dimerem. Dimer jest związkiem chemicznym, który powstaje, gdy dwie cząsteczki (często identyczne) łączą się ze sobą. Wiązanie się receptorów w ten sposób umożliwia ich domenom wewnątrzkomórkowym bliski kontakt i wzajemną aktywację.
9.2.1 Ścieżki sygnałowe i wzmacnianie sygnału
Mimo że cząsteczki sygnałowe występują często w bardzo niskich stężeniach, mogą wywoływać głębokie efekty. Po związaniu się ligandu z receptorem na powierzchni komórki, aktywacja wewnątrzkomórkowych składników receptora uruchamia łańcuch zdarzeń, który nazywany jest ścieżką lub kaskadą sygnalizacyjną. W szlaku sygnalizacyjnym, drudzy posłańcy, enzymy i/lub aktywowane białka aktywują inne białka lub posłańców (rysunek 9.11). Każdy członek szlaku może aktywować tysiące kolejnych członków szlaku w procesie zwanym wzmacnianiem sygnału. Ponieważ sygnał jest wzmacniany na każdym etapie, z jednego receptora wiążącego ligand może powstać bardzo duża odpowiedź.
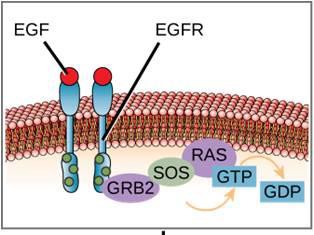
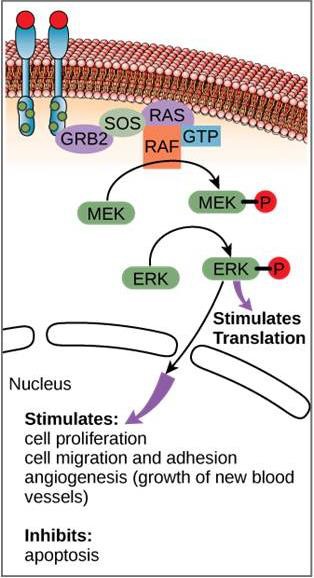
Przykład szlaku sygnalizacyjnego przedstawiono na rysunku 9.11. Epidermalny czynnik wzrostu (EGF) jest cząsteczką sygnalizacyjną, która bierze udział w regulacji wzrostu komórek, gojeniu się ran i naprawie tkanek. Receptor dla EGF (EGFR) jest kinazą tyrozynową. Aktywowana kinaza fosforyluje i aktywuje wiele innych cząsteczek. Kiedy EGF wiąże się z EGFR, kaskada kolejnych zdarzeń fosforylacji sygnalizuje komórce wzrost i podział. Jeśli EGFR jest aktywowany w nieodpowiednich momentach, może dojść do niekontrolowanego wzrostu komórek (rak).
W niektórych nowotworach aktywność GTPazy białka G RAS jest zahamowana. Oznacza to, że białko RAS nie może już hydrolizować GTP do GDP. Jaki wpływ miałoby to na dalsze wydarzenia komórkowe?
9.2.2 Metody sygnalizacji wewnątrzkomórkowej
Indukcja szlaku sygnalizacyjnego zależy od modyfikacji składnika komórkowego przez enzym. Istnieje wiele modyfikacji enzymatycznych, które mogą wystąpić w celu aktywacji kolejnego składnika szlaku. Poniżej przedstawiono niektóre z częściej występujących zdarzeń w sygnalizacji wewnątrzkomórkowej.
Fosforylacja
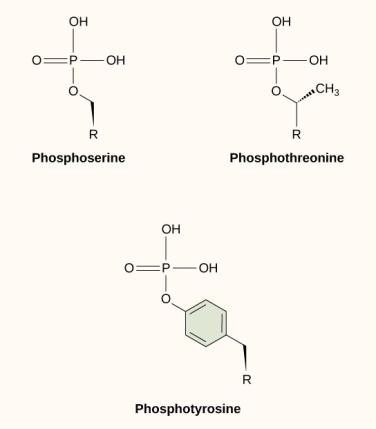
Jedną z najczęstszych modyfikacji chemicznych, która występuje w szlakach sygnalizacyjnych, jest dodanie grupy fosforanowej do cząsteczki w procesie zwanym fosforylacją. Fosforan może być dodany do nukleotydu, takiego jak GMP, aby utworzyć GDP lub GTP. Fosforany są również często dodawane do reszt seryny, treoniny i tyrozyny w białkach, gdzie zastępują grupę hydroksylową aminokwasu (rysunek 9.12). Przeniesienie fosforanu jest katalizowane przez enzym zwany kinazą. Fosforylacja może aktywować lub dezaktywować enzymy, a odwrócenie fosforylacji, deposforylacja, powoduje odwrócenie efektu.
Second Messengers
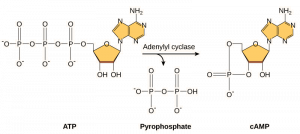
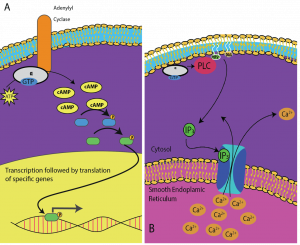
Second Messengers to małe cząsteczki, które rozprzestrzeniają sygnał po tym, jak został on zainicjowany przez wiązanie cząsteczki sygnalizacyjnej z receptorem. Cząsteczki te pomagają rozprzestrzeniać sygnał w cytoplazmie poprzez zmianę zachowania pewnych białek komórkowych. Drugim posłańcem wykorzystywanym przez wiele różnych typów komórek jest cykliczny AMP (cAMP). Cykliczny AMP jest syntetyzowany przez enzym cyklazę adenylową z ATP (rysunek 9.13). Główną rolą cAMP w komórkach jest wiązanie się i aktywacja enzymu zwanego kinazą zależną od cAMP (A-kinazą). A-kinaza reguluje wiele ważnych szlaków metabolicznych: Fosforyluje ona reszty serynowe i treoninowe swoich białek docelowych, aktywując je w tym procesie. A-kinaza występuje w wielu różnych typach komórek, a białka docelowe w każdym typie komórek są inne. Innym wtórnym posłańcem jest Ca2+ , który może zostać uwolniony w celu zalania komórki.
Różne komórki różnie reagują na cAMP. Na rysunku 9.14 pokazano, że podjednostka alfa receptora białka G aktywuje dwa różne rodzaje sygnalizacji. Na pierwszym obrazie cAMP jest wytwarzany przez enzym cyklazę adenylanową po aktywacji przez podjednostkę alfa. cAMP aktywuje następnie inne białka, które wpływają na transkrypcję genów. Na drugim obrazku podjednostka alfa białka G uruchamia kaskadę, która uwalnia Ca2+ z gładkiego retikulum endoplazmatycznego. W tym przypadku Ca2+ jest wtórnym posłańcem, który wywołuje odpowiedź komórkową.
9.3 | Odpowiedź na sygnał
Do końca tego rozdziału będziesz w stanie:
- Rozpoznać, że szlaki sygnalizacyjne kierują ekspresją białek, metabolizmem komórkowym i wzrostem komórek.
- Rozpoznać rolę apoptozy w rozwoju i utrzymaniu zdrowego organizmu.
Używając szlaków transdukcji sygnału, receptory w błonie plazmatycznej wywołują różne efekty w komórce. Wewnątrz komórki ligandy wiążą się ze swoimi wewnętrznymi receptorami, co pozwala im bezpośrednio wpływać na DNA komórki i mechanizmy produkcji białek. Rezultaty działania szlaków sygnałowych są bardzo zróżnicowane i zależą od typu komórki, jak również od warunków zewnętrznych i wewnętrznych. Poniżej opisano niewielką próbkę odpowiedzi.
9.3.1 Odpowiedzi na szlak sygnałowy
Ekspresja genów
Niektóre szlaki transdukcji sygnału regulują transkrypcję RNA. Inne regulują translację białek.
Wzrost metabolizmu komórkowego
Aktywacja receptorów β-adrenergicznych w komórkach mięśniowych przez adrenalinę prowadzi do wzrostu cyklicznego AMP wewnątrz komórki. Adrenalina jest hormonem produkowanym przez nadnercza, który przygotowuje organizm do krótkotrwałych sytuacji awaryjnych.
Wzrost komórek
Ścieżki sygnalizacyjne komórek również odgrywają ważną rolę w podziale komórek. Komórki nie dzielą się normalnie, chyba że są stymulowane przez sygnały z innych komórek. Ligandy, które promują wzrost komórek nazywane są czynnikami wzrostu. Większość czynników wzrostu wiąże się z receptorami na powierzchni komórki, które są połączone z kinazami tyrozynowymi.
Śmierć komórki
Gdy komórka jest uszkodzona, zbędna lub potencjalnie niebezpieczna dla organizmu, komórka może zainicjować mechanizm wyzwalający programowaną śmierć komórki, czyli apoptozę. Apoptoza pozwala komórce umrzeć w kontrolowany sposób, który zapobiega uwalnianiu potencjalnie szkodliwych cząsteczek z wnętrza komórki. Jednak w niektórych przypadkach, takich jak infekcja wirusowa lub niekontrolowany podział komórek spowodowany nowotworem, normalne mechanizmy kontroli i równowagi w komórce zawodzą. Zewnętrzna sygnalizacja może również zainicjować apoptozę. Na przykład, większość normalnych komórek zwierzęcych posiada receptory, które oddziałują z macierzą zewnątrzkomórkową, siecią glikoprotein, która zapewnia strukturalne wsparcie dla komórek zwierzęcych. Związanie receptorów komórkowych z macierzą zewnątrzkomórkową inicjuje kaskadę sygnałową wewnątrz komórki. Jeśli jednak komórka odsunie się od macierzy zewnątrzkomórkowej, sygnalizacja ustaje, a komórka ulega apoptozie. System ten pomaga zapobiegać przemieszczaniu się komórek po organizmie i niekontrolowanemu namnażaniu się, jak to się dzieje w przypadku komórek nowotworowych, które dają przerzuty.
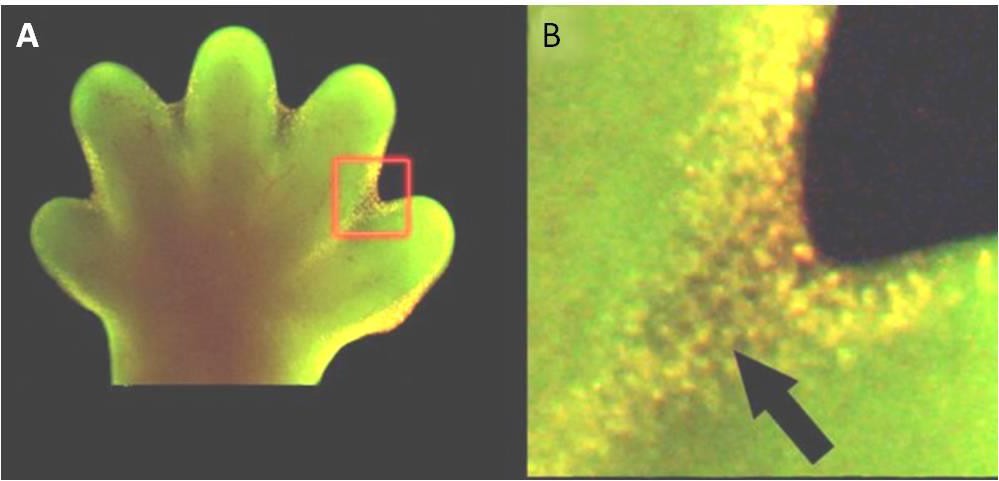
Apoptoza jest również niezbędna dla normalnego rozwoju embrionalnego. U kręgowców, na przykład, wczesne etapy rozwoju obejmują tworzenie się tkanki przypominającej sieć pomiędzy poszczególnymi palcami rąk i nóg (rysunek 9.15). W trakcie normalnego rozwoju te niepotrzebne komórki muszą zostać wyeliminowane, co umożliwia powstanie w pełni oddzielonych palców u rąk i nóg. Mechanizm sygnalizacji komórkowej uruchamia apoptozę, która niszczy komórki między rozwijającymi się palcami.
9.3.2 Zakończenie szlaków sygnałowych
Nieprawidłowa sygnalizacja często obserwowana w komórkach nowotworowych jest dowodem na to, że zakończenie sygnału w odpowiednim czasie może być równie ważne jak jego zainicjowanie. Jedną z metod zatrzymania określonego sygnału jest degradacja liganda lub usunięcie go tak, aby nie miał już dostępu do swojego receptora. Jednym z powodów, dla których hydrofobowe hormony, takie jak estrogen i testosteron, wywołują długotrwałe zdarzenia, jest fakt, że wiążą się one z białkami nośnikowymi. Białka te pozwalają nierozpuszczalne cząsteczki być rozpuszczalne we krwi, ale także chronić hormony przed degradacją przez krążących enzymów.
Wewnątrz komórki, wiele różnych enzymów odwrócić komórkowych modyfikacji, które wynikają z kaskad sygnalizacji. Na przykład, fosfatazy są enzymami, które usuwają grupę fosforanową dołączoną do białek przez kinazy w procesie zwanym dephosphorylation. cAMP jest degradowany do AMP przez fosfodiesterazę, kończąc w ten sposób swój sygnał. Podobnie, uwalnianie zapasów wapnia jest odwracane przez pompy Ca2+ , które znajdują się w błonach komórkowych.
.