Większość terapii medycznych jest przeznaczona dla „przeciętnego pacjenta” jako podejście uniwersalne, które może być skuteczne dla niektórych pacjentów, ale nie dla innych. Medycyna precyzyjna, czasami nazywana „medycyną spersonalizowaną”, to innowacyjne podejście do dostosowywania profilaktyki i leczenia chorób, które uwzględnia różnice w genach, środowisku i stylu życia poszczególnych osób. Celem medycyny precyzyjnej jest skierowanie właściwych metod leczenia do właściwych pacjentów we właściwym czasie.
Postępy w medycynie precyzyjnej doprowadziły już do nowych, potężnych odkryć i zatwierdzonych przez FDA metod leczenia, które są dostosowane do konkretnych cech jednostek, takich jak makijaż genetyczny danej osoby lub profil genetyczny jej nowotworu. Pacjenci cierpiący na różne rodzaje nowotworów rutynowo przechodzą badania molekularne w ramach opieki nad pacjentem, co umożliwia lekarzom wybór terapii zwiększających szanse przeżycia i zmniejszających narażenie na działania niepożądane.
- Testy sekwencjonowania nowej generacji (NGS)
- Rola FDA w rozwoju medycyny precyzyjnej
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Clinical Databases Guidance
- Wytyczne dotyczące walidacji analitycznej
- FDA’s Bioinformatics Platform
- Questions?
- What FDA Officials Are Saying
- NGS Final Guidances
- Raporty i dokumenty do dyskusji
- Past Meetings
Testy sekwencjonowania nowej generacji (NGS)
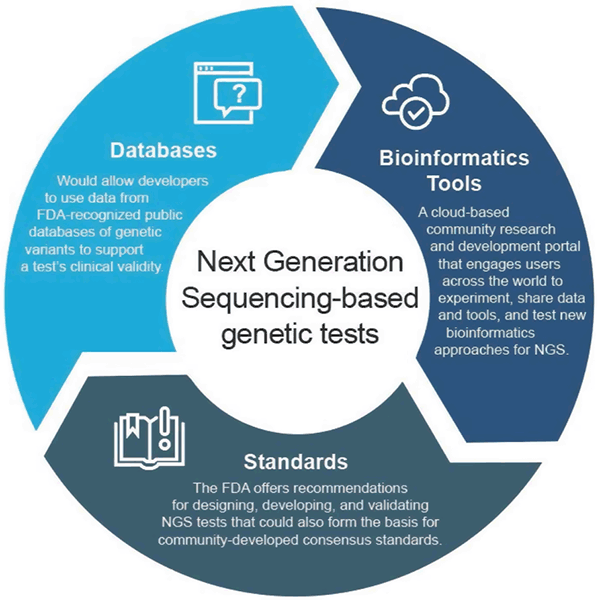
Precyzyjna opieka będzie tak dobra, jak dobre będą testy kierujące diagnozą i leczeniem. Testy sekwencjonowania nowej generacji (NGS) są w stanie szybko zidentyfikować lub „sekwencjonować” duże fragmenty genomu danej osoby i stanowią ważny postęp w klinicznych zastosowaniach medycyny precyzyjnej. FDA pracuje nad zapewnieniem dokładności testów NGS, tak aby pacjenci i klinicyści mogli otrzymywać dokładne i klinicznie znaczące wyniki testów. Ogromna ilość informacji generowanych przez NGS stawia przed FDA nowe problemy regulacyjne. Podczas gdy obecne podejścia regulacyjne są odpowiednie dla konwencjonalnych metod diagnostycznych, które wykrywają pojedynczą chorobę lub stan (takie jak poziom glukozy lub cholesterolu we krwi), te nowe techniki sekwencjonowania zawierają odpowiednik milionów testów w jednym. Z tego powodu FDA współpracowała z zainteresowanymi stronami w przemyśle, laboratoriach, środowiskach akademickich oraz stowarzyszeniach pacjentów i stowarzyszeniach zawodowych w celu opracowania elastycznego podejścia regulacyjnego, aby dostosować się do tej szybko rozwijającej się technologii, która wykorzystuje standardy konsensusu, dane pochodzące z wielu źródeł oraz najnowocześniejszą technologię obliczeniową open-source w celu wspierania rozwoju testów NGS. Takie podejście umożliwi innowacje w testach i badaniach oraz przyspieszy dostęp do dokładnych, wiarygodnych testów genetycznych. W kwietniu 2018 roku FDA wydała dwie ostateczne wytyczne, które zalecają podejścia mające na celu usprawnienie składania i przeglądu danych wspierających kliniczną i analityczną ważność testów opartych na NGS. Zalecenia te mają na celu zapewnienie skutecznego i elastycznego podejścia do nadzoru regulacyjnego: w miarę postępu technologicznego standardy mogą szybko ewoluować i być wykorzystywane do ustalania odpowiednich metryk dla szybko rozwijających się dziedzin, takich jak NGS. Podobnie, w miarę poprawy dowodów klinicznych, można wspierać nowe twierdzenia. Takie adaptacyjne podejście ostatecznie zwiększyłoby innowacyjność wśród twórców testów i poprawiłoby dostęp pacjentów do tych nowych technologii. Ostateczne wytyczne „Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” pozwalają twórcom testów na wykorzystanie danych z uznanych przez FDA publicznych baz danych wariantów genetycznych w celu wsparcia klinicznej ważności testu i określają, w jaki sposób administratorzy baz danych mogą starać się o uznanie swoich baz danych, jeśli spełniają one określone zalecenia dotyczące jakości. Takie podejście zachęca do dzielenia się danymi i zapewnia bardziej efektywną drogę na rynek. Więcej informacji na temat uznawania baz danych jest dostępnych na stronie internetowej FDA Recognition of Public Human Genetic Variants Databases. Ostateczne wytyczne „Considerations for Design, Rozwoju, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases” oferują zalecenia dotyczące projektowania, opracowywania i walidacji testów NGS. Wytyczne zachęcają również społeczność do zaangażowania się w rozwój standardów związanych z NGS przez organizacje opracowujące standardy (SDO), ponieważ standardy mogą szybciej ewoluować wraz ze zmianami w technologii i wiedzy, a zatem mogą być wykorzystane do ustalenia odpowiednich metryk, takich jak określone progi wydajności dla szybko rozwijających się dziedzin, takich jak NGS. FDA stworzyła precisionFDA, oparty na chmurze portal społecznościowy do badań i rozwoju, który angażuje użytkowników z całego świata do dzielenia się danymi i narzędziami w celu testowania, pilotowania i walidacji istniejących i nowych podejść bioinformatycznych do przetwarzania NGS. Osoby i organizacje działające w społeczności genomików mogą znaleźć więcej informacji i zapisać się do udziału na stronie http://precision.fda.gov. Please contact us with any questions about the FDA’s precision medicine efforts at [email protected]. .Rola FDA w rozwoju medycyny precyzyjnej
Streamlining FDA’s Regulatory Oversight of NGS Tests
Clinical Databases Guidance
Wytyczne dotyczące walidacji analitycznej
FDA’s Bioinformatics Platform
Questions?
What FDA Officials Are Saying
NGS Final Guidances
Raporty i dokumenty do dyskusji
Past Meetings