- trans-cynamaldehyd Właściwości chemiczne, zastosowania, produkcja
- przegląd
- Farmakokinetyka
- Zastosowania
- Toksyczność
- Właściwości chemiczne
- Właściwości chemiczne
- Właściwości chemiczne
- Definicja
- Opis syntezy
- Opis ogólny
- Powietrze &Woda Reakcje
- Profil reaktywności
- Zagrożenie pożarowe
- Potencjalne narażenie
- Wysyłka
- Niezgodności
- Usuwanie odpadów
trans-cynamaldehyd Właściwości chemiczne, zastosowania, produkcja
przegląd
Aldehyd cynamonowy, stary środek aromatyzujący pozyskiwany z drzew cynamonowych i innych gatunków z rodzaju Cinnamomum, wzbudza obecnie rosnące zainteresowanie ze względu na jego zdolność zapobiegania rozwojowi cukrzycy i jej powikłaniom. Jako żółta i lepka ciecz, aldehyd cynamonowy stanowi 98% olejku eterycznego z kory cynamonowca i został po raz pierwszy wyizolowany przez Dumasa i Péligota, a następnie zsyntetyzowany w laboratorium przez włoskiego chemika Luigiego Chiozzy (1828-1889) w 1854 roku. W 2007 r. Subash i wsp. po raz pierwszy donieśli o hipoglikemicznym i hipolipidemicznym działaniu aldehydu cynamonowego na wywołaną streptozotocyną (STZ) cukrzycę u samców szczurów Wistar. Cynamaldehyd był od tego czasu szeroko badany w zwierzęcych modelach cukrzycy i otyłości.
Cassia lub chiński cynamon jest szeroko stosowaną przyprawą pozyskiwaną z wewnętrznej kory drzewa cynamonowego. Cassia była używana przez tysiące lat do celów leczniczych i jest uważana za jedno z 50 podstawowych ziół w tradycyjnej medycynie chińskiej. Do celów leczniczych wykorzystuje się kilka części rośliny Cassia, w tym korzeń, korę, liście i kwiaty. Wyciągi z cynamonu mają różne korzystne działanie, w tym antyalergiczne, przeciwbakteryjne, przeciwwirusowe, przeciwutleniające, gastroprotekcyjne, antyangiogenne i antyAlzheimer, jak również insulinopodobne działania biologiczne. Ekstrakty cynamonu zawierają kilka aktywnych związków, w tym olejki eteryczne (aldehyd cynamonowy i aldehyd cynamylowy), taniny, śluz i węglowodany. Co ciekawe, aldehyd cynamonowy, znany również jako aldehyd cynamonowy, wykazuje działanie przeciw otyłości poprzez zmniejszenie akumulacji lipidów i obniżenie regulacji receptora aktywowanego proliferatorami peroksysomów-γ, białka wiążącego CCAAT/enhancer-binding protein α i białka wiążącego elementy regulacyjne steroli 1. Ponadto, aldehyd cynamonowy hamuje aktywację mikrogleju indukowaną lipopolisacharydem poprzez ukierunkowanie na białko-1 związane z receptorem lipoprotein o niskiej gęstości. Stwierdzono również, że aldehyd cynamonowy ma działanie antymutagenne w komórkach nowotworowych.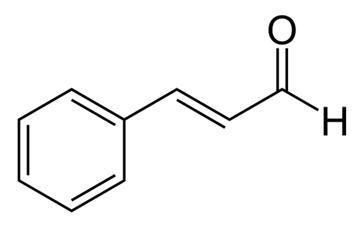
Rysunek 1 struktura chemiczna aldehydu cynamonowego;
Farmakokinetyka
Aldehyd cynamonowy naturalnie występuje w postaci trans-cynamaldehydu. W eksperymencie przeprowadzonym przez Zhao et al. oceniono farmakokinetykę aldehydu cynamonowego u szczurów przy użyciu względnie czułego podejścia chromatografii gazowej ze spektrometrią mas (GC-MS) poprzez podanie doustne (500 mg/kg) i dożylne (i.v., 20 mg/kg). Wyniki ujawniają, że AUC0-t aldehydu cynamonowego po podaniu doustnym i po podaniu i.v. wynosi odpowiednio 1984 ± 531 i 355 ± 53 ng h/ml. T1/2 i Tmax aldehydu cynamonowego są dłuższe w przypadku podawania doustnego (6,7 ± 1,5 h i 1,6 ± 0,5 h) niż w przypadku podawania i.v. (1,7 ± 0,3 h i 0,033 h). Cmax wynosi odpowiednio 249±36 ng/ml dla podania doustnego i 547±142 ng/ml dla podania i.v. Wyniki te wskazują, że biodostępność aldehydu cynamonowego jest lepsza po podaniu i.v. niż po podaniu doustnym.
Ponadto autorzy wykazują, że Cmax i AUC0-t są proporcjonalne do dawki (od 125 do 500 mg), podczas gdy Tmax i średni czas przebywania nie zmieniają się w odpowiedzi na eskalację dawki. Biorąc pod uwagę, że aldehyd cynamonowy i alkohol cynamylowy mogą przekształcać się w siebie nawzajem u szczurów, autorzy analizują również właściwości farmakokinetyczne alkoholu cynamylowego w osoczu szczurów. Dane farmakokinetyczne alkoholu cynamylowego wynoszą 1105±337 ng-h/ml dla AUC0-t, 6,7±2,8 h dla T1/2, 1,5±0,7 h dla Tmax i 221±66 ng/ml dla Cmax, przy dawce doustnej 500 mg/kg. Co ciekawe, cynamonian metylu został również wykryty w metabolitach. W celu uzyskania informacji na temat właściwości farmakokinetycznych cynamonianu metylu, zainteresowanych czytelników zachęcamy do zapoznania się z artykułem Zhao et al. Krótko mówiąc, cynamaldehyd jest dobrze rozprowadzany w organizmie po wchłonięciu. Aldehyd cynamonowy ma możliwość przekształcenia się w alkohol cynamylowy, a także może być utleniony do kwasu cynamonowego po dostaniu się do organizmu. W celu pełnego zrozumienia właściwości farmakokinetycznych aldehydu cynamonowego, należy również oznaczyć w osoczu cynamonian metylu i alkohol cynamonowy. Jednakże, niestabilność cynamonaldehydu poddaje w wątpliwość fakt, że bioaktywność cynamonaldehydu wynika prawdopodobnie z sumy jego metabolitów. Dlatego oczekuje się dalszych prób w celu rozwiązania potencjalnych obaw. Ponadto, nowo opracowany SME-cynamaldehyd o poprawionej biodostępności również wymaga dalszych badań nad działaniem przeciwcukrzycowym.
Zastosowania
Ekstrakty cynamonu mają różne korzystne działanie, w tym antyalergiczne, przeciwbakteryjne, przeciwwirusowe, przeciwutleniające, gastroprotekcyjne, antyangiogenne i antyAlzheimerowskie, jak również insulinopodobne działania biologiczne. Aldehyd cynamonowy wykazuje działanie przeciw otyłości poprzez zmniejszenie akumulacji lipidów i obniżenie regulacji receptora aktywowanego proliferatorami peroksysomów-γ, białka CCAAT/enhancer-binding protein α i białka wiążącego elementy regulacyjne steroli 1. Ponadto, aldehyd cynamonowy hamuje aktywację mikrogleju wywołaną lipopolisacharydem poprzez ukierunkowanie na białko-1 związane z receptorem lipoprotein o niskiej gęstości. Stwierdzono również, że aldehyd cynamonowy ma działanie antymutagenne w komórkach nowotworowych. Poniżej przedstawiono wpływ aldehydu cynamonowego na leczenie raka i cukrzycy:
Rak przeciwnowotworowy
Kwon i wsp. po raz pierwszy donieśli, że ekstrakty cynamonu indukują śmierć komórek czerniaka in vitro i in vivo poprzez hamowanie NF-κB i AP-1. Kolejne badania wykazały, że HCA jest głównym związkiem przeciwnowotworowym występującym w ekstraktach cynamonowych, wywierającym działanie hamujące wzrost 29 typów ludzkich komórek nowotworowych in vitro oraz ludzkich ksenograftów nowotworowych SW620 in vivo.
Inne zespoły badawcze również doniosły o działaniu przeciwnowotworowym ekstraktów cynamonowych. Hamują one komórki nowotworowe czerniaka poprzez indukowanie ekspresji czynników proangiogennych; poprawiły również aktywność przeciwnowotworową komórek T CD8 poprzez zwiększenie ich aktywności cytolitycznej. Ekstrakty z cynamonu hamują również czynnik wzrostu śródbłonka naczyniowego, co odkryto badając związki pod kątem ich aktywności hamującej wobec VEGFR2. Większość antytumorogennego działania ekstraktów cynamonowych można przypisać cynamaldehydom, głównemu składnikowi olejku eterycznego, odpowiedzialnemu za smak i aromat całego cynamonu. Stwierdzono, że cynamonaldehydy hamują proliferację komórek nowotworowych poprzez hamowanie cykliny D1 w kilku typach guzów. Cynamonaldehydy indukują również apoptozę poprzez generowanie reaktywnych form tlenu w komórkach białaczki HL-60 oraz poprzez aktywację proapoptotycznych białek rodziny Bcl-2 i szlaku sygnałowego MAPK w komórkach ludzkiego hepatoma. Ponadto dimeryczne cynamonaldehydy pochodzące z HCA wykazywały większe działanie przeciwnowotworowe niż monomeryczne cynamonaldehydy poprzez indukowanie apoptozy i zatrzymanie cyklu komórkowego. Ponadto, wiele badań ujawniło, że działanie przeciwnowotworowe HCA i jego pochodnych jest pośredniczone przez kilka mechanizmów molekularnych. Ostatnie badania wykazały, że polifenole zawierające rusztowanie cynamaldehydowe wywołują zatrzymanie cyklu komórkowego w fazie G2/M i apoptotyczną śmierć komórek w opornych na cisplatynę ludzkich komórkach raka jajnika, co sugeruje, że związki cynamaldehydowe mogą być skuteczne w chemioterapii skojarzonej u pacjentów z rakiem. Ogólnie rzecz biorąc, mechanizmy molekularne leżące u podstaw przeciwnowotworowego i antymetastatycznego działania aldehydów cynamonowych są zróżnicowane, co sugeruje, że aldehyd cynamonowy jest związkiem o wielostronnym działaniu. Zróżnicowana reaktywność różnych nowotworów na różne pochodne aldehydu cynamonowego musi zostać oceniona, aby umożliwić wybór najbardziej skutecznego związku dla każdego typu nowotworu.
Przeciwcukrzycowy
W ciągu ostatnich dziesięcioleci przeprowadzono wiele badań w celu oceny jego korzystnej roli w leczeniu cukrzycy i jej powikłań. Wykazano, że doustne podawanie aldehydu cynamonowego w dawce od 20 mg/kg masy ciała do 40 mg/kg masy ciała dziennie przez okres od 21 do 60 dni spowodowało znaczącą poprawę poziomu glukozy we krwi i hemoglobiny glikozylowanej oraz wrażliwości na insulinę u szczurów z cukrzycą indukowaną STZ. Przyjmuje się, że 20 mg/kg-BW jest dawką skuteczną w zapobieganiu rozwojowi cukrzycy u zwierząt. Ponadto, leczenie cynamaldehydem przez 4 tygodnie zwiększa poziom insuliny w osoczu i zawartość glikogenu w wątrobie, jak również obniża poziom triglicerydów i lipoprotein o niskiej gęstości cholesterolu u samców szczurów Wistar poddanych działaniu STZ i/lub HFD. Ponadto Camacho i wsp. stwierdzili, że podawanie cynamaldehydu przez 5 tygodni myszom C57BL/6J karmionym HFD znacząco prowadziło do zmniejszenia przyrostu masy tkanki tłuszczowej. Twierdzili jednak, że leczenie cynamaldehydem nie zmieniało poziomu insuliny w osoczu na czczo i spożycia paszy. Przyczyną niespójności w zakresie regulacji insuliny może być fakt, że w niektórych zakładach produkcyjnych tła genetyczne myszy C57BL/6J są zmienione. Różne szczepy myszy mogą wykazywać znaczne różnice w fenotypach. Ponadto, cynamonaldehyd może wykazywać działanie obniżające poziom glukozy poprzez poprawę wrażliwości na insulinę na obwodzie w badaniu Camacho.
Badania potwierdziły aktywność antybakteryjną aldehydu cynamonowego, goździków, tymianku i rozmarynu wobec E. coli O157:H7 i Salmonelli. Wendakoon i Sakaguchi podali, że grupa karbonylowa aldehydu cynamonowego wiąże się z białkami, uniemożliwiając aktywność dekarboksylazy aminokwasów u Enterobacter aerogenes. Smid i wsp. zaobserwowali uszkodzenie błony cytoplazmatycznej Saccharomyces cerevisiae pod wpływem działania aldehydu cynamonowego, prowadzące do nadmiernego wycieku metabolitów i enzymów z komórki, a w końcu do utraty żywotności. Większość badań sugeruje, że sposoby działania olejków eterycznych zależą od rodzaju mikroorganizmów, głównie od struktury ich ściany komórkowej oraz od układu ich błony zewnętrznej. Zaobserwowano uszkodzenia spowodowane znacznymi różnicami w zewnętrznych błonach bakterii gram-ujemnych i gram-dodatnich.
Toksyczność
Nawet obecnie przyjmuje się, że cynamaldehyd jest bezpiecznym naturalnym składnikiem i jest dobrze tolerowany u ludzi i zwierząt. Koncepcja ta jest również dobrze przyjęta przez FDA i Radę Europy z sugestią dopuszczalnego dziennego spożycia 1,25 mg/kg.
Toksyczność ostra
Odnotowano, że cynamaldehyd ma wysoki margines bezpieczeństwa, a podawany w dawce 20-krotnie większej od dawki skutecznej (20 mg/kg) tego związku nie powodował nieprawidłowych objawów behawioralnych i zaburzonych wartości chemii surowicy w całym badaniu. Ostra toksyczność aldehydu cynamonowego jest niska, z doustnymi wartościami mediany dawki śmiertelnej(LD50) wahającymi się od niskiej 0,6 g/kg BW do wysokiej 3,4 g/kg BW u różnych gatunków.
Toksyczność długoterminowa
Wyniki trzymiesięcznego badania pokazują, że masa ciała jest zmniejszona u samic szczurów narażonych na 16 500 lub 33 000 ppm oraz u samic myszy narażonych na 8200 ppm lub więcej. Ponadto, spożycie paszy jest zmniejszone we wszystkich narażonych grupach szczurów i w grupie myszy narażonych na najwyższą dawkę. Ponadto, narażenie na działanie aldehydu cynamonowego zwiększa częstość występowania hiperplazji nabłonka kolczastego żołądka. Ponadto myszy narażone na działanie aldehydu cynamonowego wykazują również zwiększoną częstość występowania zwyrodnienia nabłonka węchowego w jamie nosowej. Wszystkie szczury przeżyły w trakcie trzymiesięcznego badania.
Inne
Cynamaldehyd może również wykazywać działanie cytotoksyczne w hepatocytach szczura F344, o czym świadczy obniżenie poziomu glutationu, oraz w komórkach HepG2, o czym świadczy zwiększenie liczby mikrojąder. Behar i wsp. badali potencjalną toksyczność tego produktu w ludzkich komórkach embrionalnych i komórkach płuc. Wyniki pokazują, że traktowanie aldehydem cynamonowym depolimeryzuje mikrotubule w ludzkich fibroblastach płucnych. Aldehyd cynamonowy zmniejsza również proliferację i różnicowanie komórek poprzez hamowanie wzrostu i różnicowania komórek oraz poprzez zmianę morfologii i ruchliwości komórek, jak również zwiększenie liczby pęknięć nici DNA i śmierci komórek. Badanie przeprowadzone przez Olsena i wsp. ujawnia, że cynamaldehyd powoduje podrażnienie skóry poprzez podwyższenie progu bólu zimna i obniżenie progu bólu mechanicznego, jak również podwyższenie temperatury skóry i perfuzji u ludzi.
- Zhou M, Chen Z, Shen S. Recent advanceson cinnamaldehyde. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. Cinnamaldehyde supplementation prevents fasting-induced hyperphagia, lipid accumulation, and inflammation in high-fat diet-fed mice. BioFactors 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Diabetic osteoporosis: A review of its traditional chinese medicinal use and clinical and preclinical research. Evidence-based complementary and alternative medicine : eCAM 2016;2016:3218313.
- Dumas JP, E. Badania z zakresu chemii organicznej – nad olejkiem cynamonowym, kwasem hippurowym i kwasem sebacynowym. Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l´essence de cannelle”. Comptes rendus 1856;42:222-227.
- Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldehyde–a potential antidiabetic agent. Phytomedicine : international journal of phytotherapy and phytopharmacology 2007;14:15-22.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013. Cinnamon extract inhibits degranulation and de novo synthesis of inflammatory mediators in mast cells. Allergy 68: 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006. Antimicrobial activity of cinnamon and clove oils under modified atmosphere conditions. Int J Food Microbiol 107: 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. HIV type-1 entry inhibitors with a new mode of action. Antivir Chem Chemother 19: 243-255.
- Yang CH, Li RX, Chuang LY. 2012. Antioxidant activity of various parts of Cinnamomum cassia extracted with different extraction methods. Molecules 17: 7294-7304.
- Peterson DW et al. 2009. Cinnamon extract inhibits tau aggregation associated with Alzheimer’s disease in vitro. J Alzheimers Dis 17: 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012. In vivo and in vitro antidiabetic effects of aqueous cinnamon extract and cinnamon polyphenol-enhanced food matrix. Food Chem 135: 2994-3002.
- Kim JE et al. 2015a. A novel cinnamon-related natural product with Pim-1 inhibitory activity inhibits leukemia and skin cancer. Cancer Res 75: 2716-2728.
- Hwang H et al. 2011. 2′-Hydroxycinnamaldehyde targets low-density lipoprotein receptor-related protein-1 to inhibit lipopolysaccharide-induced microglial activation. J Neuroimmunol2011 230: 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. The antimutagenic effect of vanillin and cinnamaldehyde on spontaneous mutation in Salmonella TA104 is due to a reduction in mutations at GC but not AT sites. Mutat Res 480: 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. Postępy w badaniach nad farmakologicznymi efektami trans-cynamaldehydu. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Pharmacokinetic study of cinnamaldehyde in rats by gc-ms after oral and intravenous administration. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al. 1998. Synthesis and in vitro cytotoxicity of cinnamaldehydes to human solid tumor cells. Arch Pharm Res 21: 147-152.
- Lee CW et al. 1999. Inhibition of human tumor growth by 2′-hydroxyand 2′-benzoyloxycinnamaldehydes. Planta Med 65: 263-266
- Kwon HK et al. 2009. Cinnamon extract suppresses tumor progression by modulating angiogenesis and the effector function of CD8+ T cells. Cancer Lett 278: 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. Novel angiogenesis inhibitory activity in cinnamon extract blocks VEGFR2 kinase and downstream signaling. Carcinogenesis 31: 481-488.
- Jeong HW et al. 2000. Cinnamaldehydes inhibit cyclin dependent kinase 4/cyclin D1. Bioorg Med Chem Lett 10: 1819-1822.
- Ka H et al. 2003. Cinnamaldehyde induces apoptosis by ROSmediated mitochondrial permeability transition in human promyelocytic leukemia HL-60 cells. Cancer Lett 196: 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. Cinnamaldehyde-induced apoptosis in human PLC/PRF/5 cells through activation of the proapoptotic Bcl-2 family proteins and MAPK pathway. Life Sci 77: 938-951.
- Shin DS et al. 2006. Synthesis and biological evaluation of dimeric cinnamaldehydes as potent antitumor agents. Bioorg Med Chem 14: 2498-2506.
- Shin SY et al. 2014. Polifenole noszące rusztowanie cynamaldehydowe wykazujące działanie hamujące wzrost komórek na oporne na cisplatynę komórki raka jajnika A2780/Cis. Bioorg Med Chem 22: 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. Chemical composition and hypoglycemic and pancreas-protective effect of leaf essential oil from indigenous cinnamon. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Cinnamaldehyde chroni przed nadciśnieniem związanym z cukrzycą. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2011;49:3007-3012.
- Li M, Xu Y, Zhang W. Effects of cinnamaldehyde on the expression levels of irs-1 and p85 alpha in gastrocnemius of type 2 diabetic rats. Medical Journal of Wuhan University 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Gc-ms analysis and screening of antidiabetic, antioxidant and hypolipidemic potential of cinnamomum tamala oil in streptozotocin induced diabetes mellitus in rats. Cardiovascular diabetology 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. Anti-obesity and anti-hyperglycemic effects of cinnamaldehyde via altered ghrelin secretion and functional impact on food intake and gastric emptying. Scientific reports 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR. The c57bl/6j mouse strain background modifies the effect of a mutation in bcl2l2. G3 2012;2:99-102.
- Mekada K, Abe K, Murakami A, Nakamura S, Nakata H, Moriwaki K, Obata Y, Yoshiki A. Genetic differences among c57bl/6 substrains. Experimental animals 2009;58:141-149.
- Kiselycznyk C, Holmes A. All mice are not created equal. Frontiers in neuroscience 2011;5:10.
- Attane C, Peyot ML, Lussier R, Zhang D, Joly E, Madiraju SR, Prentki M. Differential insulin secretion of high-fat diet-fed c57bl/6nn and c57bl/6nj mice: Implications of mixed genetic background in metabolic studies. PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK, Mermierd. CM, Conne. CA, Vaughanc. RA. Trans-cinnamaldehyd stymuluje biogenezę mitochondrialną poprzez pgc-1α i pparβ/δ prowadząc do zwiększonej ekspresji glut4. Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. Anti-diabetic effects of cinnamaldehyde and berberine and their impacts on retinol-binding protein 4 expression in rats with type 2 diabetes mellitus. Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Increased p85/55/50 expression and decreased phosphotidylinositol 3-kinase activity in insulin-resistant human skeletal muscle. Diabetes 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS. Impact of hematopoietic cyclooxygenase-1 deficiency on obesity-linked adipose tissue inflammation and metabolic disorders in mice. Metabolism: clinical and experimental 2013;62:1673-1685.
- Ohaeri OC. Effect of garlic oil on the levels of various enzymes in the serum and tissue of streptozotocin diabetic rats. Bioscience reports 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH. Assessment of neutrophil gelatinase-associated lipocalin (ngal] and retinol-binding protein 4 in type 2 diabetic patients with nephropathy. Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. and CORKE, H. 2007. Antibacterial properties and major bioactive components of cinnamon stick: Activity against foodborne pathogenic bacteria. J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K. and REMMAL, A. 2003. The mechanism of bactericidal action of oregano and clove essential oils of their phenolic major components on Escherichia coli and Bacillus subtilis. J. Essent. Oil Res. 15, 356-362.
- KIM, H.-O., PARK, S.-W. and PARK, H.-D. 2004. Inactivation of Escherichia coli O157:H7 by cinnamic aldehyde purified from Cinnamomum cassia shoot. Food Microbiol. 21, 105-110
- WENDAKOON, C. and SAKAGUCHI, M. 1995. Inhibition of amino acid decarboxylase activity of Enterobacter aerogenes by active components in spices. J. Food Prot. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. and GORRIS, L.G.M. 1996. Fungicidal and fungistatic action of the secondary plant metabolites cinnamaldehyde and carvone. In Modern Fungicides and Antimicrobial Compounds pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. From type 2 diabetes to antioxidant activity: Systematyczny przegląd bezpieczeństwa i skuteczności kory cynamonu zwyczajnego i kasji. Canadian journal of physiology and pharmacology 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Insulinotropowy wpływ aldehydu cynamonowego na transkrypcyjną regulację kinazy pirogronianowej, karboksykinazy fosfoenolopirogronianowej i translokację glut4 u szczurów z cukrzycą doświadczalną. Chemico-biological interactions 2010;186:72-81.
- Gowder SJT. Ocena bezpieczeństwa aromatu spożywczego -aldehydu cynamonowego. Biosafety 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR. Toxicology and carcinogenesis studies of microencapsulated trans-cinnamaldehyde in rats and mice. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes. Toxicology in vitro : an international journal published in association with BIBRA 1996;10:37-42.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens. Mutagenesis 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribution, quantification and toxicity of cinnamaldehyde in electronic cigarette refill fluids and aerosols. Tobacco control 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Somatosensory and vasomotor manifestations of individual and combined stimulation of trpm8 and trpa1 using topical l-menthol and trans-cinnamaldehyde in healthy volunteers. European journal of pain 2014;18:1333-1342.
Właściwości chemiczne
dehyd cynamonowy trans jest głównym składnikiem olejku kasja (ok. 90%) i olejku z kory cynamonowca ze Sri Lanki (ok. 75%). Mniejsze ilości znajdują się w wielu innych olejkach eterycznych. W przyrodzie dominuje izomer trans.
Trans-Cynamaldehyd jest żółtawą cieczą o charakterystycznym korzennym zapachu, silnie przypominającym zapach cynamonu. Będąc nienasyconym aldehydem, ulega wielu reakcjom, z których ważną jest uwodornienie do alkoholu cynamonowego, dihydrocynamaldehydu i alkoholu dihydrocynamonowego. Kwas cynamonowy powstaje w wyniku autoutleniania.
Na skalę przemysłową aldehyd cynamonowy jest przygotowywany prawie wyłącznie przez kondensację alkaliczną benzaldehydu i aldehydu octowego. Samokondensacji aldehydu octowego można uniknąć przez zastosowanie nadmiaru benzaldehydu i powolne dodawanie aldehydu octowego.
Adehyd cynamonowy jest stosowany w wielu kompozycjach do tworzenia nut korzennych i orientalnych (np. perfumy mydlane). Jest to główny składnik sztucznego olejku cynamonowego. Ponadto, jest ważnym półproduktem w syntezie alkoholu cynamonowego i alkoholu dihydrocynamonowego.
Właściwości chemiczne
CZYSTA ŻÓŁTA CIECZ
Właściwości chemiczne
Łatwopalna, żółtawa, oleista ciecz (gęstnieje pod wpływem powietrza). Silny ostry, korzenny, cynamonowy zapach.
Definicja
ChEBI: Stereoizomer E (trans) aldehydu cynamonowego, rodzica klasy aldehydów cynamonowych.
Opis syntezy
Chemistry Letters, 12, str. 1207, 1983
Journal of the American Chemical Society, 93, str. 2080, 1971 DOI: 10.1021/ja00737a057
Tetrahedron Letters, 18, str. 1215, 1977
Opis ogólny
Klarowna żółta ciecz o zapachu cynamonu i słodkim smaku.
Powietrze &Woda Reakcje
Może być wrażliwy na długotrwałe działanie powietrza i światła. Nierozpuszczalny w wodzie.
Profil reaktywności
Trans-cynamaldehyd jest niezgodny z silnymi utleniaczami i silnymi zasadami. trans-cynamaldehyd może również reagować z wodorotlenkiem sodu.
Zagrożenie pożarowe
dehyd cynamonowy jest łatwopalny.
Potencjalne narażenie
Botaniczny środek grzybobójczy i owadobójczy. Używany jako środek przeciwgrzybiczy, środek wabiący kukurydzianą stonkę korzeniową oraz odstraszający psy i koty. Może być stosowany w osłonie gleby dla grzybów, upraw rzędowych, darni i wszystkich artykułów spożywczych. Nie wymieniony do stosowania w krajach UE.
Wysyłka
UN1989 Aldehydy, n.o.s., Klasa zagrożenia: 3; Oznakowania: 3-Palna ciecz
Niezgodności
Aldehydy często biorą udział w reakcjach samokondensacji lub polimeryzacji. Reakcje te są egzotermiczne; często są katalizowane przez kwas. Aldehydy łatwo utleniają się dając kwasy karboksylowe. Palne i/lub toksyczne gazy powstają w wyniku połączenia aldehydów ze związkami azowymi, diazowymi, ditiokarbaminianami, azotkami i silnymi środkami redukującymi. Aldehydy mogą reagować z powietrzem dając najpierw kwasy nadtlenowe, a w końcu kwasy karboksylowe. Te reakcje autoutleniania są aktywowane przez światło, katalizowane przez sole metali przejściowych i są autokatalityczne (katalizowane przez produkty reakcji). Dodanie stabilizatorów (przeciwutleniaczy) do transportów aldehydów opóźnia autoutlenianie. Niekompatybilny z utleniaczami (chlorany, azotany, nadtlenki, nadmanganiany, nadchlorany, chlor, brom, fluor, itp.); kontakt z nimi może spowodować pożar lub wybuch. Trzymać z dala od materiałów alkalicznych, silnych zasad, silnych kwasów, kwasów tlenowych, epoksydów, ketonów, barwników azowych, substancji żrących, boranów, hydrazyny
Usuwanie odpadów
Spalanie. Zgodnie z 40CFR165, postępować zgodnie z zaleceniami dotyczącymi utylizacji pestycydów i pojemników po pestycydach.