Trójfosforan guanozyny (dokładnie mówiąc guanozyno-5′-trifosforan lub również powszechnie skracany GTP dla uproszczenia) jest wysokoenergetycznym nukleotydem (nie mylić z nukleozydem) występującym w cytoplazmie lub spolimeryzowanym w celu utworzenia zasady guaninowej.
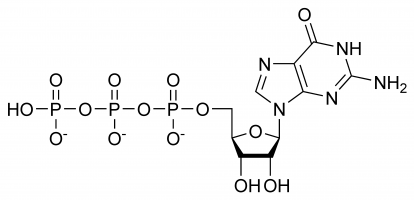
GTP pełni wybiórcze role w tworzeniu nici RNA, funkcjonując jako cząsteczka nośnika energii do syntezy białek, koenzym, poprzednik cGMP – cząsteczka wtórnego komunikatora lub jako cząsteczka efektorowa. Dwa ostatnie są powszechnie manifestowane poprzez modulację białek G. Wszystko to wynika z jego złożonej, trójwymiarowej struktury i różnorodności grup chemicznych, z których się składa. Dla uproszczenia można więc myśleć o nim jako o mnogości różnych grup funkcjonalnych, które praktycznie pełnią różne funkcje w izolacji (chociaż czasami struktura będzie zaangażowana, np. kiedy oddziałuje z enzymem i innym substratem), np. tylko trifosforan jest zaangażowany w uwalnianie energii do polimeryzacji, podczas gdy tylko zasada guaninowa jest zaangażowana w jego deaminację. Należy zauważyć, że lista podana na początku nie wyczerpuje wszystkich oddziaływań chemicznych, lecz jest jedynie demonstracją różnych możliwości.
W GTP cukier rybozy jest centralnym elementem trójwymiarowego układu kowalencyjnie połączonych cząsteczek guaniny i trifosforanu. Ten monosacharyd dostarcza grup hydroksylowych do reakcji kondensacji i ataków nukleofilowych, z których te ostatnie są ważne dla niszczenia cząsteczek RNA, a tym samym regulacji ekspresji genów. Cz±steczka guaniny i trifosforanu tworz± wi±zania kowalencyjne odpowiednio przy atomach C’1 i C’5, jednak możliwe jest również wykorzystanie przez nie innych grup hydroksylowych, o ile powstaj±ca struktura nie powoduje kolizji. Z punktu widzenia puryny jest ona związana w wyniku reakcji kondensacji na jej 9’N, który wcześniej był kowalencyjnie związany z atomem wodoru. Ponieważ guanina jest zasadą purynową, zaliczana jest do trójfosforanów purynowych wraz z trójfosforanem adeniny (ATP) i powstaje w wyniku modyfikacji monofosforanu inozyny.
Zawartość
- 1 Misconception: GTP, A Baseline Building Block
- 2 One Of Many RNA Base Predecesors
- 3 GTP; A Cousin of Universal ATP
- 4 A Resource for Signalling
- 5 References
Misconception: GTP, A Baseline Building Block
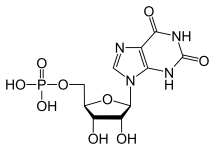
Wątroba jest głównym organem, który syntetyzuje nukleotydy purynowe i piramidynowe. Nukleotydy purynowe (GTP i ATP) są syntetyzowane poprzez tworzenie najpierw monofosforanu inozyny z ATP, glutaminy, glicyny, CO2, asparaginianu i mrówczanu. IMP
może być następnie zmodyfikowany w celu uzyskania jednej z tych cząsteczek.
W przypadku tworzenia GTP IMP jest najpierw przekształcany w XMP przez dehydrogenazę IMP. Powstała w ten sposób zmiana chemiczna i strukturalna umożliwia działanie syntazy GTP, która szybko przekształca XMP w GMP. GMP nie jest jednak cząsteczką wysokoenergetyczną, ponieważ nie posiada trifosforanu, więc jest następnie fosforylowany przez kinazy fosforanu nukleozydów, aby najpierw uzyskać difosforan, a ostatecznie trifosforan.
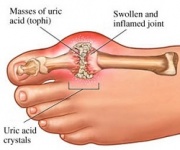
GTP jest normalnie katabolizowany do nierozpuszczalnego kwasu moczowego, który może następnie pojawić się w moczu w postaci kryształów moczanu sodu. Proces ten jest uważany za nieprawidłowy, jeśli zachodzi w stawach maziówkowych, powodując powstawanie kwasu moczowego, który jest następnie przekształcany w szkodliwy moczan monosodowy lub dwuwodny pirofosforan wapnia. Obecność takich związków chemicznych pozwala na rozwój stanu zapalnego i zapalenia stawów, a połączone objawy prowadzą do zaklasyfikowania choroby jako podagry. Innym przykładem znaczenia odpowiedniego katabolizmu nukleotydów purynowych jest ciężka połączona choroba niedoboru odporności, która powoduje zniszczenie istotnych limfocytów B i T
One Of Many RNA Base Predecesors
Istnieje kilka różnic między RNA i DNA, ale podstawowe rozróżnienie dotyczy struktury nukleobaz, które budują każdy polimer. Nukleobazy RNA zawierają grupę 2’OH na swoim cukrze rybozy, co pozwala im być znacznie bardziej reaktywnymi chemicznie, katalitycznymi i niestabilnymi. Należy zaznaczyć, że trójfosforan guanozyny dotyczy tylko wytwarzania zasady guaninowej w RNA. Analogiem GTP do tworzenia zasady guaninowej w DNA jest trifosforan deoksyguanozyny. Trójfosforan ten zawiera cukier deoksyrybozowy bez
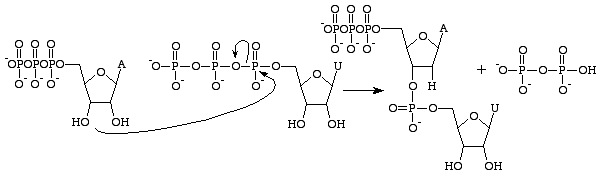
2’OH grupy, co czyni go znacznie bardziej stabilnym – zapobiega atakom nukleofilowym, które mogłyby rozszczepić wiązania fosfodiestrowe między nukleobazami. Jest to idealne rozwiązanie, ponieważ RNA powinno ulec rozpadowi po przetłumaczeniu na białko, podczas gdy DNA musi pozostać nienaruszone w celu przekazania informacji genetycznej komórce potomnej.
Trójfosforan guanozyny spowoduje powstanie zasady guaninowej w wyniku rozszczepienia wiązania bezwodnego i uwolnienia fosforanów alfa i gamma jako wolnych fosforanów. GMP utworzy następnie wiązanie fosfodiestrowe z pobliską zasadą zawierającą grupę 3’OH i dostarczy grupę 3’OH dla następnej zasady RNA. Reakcja ta zachodzi tylko wtedy, gdy zasadą przeciwną do GMP jest cytozyna, z którą może ona tworzyć wiązania wodorowe, a jej szybkość jest zwiększana przez polimerazę RNA. Polimeraza RNA nie układa trifosforanów. Katalizuje ona jedynie reakcję, która zachodzi po tym, jak dokona się ona niezależnie. Po katalizie, cząsteczka jest częścią łańcucha polinukleotydowego i nie jest już znana jako GTP, ale jako baza guanina.
GTP; A Cousin of Universal ATP
Podstawowy mechanizm uzyskiwania energii z rozszczepienia wiązania bezwodnego jest taki sam we wszystkich trifosforanach. Wysoki status energetyczny trifosforanów jest osiągany przez trzy odrębne mechanizmy. Pierwszy z nich wynika z sił odpychających
na każdej z grup fosforanowych. Przyczynia się to do dużej niestabilności wiązanych trifosforanów i dużej „chęci” osiągnięcia niższego stanu energetycznego. Druga z nich wynika ze stabilizacji rezonansowej. Kiedy GTP jest
przekształcany w GDP zwiększa się ilość możliwych pozycji dla istniejących par elektronowych, co przyczynia się do większej stabilności. Ten argument jest również podtrzymywany przy zamianie GDP na GMP. Trzecia z nich wynika z niekorzystnego efektu entropowego, jaki zwiększona ilość fosforanów wywiera na konformację cząsteczek wody otaczających cząsteczkę.
Ponieważ stężenie GTP w cytoplazmie jest znacznie niższe niż ATP, jest on wykorzystywany do specyficznych funkcji w procesach metabolicznych komórki.
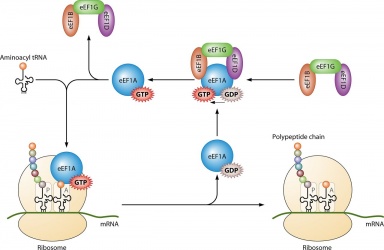
Jego głównym zastosowaniem jest synteza białek, gdy jest sprzężony z IF2 podczas inicjacji rybosomalnej, Ef-Tu i Ef-G podczas elongacji oraz ;RF3 podczas terminacji. Wszystkie cząsteczki GTP, które wiążą się z podanymi białkami ulegają dephosphorylacji, w wyniku czego powstaje PKB i wolny fosforan
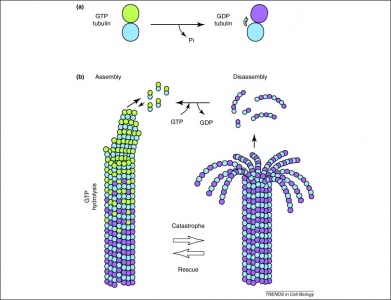
Ponadto GTP jest również wykorzystywany przez dimery tubuliny w ich tworzeniu mikrotubul. Dimery tubuliny składają się z tubuliny alfa i beta, z których każda posiada miejsca wiążące GTP. Ponieważ tubulina beta znajduje się na dodatnim końcu filamentu, GTP jest zawsze hydrolizowany w tym miejscu, gdy do wydłużającego się polimeru dodawany jest kolejny dimer. Co ważne, hydroliza GTP osłabia niekowalencyjne oddziaływania pomiędzy dimerami tubuliny, co w efekcie ułatwia rozpuszczanie mikrotubul, gdy zachodzi taka potrzeba. Należy zauważyć, że GTP białka tubuliny alfa nie jest deposforylowane, więc można uznać, że jest ono spójne w całej strukturze mikrotubuli.
A Resource for Signalling
Wykorzystanie specyficznej chemii i konformacji przestrzennej GTP jest skutecznie demonstrowane przez jego użycie w przekazywaniu sygnałów. Przede wszystkim, jest on w stanie wiązać i regulować aktywność różnych białek szlaku sygnalizacyjnego, które są klasyfikowane do dwóch różnych grup. Pierwszą z nich są heterotrimeryczne białka wiążące GTP (znane również jako heterotrimeryczne białka G), które wykorzystują GTP po aktywacji receptorów sprzężonych z białkami G w celu modyfikacji aktywności innych białek w szlaku. Drugie to monomeryczne białka wiążące GTP (znane również jako monomeryczne białka G). Reagują one na receptory inne niż receptory sprzężone z białkami G. Typowym przykładem podawanym podczas ich wyjaśniania jest białko Ras. Zauważmy, że są one w stanie selektywnie wiązać GTP b nie tylko dzięki specyficznej chemii, ale także dzięki zjawisku indukowanego dopasowania. Związany GTP zostanie po pewnym czasie hydrolizowany, co spowoduje autoinaktywację białka i zapobiegnie nadmiernej stymulacji szlaku sygnalizacyjnego. Po hydrolizie GTP PKB pozostanie związany, ponieważ zmiana konformacyjna spowoduje przesunięcie powinowactwa w kierunku cząsteczki GTP i cząsteczki PKB. Jest to jednak zmiana nietrwała i może być odwrócona przez kolejną aktywację przez receptor sprzężony z białkiem G.
GTP może być również wykorzystany jako reagent do produkcji cGMP, który jest stosunkowo często spotykaną wtórną cząsteczką sygnalizacyjną. Kataliza jest wyzwalana przez uwolnienie NO, który aktywuje cyklazę guanylanową, enzym, który wytwarza cGMP z GTP. cGMP może następnie działać jako efektor wobec kinaz białkowych, które fosforylują i modyfikują działanie określonych białek.
- J Koolman i KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell and P A Weil. Harper’s Illustrated Biochemistry. 28. edycja. Beijing, China. 2009.
- J Dow, G Lindsay i J Morrison, Biochemia: Molecules, Cells and the Body. 1st Edition. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay i J Morrison, Biochemia: Molecules, Cells and the Body. 1st Edition. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay i J Morrison, Biochemia: Molecules, Cells and the Body. 1st Edition. Wokingham, Anglia. Addison-Wesley. 1996.
- J Koolman i KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman i KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- M W King. Strona poświęcona biochemii medycznej. Wrzesień 2016. Cytowano: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell and P A Weil. Harper’s Illustrated Biochemistry. 28. edycja. Beijing, China. 2009.
- M W King. Strona poświęcona biochemii medycznej. Wrzesień 2016. Cytowano: 11:31. 03.12.2016. Dostępny w: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Strona poświęcona biochemii medycznej. Wrzesień 2016. Cited: 11:31. 03.12.2016. Dostępny w: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Strona poświęcona biochemii medycznej. Wrzesień 2016. Cited: 11:31. 03.12.2016. Dostępny w: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. Wrzesień 2016. Cited: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay i J Morrison, Biochemia: Molecules, Cells and the Body. 1st Edition. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay i J Morrison, Biochemia: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman i KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Eighth Edition. City and Country Unidentified. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Eighth Edition. City and Country Unidentified. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Eighth Edition. City and Country Unidentified. Freeman and Co. 2015.
- T E Dever and R Green. The Elongation, Termination and Recycling phases in Eukaryotes. CSHPB. July 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman i KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
.