Wśród ludzkich Neisseria i gatunków pokrewnych, trzy gatunki – N. mucosa, M. catarrhalis, i K. denitrificans redukują azotany. Test redukcji azotanu jest krytycznym testem dla rozróżnienia pomiędzy N. gonorrhoeae i K. denitrificans, szczególnie gdy szczepy K. denitrificans wydają się być gram-ujemnymi diplokokami w wybarwionych rozmazach.
Zasada
Gatunki bakterii mogą być rozróżniane na podstawie ich zdolności do redukcji azotanu do azotynów lub gazów azotowych. Wśród Neisseriaceae pochodzenia ludzkiego, szczepy Neisseria mucosa, Moraxella catarrhalis, i Kingella denitrificans redukują azotany. Szczepy M. catarrhalis i K. denitrificans były błędnie identyfikowane jako N. gonorrhoeae. Test redukcji azotanów pozwala na rozróżnienie pomiędzy tymi gatunkami, które są azotanododatnie i N. gonorrhoeae (azotanoujemne). Redukcja azotanu może być sprzężona z oddychaniem beztlenowym u niektórych gatunków.
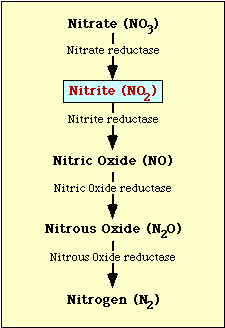
Scieżka biochemiczna zaangażowana w redukcję azotanu jest pokazana na Rysunku 1. Azotan jest redukowany do azotynu, który może być następnie zredukowany do tlenku azotu, podtlenku azotu lub azotu (rysunek 1).
Rysunek l. Ścieżka redukcji azotanu.
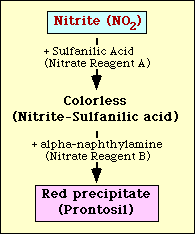
Test redukcji azotanu opiera się na wykrywaniu azotynu w pożywce po inkubacji z organizmem. Jeśli azotyn jest obecny w podłożu, reaguje z kwasem sulfanilowym (odczynnik azotanowy A), tworząc bezbarwny kompleks (azotyn-kwas sulfanilowy). Kompleks ten da następnie czerwony osad (prontosil), gdy do testu zostanie dodany odczynnik azotanowy B (alfa-naftyloamina), jak pokazano na rysunku 2.
Figura 2. Schematyczne przedstawienie wykrywania azotynów w pożywce.
Czerwony kolor pojawi się w pożywce tylko wtedy, gdy azotyn jest w niej obecny. Brak czerwonego koloru w pożywce po dodaniu kwasu sulfanilowego i alfa-naftyloaminy oznacza tylko tyle, że azotyn nie jest obecny w pożywce. Mogą być dwa wytłumaczenia tej obserwacji.
- Zazotan mógł nie zostać zredukowany; szczep jest azotanowo-ujemny.
- Zazotan mógł zostać zredukowany do azotynu, który następnie został całkowicie zredukowany do tlenku azotu, podtlenku azotu lub azotu, który nie będzie reagował z odczynnikami reagującymi z azotynem; szczep jest azotanowo-pozytywny.
Każda pożywka testowa, która daje wynik negatywny po dodaniu odczynników azotanowych musi być dalej badana w celu określenia, która z dwóch interpretacji jest dokładna.
Powodzenie testu redukcji azotanów zależy od wykonania testu w prawidłowych warunkach.
- Reakcja wystąpi najlepiej, jeśli pożywka podstawowa wspiera wzrost organizmu. Jednakże, mimo że niektóre gatunki Neisseria nie rosną dobrze w podłożach bulionowych, test redukcji azotanów może być z powodzeniem przeprowadzony w podłożu, które nie wspiera wzrostu poprzez silną inokulację podłoża, aby zapewnić wystarczającą ilość wstępnie uformowanego enzymu do wystąpienia reakcji.
- Reakcja azotanowa zachodzi tylko w warunkach beztlenowych. Pożywka zawierająca azotany jest dozowana do probówek w celu uzyskania niskiego stosunku powierzchni do głębokości, co ogranicza dyfuzję tlenu do pożywki, np. 5 ml pożywki dozuje się do probówki o średnicy 13 mm. Neisseria i gatunki pokrewne wykorzystują tlen zawarty w podłożu i szybko wytwarzają warunki beztlenowe, które są idealne do redukcji azotanów.
Test redukcji azotanów wykonuje się w podłożu zawierającym 0,2% azotanu potasu. Pożywka jest silnie inokulowana czystą kulturą podejrzanego organizmu i inkubowana w temperaturze 35C do 36,5C przez 48 h w inkubatorze z lub bez dodatku dwutlenku węgla.
Redukcja azotanów jest wykrywana za pomocą odczynników Griessa Llosvaya, kwasu sulfanilowego i alfa-naftyloaminy. Kwas sulfanilowy (odczynnik azotanowy A) jest dodawany do mieszaniny inkubacyjnej i tworzy kompleks (azotyn-kwas sulfanilowy) z każdym azotynem obecnym w podłożu. Gdy alfa-naftyloamina (odczynnik azotanowy B) zostanie dodana do inkubowanej pożywki, czerwony osad (prontosil) utworzy się z każdym kompleksem azotynu z kwasem sulfanilowym obecnym w pożywce.
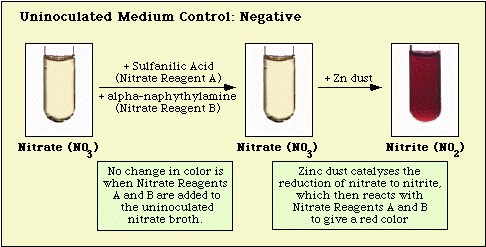
Brak czerwonego zabarwienia po dodaniu obu odczynników nie oznacza automatycznie, że organizm nie jest w stanie zredukować azotanu. Szczepy mogły zredukować azotan do azotynu, a następnie całkowicie zredukować azotyn do gazów azotowych, które nie są wykrywane po dodaniu do pożywki odczynników azotanowych A i B. Jeśli pożywka nie zmienia koloru po dodaniu kwasu sulfanilowego i alfa-naftyloaminy, do inkubowanej pożywki dodaje się niewielką ilość („czubek noża”) pyłu cynkowego. Pył cynkowy będzie katalizował chemicznie redukcję azotanu do azotynu. Tak więc, jeśli azotan nie został zredukowany przez organizmy, tzn. są one azotanoujemne, zostanie on zredukowany przez pył cynkowy i w ciągu 15 minut w inkubowanym medium pojawi się czerwony kolor. Jeżeli po dodaniu pyłu cynkowego w inkubowanej pożywce nie pojawi się żaden kolor, organizmy nie tylko zredukowały azotan do azotynu, ale zredukowały azotyn do gazów azotowych; organizmy te są również azotanododatnie.
Ale pożywka azotanowa jest dostarczana z odwróconymi probówkami Durhama w celu wykrycia produkcji gazu, produkcja gazu nie jest rejestrowana dla gatunków Neisseria. Chociaż niektóre gatunki mogą redukować azotan poza azotynem do gazów azotowych, gaz może nie gromadzić się w probówce. Gromadzenie się gazu zależy od szybkości jego produkcji. Gdy gaz jest wytwarzany bardzo powoli, może rozpuścić się w podłożu i nie gromadzić się w probówce Durhama.
Wymagania dotyczące próbek
Optymalna próbka: Czysta hodowla podejrzanego gram ujemnego, oksydazo-dodatniego diploccusa (Neisseria spp. lub M. catarrhalis) na agarze czekoladowym inkubowana w atmosferze wzbogaconej dwutlenkiem węgla w temperaturze 35C do 36,5C przez 18 do 24 h.
Niedopuszczalna próbka: Hodowle izolatów na agarze czekoladowym inkubowane w atmosferze wzbogaconej dwutlenkiem węgla w temperaturze 35C do 36,5C przez ponad 24 h.
Czynniki zakłócające wpływające na wyniki badań:
- Podłoże testowe musi być wystarczająco silnie zaszczepione, aby umożliwić zajście reakcji z wcześniej uformowanymi enzymami. Niewystarczające inokulum może nie pozwolić organizmom na zużycie tlenu do wytworzenia warunków beztlenowych, w których może nastąpić redukcja azotanów.
- Zbyt duża ilość pyłu cynkowego dodanego do inkubowanej probówki może spowodować bardzo szybką redukcję azotanów poza azotynami do gazów azotowych tak, że azotyny nie zostaną wykryte.
Stabilność próbki: Wykrywanie redukcji azotanów dla Neisseria i gatunków pokrewnych jest zależne od obecności wstępnie uformowanych enzymów.
- Testy powinny być wykonywane tylko z inokulum zebranym z 24 h hodowli.
- Podłoże azotanowe powinno być inokulowane w ciągu 30 min. od wyjęcia hodowli z inkubatora; przedłużona ekspozycja hodowli w temperaturze pokojowej może spowodować zmniejszenie aktywności enzymów.
Podłoże/Odczynniki
Podłoże: Nitrate broth (Bulion z wywaru z serca zawierający 0,2% azotanu potasu)
Heart infusion broth (Difco), 25,0 g
Potassium nitrate, 2,0 g
Distilled water, 1000.0 ml
- Rozpuścić składniki w wodzie destylowanej; dostosować roztwór do pH 7.0.
- Dozować porcje bulionu po 5 ml do probówek o wymiarach 16 mm x 100-mm z wkładami gazowymi (probówki Durhama, 6-mm x 50-mm).
- Autoklawować przez 15 min w temperaturze 121C.
Przechowywać pożywkę w temperaturze 4C do 10C (w lodówce) do czasu użycia. Przed inokulacją podgrzać pożywkę do temperatury pokojowej.
Odczynniki: Roztwór kwasu sulfanilowego (odczynnik azotanowy A): 0,8% w 5N kwasie octowym
Nazwa chemiczna: 4-aminobenzene sulfonic acid
Odczynnik azotanowy A należy przechowywać w temperaturze od 15C do 30C (temperatura pokojowa) przez okres do 3 miesięcy, w ciemności. Odczynniki mogą być przechowywane w pojemnikach z ciemnobrązowego szkła; butelki mogą być owinięte folią aluminiową w celu zapewnienia ciemności.
Roztwór alfa-naftyloaminy (odczynnik azotanowy B): 0,6% w 5N kwasie octowym
Nazwa chemiczna: N,N-dimetylo-1 naftyloamina
Odczynnik azotanowy B przechowywać w temperaturze od 2C do 8C (w lodówce) przez okres do 3 miesięcy, w ciemności. Odczynniki mogą być przechowywane w pojemnikach z ciemnobrązowego szkła; butelki mogą być owinięte folią aluminiową w celu zapewnienia ciemności.
Cynk w proszku, Odczynnik: Przechowywać w temperaturze pokojowej (15C do 30C)
Ostrzeżenie: Kwas octowy jest żrący. Kontakt ze skórą może powodować pęcherze i oparzenia. W przypadku kontaktu, natychmiast przepłukać oczy i skórę dużą ilością wody (przez co najmniej 15 min.)
Kontrola jakości/procedura badawcza
Szczepy QC:
- Nitrate reductase-positive control: Kingella denitrificans, CDC 10,236
- Kontrola reduktazy azotanowej-ujemna: Neisseria gonorrhoeae, ATCC 43069
Szczepy QC są przechowywane w temperaturze -70C w roztworze tryptycznego bulionu sojowego zawierającego 20% glicerolu. Reakcje szczepów kontrolnych powinny być potwierdzone w czasie przygotowywania zamrożonych zapasów. Szczepy QC mogą być przechowywane w temperaturze -70C przez okres do 2 lat.
Procedura:
Szczepy QC są badane w taki sam sposób jak izolaty kliniczne. Szczepy QC powinny być poddane subhodowli co najmniej raz po wstępnej hodowli z zamrożonej próbki przed wykonaniem testu. Izolaty kliniczne mogą być hodowane z podłoża selektywnego lub oczyszczonych podhodowli. Upewnić się, że hodowle są czyste.
- Rozmrozić fiolki ze szczepami kontrolnymi przechowywanymi w temperaturze -70C.
- Rozłożyć na płytkach z agarem czekoladowym lub uzupełnionym agarem GC do izolacji. Inkubować w temperaturze 35C do 36,5C w atmosferze wzbogaconej w dwutlenek węgla przez 18 do 24 h.
-
Za pomocą sterylnej wymazówki przygotować ciężką zawiesinę dobrze izolowanych kolonii z czystej kultury izolatu inkubowanego na podłożu czekoladowym w temperaturze 35C do 36.5 C w atmosferze wzbogaconej dwutlenkiem węgla przez 18 do 24 h. Zaszczepić pożywkę testową, aby uzyskać silne zmętnienie.
Uwaga: Szczepy N. gonorrhoeae i niektóre inne Neisseria spp. mogą nie rosnąć w tej pożywce. Tak więc, reakcja może być zależna od wstępnie utworzonego enzymu.
- Inkubować inokulowane pożywki i probówkę z pożywką kontrolną bez inokulacji w temperaturze 35C do 36,5 C w atmosferze wzbogaconej dwutlenkiem węgla przez 48 h.
-
Po 48 h inkubacji dodać, za pomocą pipety Pasteura, 5 kropli odczynnika #A, a następnie 5 kropli odczynnika #B do każdej probówki. Dobrze wstrząsnąć probówką, aby wymieszać odczynniki z podłożem.
Zbadać zawiesinę pod kątem różowo-czerwonego koloru, który powinien pojawić się w ciągu kilku minut, jeżeli podłoże jest jeszcze ciepłe. Reakcja może trwać nieco dłużej, jeśli pożywka jest zimna w momencie dodawania odczynników.
Jeśli zawiesina zmieni kolor na różowo-czerwony przed dodaniem sproszkowanego Zn, reakcja jest pozytywna i test jest zakończony. Nie należy wykonywać kroku 4.
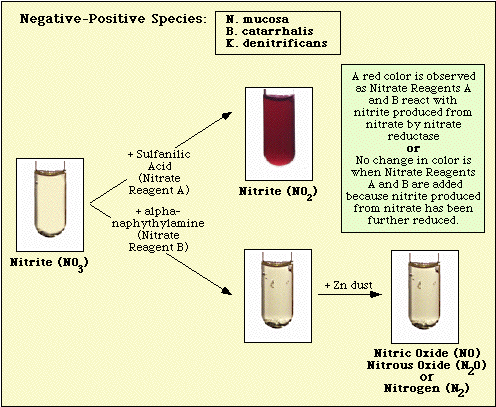
Reakcje obserwowane w przypadku kontrolnej pożywki bez inokulacji, izolatów azotanonegatywnych i azotanododatnich przedstawiono odpowiednio na Rysunku 3, Rysunku 4 i Rysunku 5.
-
Jeśli zawiesina jest bezbarwna po dodaniu odczynników A i B, dodać niewielką ilość (4 do 5 mg; „ostry czubek noża”) pyłu cynkowego do pożywki. Energicznie wstrząsnąć probówką i pozostawić w temperaturze pokojowej na 10-15 min.
Jeśli po dodaniu proszku Zn pożywka pozostaje bezbarwna, wynik testu jest pozytywny.
Jeśli po dodaniu proszku Zn pożywka zmienia kolor na różowy, wynik jest negatywny. - Odczytać i zapisać wyniki.
Rysunek 3. Reakcja obserwowana z pożywką azotanowo-azotanową bez inokulacji.
Rysunek 4. Reakcja obserwowana z gatunkami azotanonegatywnymi.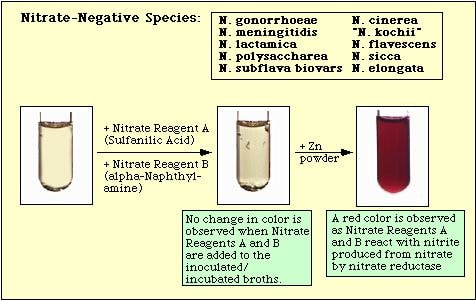
Rysunek 5. Reakcje obserwowane w przypadku gatunków azotanowo-dodatnich.
Schemat kontroli jakości:
- Test QC reduktazy azotanowej jest wykonywany każdego dnia, w którym badane są izolaty kliniczne.
Problemy & Rozwiązania
Test redukcji azotanu może dawać wyniki fałszywie ujemne lub fałszywie dodatnie, jeśli podłoże nie jest produkowane dokładnie lub test nie jest wykonywany dokładnie. Reakcja w tym teście jest zależna od wielu czynników.
- Niewykrycie różowego koloru w probówce kontrolnej z niezakażoną pożywką po dodaniu pyłu Zn może być spowodowane (1) tym, że pożywka nie zawiera azotanu lub (2) dodaniem zbyt dużej ilości pyłu cynkowego, który katalizował redukcję azotanu poza azotynem do gazów azotowych. Najprostszym rozwiązaniem jest uzyskanie większej ilości pożywki azotanowej, upewniając się, że azotan został dodany do pożywki podstawowej. Alternatywnie, można zaszczepić pożywkę pozytywnym szczepem kontrolnym, ale należy sprawdzić reakcję po krótszym czasie inkubacji; szczepy N. mucosa wytworzą pozytywną reakcję azotynową po kilku godzinach inkubacji. Jeśli potwierdzi się, że pożywka zawiera azotany, należy powtórzyć test aż do ustalenia właściwej ilości pyłu cynkowego do dodania. Ważne jest, aby dowiedzieć się, ile pyłu cynkowego dodać do testu. Dodanie zbyt dużej ilości pyłu cynkowego może spowodować wynik fałszywie dodatni.
- Jeśli po dodaniu do pożywki odczynników azotanowych A i B w kontroli pożywki niezakażonej zostanie wykryty różowy kolor, pożywka jest zanieczyszczona azotynami. Jedynym rozwiązaniem jest uzyskanie nowej partii pożywki, która nie jest zanieczyszczona azotynami.
- W pożywce zawierającej azotany, niepowodzenie pozytywnego szczepu kontrolnego, Kingella denitrificans, w uzyskaniu pozytywnej reakcji wystąpiłoby tylko wtedy, gdyby szczep nie był K. denitrificans. Ponownie sprawdzić tożsamość pozytywnego szczepu kontrolnego. Wybrać nową hodowlę szczepu kontrolnego i powtórzyć badanie. Podobnie, jeśli uzyskano pozytywny wynik testu reduktazy azotanowej z ujemnym szczepem kontrolnym, N. gonorrhoeae, to albo ujemny szczep kontrolny nie jest N. gonorrhoeae, albo hodowla jest zanieczyszczona organizmem azotanododatnim. Ponownie sprawdzić czystość i tożsamość referencyjnego szczepu gonokokowego. Powtórzyć badanie z czystą kulturą potwierdzonej hodowli N. gonorrhoeae.
- Reakcja redukcji azotanów wskazuje zdolność organizmów do redukcji azotanów, reakcji, która zachodzi tylko w warunkach beztlenowych; reakcja nie wystąpi, jeśli organizmy otrzymują stały dopływ tlenu. Dlatego też reakcja może nie zachodzić w hodowlach nieruchomych (w szczególności gatunków wolno rosnących), w których pożywka jest rozprowadzana w płytkich warstwach, umożliwiających dyfuzję tlenu do pożywki. Badanie w celu ustalenia, czy w podłożu obecny jest tlen, można przeprowadzić, dodając do podłoża kroplę odczynnika oksydazowego. Jeśli pożywka zmieni kolor na fioletowy, oznacza to, że zawiera tlen i reakcja redukcji azotanów może nie zachodzić. Jeśli pożywka pozostaje bezbarwna, pożywka nie zawiera tlenu i może wystąpić test redukcji azotanów. Zauważono, że komórki N. gonorrhoeae szybko zużywają tlen, jeśli do pożywki wprowadzono wystarczającą liczbę komórek. Jeśli odczynnik oksydazowy zostanie dodany po około 1 do 2 godzinach inkubacji, pożywka pozostanie klarowna. Ponieważ odczynnik oksydazowy zabija gonokoki obecne w pożywce, pożywka stopniowo zmieni kolor na fioletowy, zaczynając od górnej części probówki, w miarę dyfuzji tlenu do pożywki. Jeżeli pożywka jest podawana do probówek o innych wymiarach niż sugerowane powyżej, należy upewnić się, że stosunek powierzchni do głębokości jest co najmniej równy lub mniejszy niż sugerowany powyżej. Jeżeli średnica probówki, do której dozowana jest pożywka, jest większa niż opisana powyżej, należy użyć większej objętości pożywki, aby utrzymać ten sam stosunek powierzchni do głębokości.
-
Reakcja redukcji azotanów może nie wystąpić, jeżeli pożywka, w której przeprowadzane jest badanie, nie pozwala na normalny wzrost organizmu. Jednakże, test może być przeprowadzony w podłożu, które nie wspiera wzrostu organizmów, jeśli inokulum jest wystarczająco gęste, aby wstępnie uformowane enzymy mogły wyczerpać istniejący zapas tlenu i zredukować azotany w szybszym tempie niż to, w którym tlen dyfunduje do podłoża.
Uwaga: Aby sprawdzić, czy tlen został usunięty z podłoża, dodać 2 do 3 kropli odczynnika oksydazowego do duplikatu zaszczepionego podłoża. Jeżeli tlen został odpowiednio usunięty z pożywki, odczynnik oksydazowy nie zabarwi się natychmiast na kolor fioletowy. Jeśli pożywka zawiera rozpuszczony tlen, odczynnik oksydazowy zabarwi się na purpurowo. Należy również zauważyć, że test redukcji azotanów może być przeprowadzony w pożywce, do której dodano odczynnik oksydazowy.
- Gdy odczynnik A zostanie dodany do pożywki testowej, azotyn powstały w wyniku redukcji azotanów utworzy kompleks z kwasem sulfanilowym, który wytwarza czerwony osad z alfa-naftyloaminą w odczynniku B. Obecność czerwonego koloru w pożywce testowej wskazuje, że azotyn jest obecny w wyniku redukcji azotanów. Jednakże brak czerwonego zabarwienia po dodaniu odczynników A i B nie musi oznaczać, że azotan nie został zredukowany. Brak czerwonego zabarwienia może oznaczać, że: 1) azotan nie został zredukowany lub 2) azotyn, powstały w wyniku redukcji azotanu, został zredukowany do gazów azotowych. Aby określić, czy azotyn został zredukowany, należy umieścić niewielką ilość pyłu cynkowego w mieszaninie inkubacyjnej, jeżeli jest ona bezbarwna po dodaniu odczynników A i B. Pył cynkowy katalizuje redukcję azotanu do azotynu; w podłożu, które nadal zawiera nieredukowany azotan, powinien pojawić się czerwony kolor. Ważne jest jednak, aby nie dodać zbyt dużo pyłu cynkowego; nadmiar pyłu cynkowego będzie katalizował redukcję azotynów powstałych z tego azotanu, co spowoduje bezbarwne podłoże i błędną interpretację testu jako pozytywnego (wynik fałszywie pozytywny).
- Pozytywny wynik testu reduktazy azotanowej uzyskany ze szczepem kontroli negatywnej, N. gonorrhoeae, po dodaniu pyłu cynkowego wskazuje, że azotan został zredukowany do azotynów, prawdopodobnie z powodu dodania zbyt dużej ilości pyłu cynkowego do testu. Powtórzyć test, upewniając się, że dodano bardzo mało pyłu cynkowego. Różowy kolor, wskazujący, że organizm nie zredukował azotanu, może pojawić się po 10 do 15 minutach. Nie dodawać więcej pyłu cynkowego! Poczekać, aż kolor się rozwinie. Jeśli w ciągu 30 minut nie pojawi się kolor, zinterpretuj test jako pozytywny.
Ograniczenia testu
Jeśli test jest wykonywany prawidłowo, a szczepy kontroli jakości dają odpowiednie wyniki, nie powinno być żadnych ograniczeń dla tego testu. Należy zadbać o to, aby wszystkie składniki testu zostały wykonane prawidłowo.
Nie można dokonać identyfikacji rodzaju lub gatunku wyłącznie na podstawie testu redukcji azotanów.
Wyniki, interpretacja i raportowanie
Izolaty mogą być zgłoszone jako azotan-dodatnie, jeżeli azotyn (różowy kolor) jest wykryty w inokulowanym podłożu po dodaniu odczynników A i B lub jeżeli nie wykryto koloru w podłożu po dodaniu pyłu cynkowego.
Izolaty mogą być zgłaszane jako azotanowo-ujemne, jeśli azotyn nie jest wykrywany (brak zmiany koloru) po dodaniu odczynników A i B lub jeśli różowy kolor pojawia się po dodaniu pyłu cynkowego do inokulowanej pożywki.
Bibliografia
Knapp JS, Clark VL. Beztlenowy wzrost Neisseria gonorrhoeae sprzężony z redukcją azotynów. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. A guide to the identification of the genera of bacteria. The Williams & Wilkins Co., Baltimore, MD.
.