Mechaniczne powikłania ostrego zawału mięśnia sercowego (AMI) to ubytek przegrody międzykomorowej (VSD), pęknięcie lub dysfunkcja mięśnia brodawkowatego, pęknięcie wolnej ściany serca, tętniak komory, dynamiczna niedrożność drogi odpływu lewej komory (LV) (OT) oraz niewydolność prawej komory (RV). Wszystkie te warunki mogą potencjalnie prowadzić do niewydolności LV ze wstrząsem kardiogennym.
Dokładne zrozumienie mechanicznych powikłań AMI i ich czynników ryzyka może pomóc klinicystom we wczesnym postawieniu diagnozy. W celu uzyskania korzystnych wyników leczenia konieczne jest szybkie rozpoznanie i odpowiednia terapia medyczna oraz odpowiednio wczesna interwencja chirurgiczna. Ważnymi czynnikami zwiększającymi śmiertelność wewnątrzszpitalną z powodu mechanicznych powikłań zawału serca są zaawansowany wiek, wstrząs kardiogenny i niewydolność krążeniowo-oddechowa.
Pęknięcie wolnej ściany komory
VFWR jest najpoważniejszym powikłaniem AMI. VFWR jest zwykle związane z dużymi zawałami o charakterze transmuralnym i poprzedzającym je rozszerzeniem zawału. Jest najczęstszą przyczyną zgonów, drugą po niewydolności LV, i odpowiada za 15-30% zgonów związanych z AMI. Bezsprzecznie najbardziej katastrofalne z powikłań mechanicznych, VFWR prowadzi do ostrej hemoperikardii i śmierci z powodu tamponady serca.
Całkowita częstość występowania VFWR waha się od 0,8-6,2%. Częstość występowania tego powikłania zmniejszyła się na przestrzeni lat dzięki lepszej kontroli 24-godzinnego skurczowego ciśnienia tętniczego, zwiększonemu stosowaniu terapii reperfuzyjnej, beta-blokerów i inhibitorów ACE oraz zmniejszeniu stosowania heparyny.
Dane z National Registry of Myocardial Infarction (NRMI) wykazały zwiększoną częstość występowania śmiertelności wewnątrzszpitalnej wśród pacjentów, którzy otrzymali terapię trombolityczną (12,1%) niż wśród pacjentów, którzy jej nie otrzymali (6,1%). W badaniu Thrombolysis in Myocardial Infarction Phase II (TIMI II) 16% pacjentów zmarło z powodu pęknięcia mięśnia sercowego w ciągu 18 godzin od rozpoczęcia leczenia. U pacjentów, u których wykonano przezskórną angioplastykę wieńcową (PTCA), częstość występowania pęknięć wolnej ściany była mniejsza niż u pacjentów leczonych trombolitycznie.
Do czynników ryzyka VFWR należą: zaawansowany wiek powyżej 70 lat, płeć żeńska, brak wcześniejszych zawałów serca, załamki Q w EKG, nadciśnienie tętnicze w początkowej fazie STEMI, stosowanie kortykosteroidów lub NLPZ oraz leczenie fibrynolityczne po ponad 14 godzinach od wystąpienia STEMI. Pacjenci z dusznicą bolesną w wywiadzie, wcześniejszym AMI, wielonaczyniową chorobą wieńcową i przewlekłą niewydolnością serca są mniej narażeni na wystąpienie VFWR LV niż inni, ponieważ rozwijają się u nich kolaterale i prekondycjonowanie niedokrwienne.
Kliniczna prezentacja VFWR
VFWR są dramatyczne; występują ostro lub czasami podostro jako tętniaki rzekome; i najczęściej dotyczą przedniej lub bocznej ściany LV. Większość VFWR występuje w ciągu pierwszego tygodnia po AMI.
Becker i wsp. sklasyfikowali następujące 3 typy VFWRs :
-
Typ I – nagłe szczelinowate rozdarcie, które często jest związane z zawałami przednimi i które występuje wcześnie (w ciągu 24 h)
-
Typ II -. nadżerka zawału na granicy między zawałem a żywotnym mięśniem sercowym
-
Typ III – wczesne tworzenie się tętniaka skorelowane ze starszymi i znacznie powiększonymi zawałami
Typ III zwykle występuje później niż pęknięcia typu I lub typu II. Leczenie trombolityczne przyspiesza wystąpienie pęknięcia serca w VFWR Beckera typu I i typu II. W zawałach znacznie poszerzonych (typ III) terapia trombolityczna zmniejsza częstość występowania pęknięcia serca.
Tętniak rzekomy powstaje, gdy przylegające osierdzie i krwiak zamykają pęknięcie lub perforację mięśnia sercowego. Ściana tętniaka rzekomego jest najczęściej uwidoczniona jako tętniakowaty wyrostek, który łączy się z jamą LV za pomocą wąskiej szyi. Ściana ta zbudowana jest z osierdzia i zorganizowanej skrzepliny i/lub krwiaka. Jest ona pozbawiona elementów mięśnia sercowego, podczas gdy tętniak prawdziwy ma wszystkie elementy pierwotnej ściany mięśnia sercowego i stosunkowo szeroką podstawę. Tętniak rzekomy może mieć różną wielkość i jest obarczony dużym ryzykiem pęknięcia.
Kliniczne prezentacje VFWR różnią się w zależności od ostrości, lokalizacji i wielkości pęknięcia. U pacjentów z ostrym VFWR występuje silny ból w klatce piersiowej, nagła dysocjacja elektromechaniczna lub asystolia, zapaść hemodynamiczna i prawdopodobnie zgon. U około jednej trzeciej pacjentów przebieg jest podostry i występują u nich objawy takie jak omdlenia, hipotensja, wstrząs, arytmia oraz przedłużający się i nawracający ból w klatce piersiowej.
Diagnostyka VFWR
Wczesne rozpoznanie VFWR i interwencja są kluczowe dla przeżycia pacjentów. Wysoki wskaźnik podejrzeń jest wymagany, gdy pacjenci z AMI zgłaszają się z silnym bólem w klatce piersiowej, wstrząsem lub zaburzeniami rytmu i nagłym pojawieniem się dysocjacji elektromechanicznej. Objawy EKG świadczące o zbliżającym się VFWR mają ograniczoną swoistość, ale obejmują tachykardię zatokową, ubytki przewodzenia śródkomorowego oraz utrzymujące się lub nawracające uniesienie odcinka ST.
Echokardiografia jest narzędziem diagnostycznym z wyboru. Kluczowym objawem diagnostycznym jest umiarkowany lub duży wysięk w osierdziu z klinicznymi i echokardiograficznymi objawami zbliżającej się tamponady osierdzia. U pacjentów z tamponadą serca i dysocjacją elektromechaniczną, umiarkowany do ciężkiego wysięk w osierdziu zwiększa ryzyko śmiertelności. Pacjenci bez początkowej tamponady serca, choć mają mniejszą śmiertelność, nadal powinni być obserwowani, ponieważ nadal może dojść do późnego pęknięcia osierdzia. Brak wysięku w osierdziu w badaniu echokardiograficznym ma wysoką negatywną wartość predykcyjną. Jeśli możliwość wykonania echokardiogramu przezklatkowego jest ograniczona u pacjentów poddawanych wentylacji mechanicznej, echokardiografia przezprzełykowa może pomóc w potwierdzeniu VFWR.
MRI zapewnia lepszą jakość obrazu i pozwala na identyfikację miejsca i anatomii komorowego tętniaka rzekomego (tj. pękniętej LV ograniczonej przez osierdzie z zamkniętym skrzepem). MRI ma jednak ograniczone zastosowanie w ostrym okresie ze względu na czas i brak możliwości przenoszenia urządzeń do obrazowania.
Leczenie VFWR
Najważniejszą strategią prewencyjną jest wczesna terapia reperfuzyjna, przy czym preferowaną metodą jest przezskórna interwencja wieńcowa (PCI). Terapia fibrynolityczna wiąże się z ogólnie mniejszym ryzykiem VFWR, jednak jej zastosowanie po upływie ponad 14 godzin od początku STEMI może zwiększać ryzyko wczesnego pęknięcia.
Standardowym postępowaniem w przypadku VFWR jest chirurgiczna naprawa w trybie nagłym po uzyskaniu stabilności hemodynamicznej. Pacjenci mogą najpierw potrzebować płynów dożylnych, środków inotropowych i doraźnej perikardiocentezy.
Pifarré i współpracownicy zalecają zastosowanie wewnątrzaortalnej pompy balonowej w celu zmniejszenia skurczowego obciążenia następczego i poprawy rozkurczowej perfuzji mięśnia sercowego.
Zastosowano kilka technik chirurgicznych, w tym infarktomię, przyklejenie za pomocą biologicznych łatek klejowych wykonanych z włókna polietylenowego tereftalanu poliestru (Dacron; DuPont, Wilmington, DE) lub żywicy fluoropolimerowej politetrafluoroetylenu (Teflon; DuPont); oraz zastosowanie szwów zastawkowych bez infarktomii.
Śmiertelność jest znacząco wysoka i w dużej mierze zależy od przedoperacyjnego stanu hemodynamicznego pacjenta. Wczesne rozpoznanie, szybkie wdrożenie opisanych powyżej działań w celu osiągnięcia stabilności hemodynamicznej i szybka naprawa chirurgiczna mogą poprawić wskaźniki przeżycia. Kontynuacja randomizowanego badania Acorn wykazała długotrwałą poprawę struktury i funkcji lewej komory po operacji zastawki mitralnej, trwającą nawet 5 lat. Dane te dostarczają dowodów przemawiających za przeprowadzeniem zabiegu naprawczego zastawki mitralnej w połączeniu z urządzeniem Acorn CorCap u pacjentów z niedokrwienną niewydolnością serca z ciężką dysfunkcją lewej komory, u których zastosowano optymalne leczenie farmakologiczne, ale u których nadal występują objawy istotnej niedomykalności mitralnej.
Pęknięcie przegrody międzykomorowej
VSR jest rzadkim, ale zagrażającym życiu powikłaniem AMI. Pomimo optymalnego leczenia farmakologicznego i chirurgicznego, pacjenci z VSR charakteryzują się wysoką śmiertelnością wewnątrzszpitalną. W erze przedtrombolitycznej VSR występował u 1-3% osób z zawałem. Częstość ta zmniejszyła się wraz z wprowadzeniem leczenia trombolitycznego (do 0,2-0,34%) z powodu poprawy reperfuzji i ratowania mięśnia sercowego. Dwumodalny rozkład VSR charakteryzuje się wysoką częstością występowania w ciągu pierwszych 24 godzin, z kolejnym szczytem w dniach 3-5 i rzadko po ponad 2 tygodniach od AMI.
W przypadku pacjentów otrzymujących trombolityki mediana czasu od wystąpienia objawów AMI do pęknięcia przegrody międzykomorowej wynosiła 1 dzień w badaniu Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) i 16 godzin w badaniu Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK) trial.
Do czynników ryzyka pęknięcia przegrody należą: zaawansowany wiek (>65 lat), płeć żeńska, choroba jednego naczynia, rozległy zawał serca i słabe krążenie oboczne w przegrodzie. Przed wprowadzeniem leków trombolitycznych czynnikami ryzyka VSR były nadciśnienie tętnicze i brak dławicy piersiowej w wywiadzie. Rozległy zawał i zajęcie RV są innymi znanymi czynnikami ryzyka pęknięcia przegrody.
U pacjentów z AMI bez reperfuzji martwica układu krzepnięcia rozwija się w ciągu 3-5 dni po zawale. Neutrofile migrują do strefy martwicy i ulegają apoptozie, uwalniają enzymy lityczne i przyspieszają rozpad martwiczego miokardium. Niektórzy pacjenci mają zawały z dużymi krwiakami śródmiąższowymi, które wnikają w tkankę i powodują wczesne pęknięcie przegrody międzykomorowej. Wielkość pęknięcia przegrody międzykomorowej waha się od kilku milimetrów do kilku centymetrów.
VSR jest klasyfikowany jako prosty lub złożony w zależności od jego długości, przebiegu i lokalizacji. W prostym pęknięciu przegrody perforacja znajduje się na tym samym poziomie po obu stronach przegrody i występuje bezpośrednie przejście przez przegrodę. Złożone pęknięcie przegrody charakteryzuje się rozległym krwotokiem z nieregularnymi, serpentynowymi drogami w martwiczej tkance.
Pęknięcia przegrody są najczęstsze u pacjentów z dużym przednim zawałem serca spowodowanym okluzją tętnicy LAD powodującą rozległe zawały przegrody. Zawałom tym towarzyszą uniesienia odcinka ST i załamki Q w odprowadzeniach dolnych (II, III, aVF) i dlatego te zmiany w EKG są częściej obserwowane w pęknięciach przegrody. Pęknięcia te są zwykle koniuszkowe i proste.
Pęknięcia przegrody międzykomorowej u pacjentów z zawałem serca w odprowadzeniach dolnych występują stosunkowo rzadko. Pęknięcia te dotyczą przegrody dolnej dolno-bocznej i często są złożone.
Kliniczna prezentacja VSR
Objawy VSR powikłanego AMI obejmują ból w klatce piersiowej, duszność, niedociśnienie, niewydolność obu komór i wstrząs w ciągu kilku godzin do kilku dni. Pacjenci często zgłaszają się z nowym, głośnym i ostrym szmerem holosystolicznym. Szmer ten jest najgłośniejszy wzdłuż dolnej lewej krawędzi mostka i towarzyszy mu wyczuwalny palpacyjnie skurczowy dreszcz przymostkowy. Powszechne są galopy RV i LV S3.
U pacjentów we wstrząsie kardiogennym powikłanym pęknięciem przegrody szmer i dreszcze mogą być trudne do zidentyfikowania. Z kolei u pacjentów z ostrą MR często występuje miękki szmer skurczowy w koniuszku bez dreszczy.
Diagnostyka VSR
Echokardiografia z kolorowym obrazowaniem dopplerowskim przepływu jest narzędziem diagnostycznym z wyboru w identyfikacji VSR. (Jego czułość i swoistość sięgają 100%. Ponadto można je stosować w następujących przypadkach:
-
Określenie miejsca i wielkości pęknięcia przegrody
-
Ocena funkcji LV i RV funkcję
-
Oszacuj ciśnienie skurczowe RV
-
Oszacuj przesunięcie lewo-do-right shunt
Cewnikowanie serca jest zwykle wymagane do potwierdzenia diagnozy, ilościowego określenia stopnia przecieku lewo-prawego, odróżnienia VSR od innych stanów (np. niedomykalności mitralnej) oraz uwidocznienia tętnic wieńcowych.
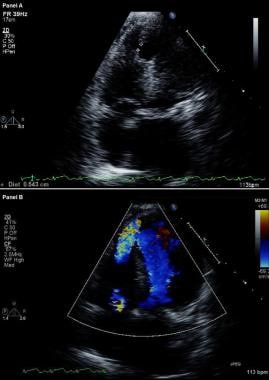 Powikłania zawału mięśnia sercowego. Zmodyfikowany dwuwymiarowy (u góry) echokardiogram i obraz kolorowego Dopplera przepływu (u dołu). Projekcja koniuszkowa czterojamowa pokazuje przerwę w przegrodzie międzykomorowej i swobodną komunikację między komorami przez duży ubytek w przegrodzie międzykomorowej w części koniuszkowej u pacjenta, który niedawno przebył zawał mięśnia sercowego w odcinku przednim.
Powikłania zawału mięśnia sercowego. Zmodyfikowany dwuwymiarowy (u góry) echokardiogram i obraz kolorowego Dopplera przepływu (u dołu). Projekcja koniuszkowa czterojamowa pokazuje przerwę w przegrodzie międzykomorowej i swobodną komunikację między komorami przez duży ubytek w przegrodzie międzykomorowej w części koniuszkowej u pacjenta, który niedawno przebył zawał mięśnia sercowego w odcinku przednim. U pacjentów z VSR w cewnikowaniu prawego serca obserwuje się stopniowe narastanie saturacji tlenem od prawego przedsionka do RV; w przeciwieństwie do tego u pacjentów z MR nie obserwuje się stopniowego narastania saturacji tlenem. Obecność dużych fal V w obrazie zaklinowania kapilar płucnych przemawia za rozpoznaniem ostrej MR.
Lewa wentrykulografia może być również wykorzystana do identyfikacji miejsca pęknięcia komory (patrz Cewnikowanie serca ). Badanie to jest jednak zwykle zbędne po wykonaniu dobrej jakości badania echokardiograficznego i dopplerowskiego.
Leczenie VSR
Kluczem do postępowania w VSR jest szybkie rozpoznanie i agresywne podejście do stabilizacji hemodynamicznej, angiografii i operacji. Optymalne podejście obejmuje stabilizację hemodynamiczną z podawaniem tlenu i mechanicznym wspomaganiem za pomocą wewnątrzaortalnej pompy balonowej, a także podawanie leków rozszerzających naczynia (w celu zmniejszenia obciążenia następczego, a tym samym ciśnienia w LV i shuntu lewo-prawego), diuretyków i środków inotropowych.
Cewnikowanie serca jest konieczne w celu określenia anatomii naczyń wieńcowych; po nim następuje pilna naprawa chirurgiczna.
W badaniu 52 kolejnych pacjentów z pozawałowym pęknięciem przegrody międzykomorowej, które zostało naprawione chirurgicznie, badacze stwierdzili, że śmiertelność 30-dniowa wynosiła 36% (n = 19). Większość pacjentów, którzy przeżyli krócej niż 30 dni, miała przedoperacyjny stan wstrząsu. Badacze konkludują, że u pacjentów z pęknięciem przegrody międzykomorowej konieczna jest przedoperacyjna poprawa stanu wstrząsu i agresywna rewaskularyzacja wieńcowa.
Leczenie farmakologiczne ma na celu jedynie czasową stabilizację przed zabiegiem operacyjnym, ponieważ stan większości pacjentów ulega szybkiemu pogorszeniu i umierają oni w przypadku braku interwencji chirurgicznej. W badaniu GUSTO-I śmiertelność 30-dniowa u chorych z VSR poddanych leczeniu chirurgicznemu była niższa niż u chorych leczonych farmakologicznie (47% vs 94%), podobnie jak śmiertelność jednoroczna (53% vs 97%). Lemery i wsp. wykazali, że 30-dniowe przeżycie wynosiło 24% u chorych leczonych medycznie w porównaniu z 47% u leczonych chirurgicznie.
Wytyczne American College of Cardiology/American Heart Association (ACC/AHA) dotyczące leczenia pacjentów z pęknięciem przegrody międzykomorowej powikłanym AMI podkreślają konieczność pilnej interwencji chirurgicznej, niezależnie od ich stanu klinicznego. Postępowanie chirurgiczne w przypadku pęknięcia przegrody międzykomorowej obejmuje następujące elementy:
-
Szybkie założenie hipotermicznego krążenia pozaustrojowego
-
Podejście do pękniętej przegrody przez obszar zawału i wycięcie wszystkich martwiczych, kruchych brzegów przegrody i ścian komór w celu uniknięcia krwotoku pooperacyjnego, resztkowego ubytku przegrody, lub obu
-
Odbudowa przegrody i ścian komór przy użyciu materiału protetycznego oraz zachowanie geometrycznej konfiguracji komór i funkcji serca
Przezskórne zamykanie pęknięcia przegrody jest stosunkowo nowym podejściem, stosowanym u wybranych pacjentów jako alternatywa dla naprawy chirurgicznej lub w celu ostrej stabilizacji krytycznie chorych pacjentów. Jednak przezskórne zamknięcie jest obecnie niedostępne w wielu instytucjach i nie ma danych dotyczących długoterminowych wyników leczenia.
W kilku badaniach nie wykazano związku między śmiertelnością okołooperacyjną a jednoczesną rewaskularyzacją wieńcową (pomostowanie aortalno-wieńcowe). Najgorzej rokują pacjenci we wstrząsie kardiogennym spowodowanym pęknięciem przegrody międzykomorowej. W badaniu SHOCK śmiertelność wewnątrzszpitalna była wyższa u chorych we wstrząsie kardiogennym spowodowanym pęknięciem przegrody międzykomorowej (87,3%) niż u chorych we wstrząsie kardiogennym z innych przyczyn (59,2% z czystą niewydolnością LV i 55,1% z ostrą MR).
U pacjentów, którzy przeżyli naprawę chirurgiczną, częstość nawrotów lub pozostałości ubytku przegrody wynosi około 28%, a związana z tym śmiertelność jest wysoka.
Powtórna interwencja chirurgiczna jest wskazana u pacjentów, u których występuje kliniczna niewydolność serca lub frakcja płucno-systemowa większa niż 2.
Ostra niedomykalność mitralna
MR jest częstym powikłaniem AMI, które wynika z lokalnego i globalnego remodelingu LV i które jest niezależnym predyktorem niewydolności serca i zgonu. MR pojawia się zwykle 7-10 dni po AMI, choć czas ten może być różny w zależności od mechanizmu MR. Pęknięcie mięśnia brodawkowatego prowadzące do MR występuje w ciągu 1-14 dni (mediana, 1 dzień).
Mild-to-moderate MR jest często klinicznie nieme i wykrywane w echokardiografii dopplerowskiej wykonywanej we wczesnej fazie AMI. W takich przypadkach MR rzadko powoduje zaburzenia hemodynamiczne.
Speckle tracking i echokardiografia trójwymiarowa okazały się ważnymi narzędziami obrazowania w ocenie odwrotnego remodelingu LV po operacji zwyrodnieniowej niedomykalności zastawki mitralnej. Subtelne regionalne przedoperacyjne zmiany w funkcji rozkurczowej przegrody i ściany bocznej można było zidentyfikować przed zabiegiem, co pomogło w optymalizacji czasu skierowania na zabieg i rozpoznaniu potencjalnych winowajców jako wskaźników nawrotu choroby po naprawie zastawki mitralnej.
Silna ostra MR, będąca skutkiem pęknięcia mięśni brodawkowatych lub strun ścięgnistych, prowadzi do nagłego pogorszenia hemodynamicznego ze wstrząsem kardiogennym. Konieczna jest szybka diagnoza, stabilizacja hemodynamiczna i szybka interwencja chirurgiczna, ponieważ ostra, ciężka MR wiąże się z wysoką śmiertelnością.
Zgłaszana częstość występowania MR może się różnić z powodu kilku czynników, w tym stosowanych metod diagnostycznych, obecności lub braku niewydolności serca, zgłaszanego stopnia MR, rodzaju stosowanej terapii oraz czasu od początku zawału do badania.
W badaniu GUSTO-I częstość występowania MR u pacjentów otrzymujących leczenie trombolityczne wynosiła 1,73%. W badaniu SHOCK, do którego włączono chorych po zawale serca we wstrząsie kardiogennym, stwierdzono częstość występowania umiarkowanej lub ciężkiej MR na poziomie 39,1%. Kinn i wsp. wykazali, że reperfuzja za pomocą angioplastyki spowodowała zmniejszenie częstości występowania ostrej MR o 82% w porównaniu z leczeniem trombolitycznym (0,31% vs 1,73%).
Czynniki ryzyka wystąpienia MR to zaawansowany wiek, płeć żeńska, duży zawał, wcześniejsze AMI, nawracające niedokrwienie, wielonaczyniowa choroba wieńcowa i niewydolność serca.
Różne mechanizmy mogą powodować MR po AMI. Najczęściej opisywanym mechanizmem jest pęknięcie mięśnia brodawkowatego.
Pęknięcie takie występuje u 1% pacjentów z AMI i często dotyczy raczej mięśnia brodawkowatego tylno-przyśrodkowego niż przednio-bocznego, ponieważ ten pierwszy ma pojedyncze ukrwienie w porównaniu z podwójnym ukrwieniem tego drugiego. Pęknięcie mięśnia brodawkowatego może prowadzić do pofałdowania lub wypadnięcia płatków, co skutkuje ciężką MR. Dysfunkcja mięśnia brodawkowatego spowodowana bliznowaceniem lub nawracającym niedokrwieniem może również prowadzić do MR w fazie podostrej i przewlekłej po zawale; stan ten może ustąpić samoistnie.
Duży zawał tylnej części serca powoduje ostrą MR z powodu asymetrycznego poszerzenia pierścienia oraz zmienionej funkcji i geometrii mięśnia brodawkowatego.
Kliniczna prezentacja MR
Pacjenci z czynnościową łagodną lub umiarkowaną MR są często bezobjawowi. Nasilenie objawów różni się w zależności od funkcji komór. Cechy kliniczne ostrej, ciężkiej MR obejmują duszność, zmęczenie, nowy szmer koniuszkowy holosystoliczny, gwałtowny obrzęk płuc i wstrząs.
Nowy szmer skurczowy może być tylko wczesno- lub średnio-skurczowy, a nie holosystoliczny. Może być miękki lub nawet nieobecny z powodu nagłego wzrostu ciśnienia w lewym przedsionku, co zmniejsza gradient ciśnienia między lewym przedsionkiem a LV, w porównaniu z przewlekłą MR. Szmer jest najlepiej słyszalny w koniuszku, a nie na dolnej granicy lewego mostka i rzadko towarzyszy mu dreszcze. Spodziewane są galopy S3 i S4.
Diagnostyka MR
Klinicysta nie może polegać na nowym szmerze holosystolicznym w celu rozpoznania MR lub oceny jego ciężkości z powodu zmiennego stanu hemodynamicznego. U pacjenta z AMI, który zgłasza się z nowym szmerem skurczowym na koniuszku, ostrym obrzękiem płuc i wstrząsem kardiogennym, wysoki wskaźnik klinicznego podejrzenia ciężkiej MR jest kluczem do rozpoznania.
Radiografia klatki piersiowej może wykazać dowody obrzęku płuc w ostrym okresie bez klinicznie istotnego powiększenia serca.
Echokardiografia z obrazowaniem dopplerowskim przepływu w kolorze jest standardowym narzędziem diagnostycznym do wykrywania MR. Echokardiografia przezklatkowa jest preferowanym wstępnym narzędziem przesiewowym, ale echokardiografia przezprzełykowa jest nieoceniona w określaniu ciężkości i dokładnego mechanizmu ostrej MR, zwłaszcza gdy podejrzenie pęknięcia mięśnia brodawkowatego jest duże. Cewnikowanie serca powinno być wykonane u wszystkich pacjentów w celu określenia zakresu i stopnia zaawansowania choroby wieńcowej.
Leczenie MR
Określenie stabilności hemodynamicznej, wyjaśnienie dokładnego mechanizmu ostrej MR i szybkie leczenie są niezbędne dla uzyskania korzystnego wyniku. Postępowanie medyczne obejmuje zmniejszenie obciążenia następczego za pomocą diuretyków, nitroprusydku sodu i azotanów u pacjentów, u których nie występuje hipotensja.
W przypadku pacjentów, u których występują zaburzenia hemodynamiczne, należy szybko zastosować kontrapulsację balonem wewnątrzaortalnym. Ta interwencja zwykle znacznie zmniejsza obciążenie następcze i objętość niedomykalności, poprawiając rzut serca w przygotowaniu do naprawy chirurgicznej. Bez naprawy chirurgicznej sama terapia medyczna u pacjentów z pęknięciem mięśnia brodawkowatego skutkuje niewystarczającą poprawą hemodynamiczną i złym rokowaniem krótkoterminowym.
Pilna interwencja chirurgiczna jest leczeniem z wyboru w przypadku pęknięcia mięśnia brodawkowatego. Podejście chirurgiczne może obejmować naprawę lub wymianę zastawki mitralnej. W przypadku braku martwicy mięśnia brodawkowatego naprawa zastawki mitralnej poprawia przeżywalność w większym stopniu niż wymiana zastawki mitralnej. Różnica ta wynika z faktu, że aparat podzastawkowy jest zwykle zachowany. Naprawa zastawki mitralnej eliminuje również powikłania związane z nieprawidłowym funkcjonowaniem protezy.
W przypadku chorych z rozległą martwicą mięśnia brodawkowatego i/lub wolnej ściany komory preferowaną metodą jest wymiana zastawki mitralnej. W jednym z badań wykazano, że pomostowanie tętnic wieńcowych (CABG) wykonane w czasie operacji poprawia przeżycie krótko- i długoterminowe.
Jedyną sytuacją, w której można bezpiecznie uniknąć operacji w trybie nagłym, jest przerywana MR spowodowana nawracającym niedokrwieniem. U tych chorych skuteczna może być rewaskularyzacja mięśnia sercowego. Zabieg ten wykonuje się za pomocą angioplastyki lub pomostowania aortalno-wieńcowego.
Dynamiczne LVOTO
Początkowo uważano, że występuje tylko w kardiomiopatii przerostowej, jednak różni badacze donoszą o obecności dynamicznego LVOTO jako powikłania ostrego przedniego zawału serca. Postuluje się również, że obecność dynamicznego LVOTO może być jedną z przyczyn pęknięcia mięśnia sercowego.
Dynamiczne LVOTO jest mechanicznie spowodowane kompensacyjną hiperkinezą podstawnego i środkowego segmentu LV u pacjentów z zawałem dystalnej LAD. Czynnikami predykcyjnymi zwiększonej regionalnej kurczliwości w obszarach niezawałowych są brak choroby wielonaczyniowej, płeć żeńska i większy przepływ w naczyniu związanym z zawałem. Zwiększona siła skurczu podstawowego miokardium powoduje niedomykalność mitralną poprzez efekt Venturiego. Skutkuje to zwiększeniem OTO, co prowadzi do dalszego zmniejszenia rzutu LV w warunkach już obecnej hipoperfuzji systemowej.
Ta zwiększona LVOTO w warunkach uszkodzonego mięśnia sercowego o charakterze transmuralnym tworzy idealne warunki, w których dochodzi do zwiększenia końcowoskurczowego ciśnienia śródkomorowego, co wywołuje zwiększone naprężenie ściany osłabionej, martwiczej strefy zawału. To często śmiertelne powikłanie występuje najczęściej u kobiet, starszych pacjentów (>70 lat) oraz u osób bez wcześniejszego zawału serca.
Kliniczna prezentacja LVOTO
Pacjenci dotknięci chorobą mogą mieć typowe objawy zespołu wzmożonych objawów autonomicznych, takie jak zaburzenia oddychania, diaforeza i chłodne, wilgotne kończyny, oprócz typowych oznak i objawów AMI.
Pacjenci ci mogą szybko przejść do wstrząsu kardiogennego z ciężką ortopenią, dusznością i oligurią, i mogą mieć zmieniony stan psychiczny z hipoperfuzji mózgu. Pacjenci mogą pojawić się z nowym skurczowym szmerem wyrzutowym, nowym szmerem holosystolicznym promieniującym do pachy w wyniku skurczowego ruchu przedniego płatka mitralnego (SAM). Może być również obecny galop S3, rzężenia płucne, hipotensja i tachykardia; te ostatnie objawy fizyczne mogą być całkowicie nieobecne w ostrym okresie.
Echokardiografia przezklatkowa lub przezprzełykowa (TTE/TEE) jest badaniem diagnostycznym z wyboru i może dokładnie scharakteryzować segment hiperkinetyczny, LVOTO i płatek mitralny SAM.
Leczenie LVOTO
Rozważmy zmniejszenie hiperkurczliwości mięśnia sercowego poprzez ostrożne dodanie beta-blokady. Również powolna resuscytacja objętościowa poprzez zwiększenie obciążenia następczego (fenyloferyna) może zwiększyć obciążenie wstępne i zmniejszyć LVOTO i SAM. Najlepiej byłoby unikać leków zwiększających obciążenie następcze. Należy również unikać leków rozszerzających naczynia, inotropów i pomp balonowych, ponieważ mogą one zwiększać LVOTO.
Niewydolność RV
Często obserwowana w związku z zawałem serca o mniejszym nasileniu, łagodna dysfunkcja RV po zawale jest powszechna; jednak w większości przypadków wpływ na LV jest minimalny.
Znacząca hipokineza RV występuje w przypadku okluzji proksymalnej prawej tętnicy wieńcowej z niewielkim ograniczeniem kolateralizacji z krążenia lewostronnego. Postuluje się, że ponieważ RV jest cienkościenna i ma mniejsze zapotrzebowanie na tlen, perfuzja wieńcowa ma miejsce podczas całego cyklu serca; dlatego rozległy nieodwracalny zawał występuje rzadko.
Typowa niewydolność RV może przebiegać z hipotensją (z powodu braku obciążenia wstępnego LV) i żylnym poszerzeniem żył szyjnych z czystym polem płucnym. Chociaż klasycznie opisywana w kontekście niewydolności RV, ta triada jest rzadko spotykana w czystej postaci w warunkach klinicznych. Większość pacjentów występuje ze wstrząsem kardiogennym o niskiej wydajności lub niewydolnością LV z towarzyszącymi objawami autonomicznymi.
Występowanie szyjnego ciśnienia żylnego powyżej 8 cm H2O i objawu Kussmaula jest wysoce czułe i swoiste dla ciężkiej niewydolności RV.
Okresowo, przetaczanie z prawej do lewej strony przez drożny otwór owalny powoduje trwałą hipoksemię. Należy pamiętać o tym osobliwym powikłaniu.
Elektrokardiograficznie pacjenci prezentują się z dolnym uniesieniem odcinka ST w połączeniu z uniesieniem odcinka ST w odprowadzeniu V4R. Radiogram klatki piersiowej zwykle wydaje się nijaki, bez dystorsji żylnej w górnym płacie.
Diagnostyka niewydolności RV
Dwuwymiarowa (2D) echokardiografia i rezonans magnetyczny (MRI) są bardzo przydatne. Najczęściej echokardiografia pomaga w ustaleniu rozpoznania.
Wyniki cewnikowania metodą Swana-Ganza zwykle sugerują wysokie ciśnienie w tętnicy płucnej przy niskim PCWP.
Leczenie niewydolności RV
Resuscytacja objętościowa w celu utrzymania PCWP na poziomie lub wokół 15 mmHg może pomóc tymczasowo poprzez przejściowe zwiększenie obciążenia wstępnego RV. Ostateczne leczenie polega jednak na przywróceniu krążenia wieńcowego. W rzadkich przypadkach ciężkiej niewydolności RV należy rozważyć zastosowanie mechanicznego wspomagania krążenia za pomocą urządzeń do wspomagania RV (AD), albo czasowo, albo jako terapii pomostowej w przypadku rozległego zajęcia obu komór.