Clinical record
Dwóch pacjentów z niedoborem transkarbamylazy ornityny, zaburzeniem cyklu mocznikowego, zostało przeniesionych do naszego oddziału intensywnej terapii w ciągu 12 miesięcy. Obaj byli wcześniej zdrowymi mężczyznami, którzy początkowo przedstawili się z nieopisanymi, ale postępującymi objawami neurologicznymi po drobnych procedurach (streszczenia przypadków w ramce 1).
Każdy pacjent rozwinął swoje początkowe objawy neurologiczne (ból głowy, spowolnienie umysłowe, brak koordynacji) około 24-48 godzin po prawdopodobnym czynniku poprzedzającym, który w każdym przypadku był pojedynczą dawką kortykosteroidu. U pacjenta 1 senność w ciągu 48 godzin przeszła w niespójność, niewyraźne widzenie i ciężkie pobudzenie, które wymagało intubacji 2 dni później. U pacjenta 2 ból głowy, nudności, niewyraźne widzenie i ból w nadbrzuszu w ciągu 48 godzin przeszły w ciągu następnych 2 dni w dezorientację i powolną mowę; następnego dnia rozwinęła się śpiączka, wymagająca intubacji.
Po przedstawieniu ich do szpitala peryferyjnego, obszerny panel badań patologicznych został podjęty dla każdego pacjenta, w tym badania krwi (pełna morfologia krwi, testy funkcji nerek, poziomy enzymów wątrobowych, profil krzepnięcia i markery zapalne), nakłucie lędźwiowe i obrazowanie mózgu (tomografia komputerowa i rezonans magnetyczny). Wyniki tych badań były wszystkie bez zmian.
Identyfikacja znaczącej hiperamonemii była opóźniona do około 36-48 godzin po przedstawieniu do szpitala. Pacjenci byli w śpiączce, kiedy zostali przewiezieni do naszego szpitala. Pacjent 1 miał przedłużony pobyt w naszym oddziale intensywnej terapii, z utrzymującym się minimalnie przytomnym stanem; Pacjent 2 przeszedł do śmierci mózgu i dawstwa organów.
Lekarze będą znali najczęstsze przyczyny hiperamonemii, w tym zwiększony ładunek białka związany z chorobą wątroby i dysfunkcją enzymów cyklu mocznikowego spowodowaną przez leki takie jak walproinian sodu. Mniej powszechnymi, ale ważnymi przyczynami podwyższonego poziomu amoniaku we krwi są dziedziczne zaburzenia cyklu mocznikowego (UCD). Najcięższe formy występują we wczesnym okresie życia, ale łagodniejsze formy tych zaburzeń mogą ujawnić się w wieku dorosłym.
UCDs stanowią grupę wrodzonych błędów metabolizmu, z szacowaną całkowitą częstością występowania pomiędzy 1:80001 a 1:30 0002 urodzeń. Są one spowodowane dysfunkcją któregokolwiek z sześciu enzymów lub dwóch białek transportowych biorących udział w biosyntezie mocznika, procesie zachodzącym głównie w wątrobie. Cykl mocznikowy jest końcowym szlakiem utylizacji amoniaku powstającego podczas katabolizmu aminokwasów. Amoniak jest neurotoksyczny, a każdy ostry wzrost jego stężenia we krwi powyżej 50 μmol/l może powodować objawy neurologiczne. Podczas gdy poziom amoniaku powyżej 100 μmol/L może powodować obtundację, łagodniejsze wzrosty powinny być interpretowane w kontekście klinicznym ich wystąpienia.
UCD dotykającym naszych dwóch pacjentów był niedobór transkarbamylazy ornitynowej (OTC), najczęstsze z zaburzeń cyklu mocznikowego. Niedobór OTC jest X-linked cecha, a zatem jest częściej wyrażone w mężczyzn, chociaż kobiety przewoźnicy mogą zdekompensować po znacznym stresie, takich jak poród.3 Inne UCD są autosomalne recesywne cechy.4
Pierwsza prezentacja w dorosłości można przypisać do łagodniejszego stopnia niedoboru, a często także do samoograniczenia spożycia białka jako wyuczone zachowanie, pozwalając stabilność aż stresor środowiskowy nadzoruje. Warunki, które prowadzą do zwiększonego zapotrzebowania na cykl mocznikowy, takie jak obciążenie białkiem, infekcje, systemowe kortykosteroidy, szybka utrata masy ciała, operacje, urazy i chemioterapia,5 mogą przyspieszyć dekompensację u osób z UCD. Przypadek 44-letniego mężczyzny, który zmarł z powodu wcześniej nierozpoznanego niedoboru OTC po operacji pomostowania tętnic wieńcowych, został opisany w tym czasopiśmie w 2007 roku.6
W przypadku dwóch pacjentów opisanych w naszym artykule pojedyncza, ale znaczna przypadkowa dawka kortykosteroidu była początkowym zdarzeniem poprzedzającym, a długotrwały post utrwalił błędny cykl metaboliczny, który zakończył się ciężką hiperamonemią.
Hyperammonaemia u dorosłych może przebiegać z objawami psychiatrycznymi lub neurologicznymi, w tym bólem głowy, dezorientacją, pobudzeniem z agresywnym zachowaniem, dyzartrią, ataksją, halucynacjami i zaburzeniami widzenia,3 objawami, które odzwierciedlają toksyczną encefalopatię metaboliczną. Objawom ze strony układu nerwowego mogą towarzyszyć objawy brzuszne (nudności, wymioty).
Nasze dwa przypadki ilustrują przebieg postępującej hiperamonemii, jeśli leczenie nie zostanie wcześnie rozpoczęte: pogłębiające się zaburzenia poznawcze i obrzęk mózgu, z rozwojem śpiączki, drgawek i zgonu z powodu nadciśnienia wewnątrzczaszkowego.
Gdy nie ma alternatywnego wyjaśnienia dla nieproporcjonalnego i postępującego charakteru zaburzeń poznawczych u pacjenta, powinno to być traktowane jako ważna wskazówka do zbadania możliwości etiologii metabolicznej. Ponieważ pogorszenie następuje w ciągu kilku dni, istnieje możliwość interwencji ratującej życie, jeśli stan zostanie rozpoznany na czas.
Pomiar stężenia amoniaku we krwi jako część przesiewowego badania metabolicznego powinien być wykonany przy najbliższej możliwej okazji w takim przypadku. Jeśli poziom amoniaku jest podwyższony, należy skonsultować się ze specjalistą w dziedzinie metabolizmu, przygotować profil aminokwasów w osoczu, zmierzyć poziom kwasów organicznych i kwasu orotowego w moczu oraz rozpocząć leczenie doraźne hiperamonemii.
Trzy elementy leczenia śpiączki hiperamonemicznej związanej z cyklem mocznikowym obejmują:
-
fizyczne usunięcie amoniaku przez hemodializę lub hemodiafiltrację;
-
odwrócenie stanu katabolicznego przez wlew insuliny/dekstrozy i intralipidu; oraz
-
czasowe wstrzymanie podawania białka i rozpoczęcie podawania zmiataczy azotu, gdy tylko będą dostępne.
Te działania powinny być rozpoczęte pod kierunkiem lekarza zajmującego się metabolizmem i na oddziale intensywnej terapii, gdzie można opanować pobudzenie lub śpiączkę. Poziom amoniaku można szybko zmniejszyć za pomocą dializy; jego usuwanie zależy od szybkości przepływu, co sprawia, że najskuteczniejszą metodą oczyszczania jest hemodializa przerywana, jak pokazano w ramce 2. Z tego powodu opowiadamy się raczej za przerywaną dializą niż za ciągłą żylną hemodiafiltracją w celu wczesnej kontroli amoniaku w warunkach nagłych.
Choć poważne upośledzenie neurologiczne na początku leczenia jest bardzo niepokojące, samo w sobie nie powinno być powodem do wstrzymania leczenia, ponieważ możliwy jest dobry powrót neurologiczny. Ilustruje to opis przypadku pacjenta w średnim wieku, który wyzdrowiał, pomimo dekortykacji w momencie rozpoczęcia leczenia.5
Popowiadamy się za wczesną oceną poziomu amoniaku u pacjentów z niewyjaśnionym zmienionym stanem świadomości lub gdy ich zaburzenia poznawcze wydają się nieproporcjonalne do współistniejącej choroby ogólnoustrojowej. Wiele z niezbędnych elementów opieki może być rozpoczętych na oddziałach intensywnej opieki medycznej niebędących szpitalami. Rozpoczęcie leczenia w szpitalu, w którym nastąpiło zgłoszenie jest niezbędne, ponieważ jest to nagły przypadek medyczny; wynik neurologiczny i przeżycie zależą w decydującym stopniu od czasu interwencji. W przypadku wczesnego rozpoznania i odpowiedniego leczenia rokowanie co do powrotu do zdrowia jest dobre.
Wnioski dla praktyki
-
Zaburzenia cyklu mocznikowego mogą wystąpić po raz pierwszy w wieku dorosłym, zdemaskowane przez czynniki wyzwalające, takie jak choroba ogólnoustrojowa, zwiększone obciążenie białkiem, zabieg chirurgiczny lub kortykosteroidy.
-
Ocena stężenia amoniaku jest prostym, ale krytycznym badaniem u pacjentów z niewyjaśnionymi zaburzeniami świadomości.
-
Sesja przerywanej hemodializy jest wysoce skuteczna w celu szybkiej kontroli amoniaku i przewyższa ciągłą hemodiafiltrację w celu szybkiej korekty.
-
Pilne leczenie hiperamonemii powinno być podjęte wcześnie, aby zapobiec wyniszczającemu uszkodzeniu neurologicznemu.
Box 1 – Historie przypadków dwóch pacjentów
Pacjent 1: 24 lata, mężczyzna
Historia medyczna
- Obturacyjny bezdech senny; brak godnego uwagi wywiadu rodzinnego; osoba wysoko funkcjonująca
- Prawdopodobnie czynnik poprzedzający: deksametazon śródoperacyjnie (8 mg) podczas zabiegu septoplastyki nosa
Postępy
- Niewidomość i senność 48 h po operacji, postępujące w ciągu 24 h do niespójności
- Intubowany 12 h później z powodu ciężkiego pobudzenia
- GCS obniżył się do 5-6 w ciągu następnych 48 h; poziom amoniaku, 334 μmol/L (RR, < 50 μmol/L); Rozpoczęto leczenie specyficzne dla choroby
- Podwyższone ciśnienie śródczaszkowe 6 h później (rozszerzone źrenice z obrzękiem mózgu w CT mózgu), co doprowadziło do kraniektomii dekompresyjnej powikłanej krwiakiem czołowym, wymagający ewakuacji
- Przedłużony oddział intensywnej terapii i pobyt w szpitalu
Postępowanie
- Przetrwały minimalnie przytomny stan (w wieku 22 miesięcy)
- Wypisany do ośrodka opiekuńczego
- Analiza biochemiczna osocza i moczu zgodna z niedoborem OTC (podwyższony poziom kwasu orotowego w moczu; wysoki poziom glutaminy w osoczu; niski poziom ornityny, cytruliny i argininy w osoczu)
- Badania genetyczne potwierdziły mutację genu OTC związaną z niedoborem OTC
Pacjent 2: 39 lat, mężczyzna
Historia medyczna
- Przewlekły ból kolana; brak godnego uwagi wywiadu rodzinnego; osoba wysoko funkcjonująca
- Prawdopodobny czynnik poprzedzający: wstrzyknięcie kortyzonu w kolano z powodu bólu kolana
Postępowanie
- Ból głowy, nudności, ból w nadbrzuszu, niewyraźne widzenie i brak koordynacji 48 h po wstrzyknięciu
- Postępował przez następne 48 h do dezorientacji, spowolnionej mowy
- Progresywny spadek GCS, wymagający intubacji
- Aktywność drgawek
- Powtórne CT mózgu wykazało obrzęk mózgu
- Stężenie amoniaku: 652 μmol/L (RR, < 50 μmol/L); rozpoczęto leczenie specyficzne dla choroby; założono monitor ciśnienia wewnątrzczaszkowego; brak kontroli nadciśnienia wewnątrzczaszkowego; decyzja o paliatywizacji
Dolegliwość
- Postępowanie w kierunku śmierci mózgu i dawstwa narządów (z wyjątkiem dawstwa wątroby: przeciwwskazane)
- Wyniki badań biochemicznych zgodne z niedoborem OTC (głębokie podwyższenie kwasu orotowego w moczu, wysoki poziom glutaminy w osoczu, niski poziom argininy)
- Badania genetyczne potwierdziły mutację genu OTC związaną z niedoborem OTC
GCS = Glasgow coma score; RR = zakres referencyjny; CT = tomografia komputerowa; OTC = transkarbamylaza ornitynowa.
Boks 2 – Poziomy amoniaku u naszych dwóch pacjentów i ich odpowiedź na leczenie*
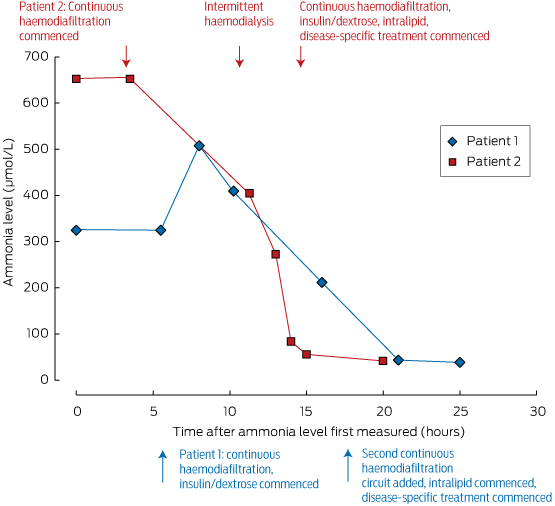
* Należy zwrócić uwagę na szybkie tempo spadku poziomu amoniaku w surowicy u Pacjenta 2 osiągnięte po rozpoczęciu przerywanej hemodializy (około 10 godzin po pierwszym pomiarze).
.