- Introduction: Klinika Migreny
- Patofizjologia migreny i peptydu związanego z genem kalcytoniny (Calcitonin Gene-Related Peptide, CGRP)
- Interwencje farmakologiczne na szlaku CGRP
- Zależność farmakokinetyka (PK)/farmakodynamika (PD) mAbs Anti-Migraine
- Podsumowanie
- Author Contributions
- Oświadczenie o konflikcie interesów
Introduction: Klinika Migreny
Migrena polega na jednostronnym bólu głowy, któremu towarzyszy zespół innych objawów czuciowych, autonomicznych i poznawczych i została zidentyfikowana w badaniu globalnego obciążenia chorobami (GBD) z 2016 r. jako szóste najbardziej rozpowszechnione zaburzenie i jedna z głównych przyczyn niepełnosprawności na całym świecie, często występująca w wieku produkcyjnym oraz u młodych dorosłych i kobiet w średnim wieku (Collaborators, 2018). W związku z tym migrena stanowi bardzo poważny problem społeczny pod względem lat życia przeżytych z niepełnosprawnością (YLDs) i najważniejszą przyczynę YLDs w wieku od 15 do 49 lat (patrz Steiner et al., 2018). Obciążenie związane z tą chorobą do niedawna nie zostało zidentyfikowane, ponieważ: migrena nie jest przyczyną trwałej niepełnosprawności lub zgonu; ból głowy sporadycznie występuje w populacji ogólnej (Collaborators, 2018). Chociaż definitywna patogeneza migreny nie jest znana, w jej powstawanie zaangażowane jest krążenie pozaczaszkowe (Drummond i Lance, 1983). Przebieg kliniczny migreny artykułuje się w różnych następujących lub współistniejących fazach: premonitorium, aura, ból głowy i postdrom (podobny do fazy premonitorium) (Goadsby i wsp., 2017a). Faza zwiastunowa obejmuje drażliwość, łaknienie jedzenia, sztywność karku i może występować od 2 do 72 h przed atakiem i trwa przez pozostałe fazy. Zgodnie z definicjami Międzynarodowej Klasyfikacji Zaburzeń Bólu Głowy wydanie trzecie (ICHD-3):
– aura charakteryzuje się jednym lub więcej przemijającymi, odwracalnymi deficytami neurologicznymi, z których przynajmniej jeden musi mieć jednostronną lokalizację, które rozwijają się przez 5 min lub dłużej i z których każdy deficyt trwa od 5 do 60 min;
– migrena polega na napadach bólu głowy trwających 472 h, którym towarzyszą nudności, fotofobia i fonofobia lub oba te objawy (zob. Goadsby i wsp., 2017a).
Skórna allodynia, definiowana jako percepcja bólu po bodźcach niebolesnych, występuje u ponad 70% pacjentów (Lambru i in., 2018). Silny ból głowy słabnie, aż do ustąpienia w fazie postdromowej, podczas gdy inne objawy, takie jak astenia, senność i fotofobia, nadal dotykają pacjenta, ukazując w ten sposób złożone podłoże neuronalne leżące u podstaw migreny (Lambru i in., 2018). W zależności od liczby dni w miesiącu, których dotyczy migrena, jest ona klasyfikowana jako epizodyczna (mniej niż 15 dni migreny lub bólu głowy) lub przewlekła (co najmniej 15 dni, z których 8 lub więcej to dni migrenowe) (zob. Goadsby i in., 2017b). Ten aspekt wpływa znacząco na skutki choroby i możliwości terapeutyczne (Giamberardino et al., 2017). W przypadku 1 do 3 ataków na miesiąc możliwe jest stosowanie jedynie leków objawowych o działaniu abortywnym, podczas gdy w przypadku wystąpienia 4 do 14 ataków na miesiąc obowiązkowe jest dodanie leczenia zapobiegawczego; to ostatnie leczenie jest konieczne, aby uniknąć przewlekłości choroby (Giamberardino i Martelletti, 2015; Giamberardino i in., 2017) oraz w celu zmniejszenia ryzyka wystąpienia bólu głowy spowodowanego nadużywaniem leków i migreny opornej na leczenie (Martelletti, 2017).
Patofizjologia migreny i peptydu związanego z genem kalcytoniny (Calcitonin Gene-Related Peptide, CGRP)
Dokładna przyczyna napadów migreny nie jest jeszcze dobrze poznana, ale aktualne badania podkreślają znaczenie procesów sensytyzacji w obrębie układu trójdzielno-naczyniowego i całego pnia mózgu, a także obserwację zmniejszonej ilości istoty szarej w obszarach przetwarzających ból (patrz Goadsby i in., 2017a). Ze zwoju trójdzielnego zawierającego ciało komórki pseudo-unipolarne aferenty pierwotne synapsują na naczynia krwionośne oraz na kompleks trójdzielno-szyjny, z którego włókna drugiego rzędu synapsują na neurony wzgórzowo-korowe trzeciego rzędu oraz na locus coeruleus, periaqueductal gray i podwzgórze (Goadsby i in., 2017a). Włókna nocyceptywne ze zwoju trójdzielnego i zwoju grzbietowego korzenia szyjnego unerwiają naczynia opony twardej, a ich zakończenia uwalniają wazoaktywne neuropeptydy, takie jak peptyd związany z genem kalcytoniny (CGRP) indukujący wazodylatację. Ekspresję CGRP, CLR i RAMP1 w ludzkich naczyniach opony twardej przedstawiono na rycinach 1A-C. Istotnie, autonomiczne włókna nerwowe unerwiające naczynia zewnątrzmózgowe zawierają kilka neuroprzekaźnikowych cząsteczek wazoaktywnych: noradrenalinę, serotoninę, acetylocholinę, neuropeptyd Y (NPY), wazoaktywny polipeptyd jelitowy (VIP), substancję P (SP), neurokininę A (NU) i CGRP (Goadsby i wsp., 1990). Antagoniści receptora CGRP działają blokując informacje nocyceptywne z opony twardej: są one przetwarzane w jądrach wzgórza, skąd docierają do wyższych obszarów korowych. Wejścia z układu trójdzielno-naczyniowego podlegają modulacji przez drogę zstępującą pnia mózgu: agoniści receptorów 5-hydroksytryptaminy (5HT)1B/1D, czyli tryptany, mają działać przez ten układ i przeciwdziałać występującemu rozszerzeniu naczyń. O ile propranolol i topiramat są lekami profilaktycznymi, o tyle te ostatnie stosuje się w ostrych epizodach migreny. W szczególności, oprócz działania wazokonstrykcyjnego, tryptany działając bezpośrednio na receptory presynaptyczne 5HT1B/D hamują uwalnianie mediatorów, takich jak CGRP, biorących udział w nocycepcji. Ponadto eksperymentalnie wykazano, że sumatryptan hamuje prąd wsteczny mediowany przez receptor TRPV1 (transient receptor potential vanilloid 1) w zwojach nerwu trójdzielnego (Evans i wsp., 2012). CGRP jest uwalniany podczas napadów migreny i pełni szereg funkcji jako najbardziej wazoaktywny neuropeptyd, którego poziom w naczyniach czaszkowych wzrasta w przebiegu tego zaburzenia (Goadsby i in., 1990). Wykazano, że CGRP ulega zmianom również w płynie mózgowo-rdzeniowym (van Dongen i wsp., 2017). Od dawna badane są czynniki wyzwalające zmienioną pobudliwość ośrodkową i następujące po niej przełamanie epizodów bólu migrenowego. Stymulacja włókien nerwowych może sprzyjać powstawaniu zarówno ortodromicznych, jak i antydromicznych potencjałów czynnościowych, a w szczególności aktywacja duralnych peptydergicznych pierwotnych aferentów czuciowych, które wykazują ekspresję przejściowego potencjału receptorowego (TRP), może indukować uwalnianie kilku cząsteczek, w tym CGRP, które wyzwalają reakcje zapalne tkanek, znane jako zapalenie neurogenne (Xanthos i Sandkuhler, 2014). W szczególności CGRP bierze udział w nocycepcji czaszkowej oraz w epifenomenie wazodylatacji wiążąc swoje receptory na oponowych i mózgowych naczyniach krwionośnych (Deen i in., 2017). Procesy te sprzyjają sensytyzacji włókien trójdzielnych drugiego rzędu przenoszących wzmocnione bodźce bólowe do wyższych regionów, takich jak wzgórze, podwzgórze i kora mózgowa, dając początek migrenie (Dussor i wsp., 2014). TRPs podlegają aktywacji w odpowiedzi na kilka środowiskowych bodźców drażniących, takich jak zmiany temperatury i pH, które u osób predysponowanych mogą wyzwalać ból migrenowy. CGRP powstaje w wyniku tkankowo-specyficznego alternatywnego splicingu genu kalcytoniny CALC I na chromosomie 11, kodującego również kalcytoninę. Przeciwnie, β CGRP jest produkowany z genu CALC II zlokalizowanego w innym miejscu chromosomu 11. Neuropeptyd α CGRP występuje w ośrodkowym układzie nerwowym jako izoforma α o długości 37 aminokwasów, a w transdukcji sygnału pośredniczą dwa receptory.
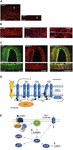
Rysunek 1. Występowanie i szlak CGRP w migrenie. Ekspresja CGRP, CLR i RAMP1 w ludzkich naczyniach twardych: (A) immunoreaktywność CGRP stwierdza się w cienkich włóknach w adventitia; (B) przekroje poprzeczne i podłużne wykazujące ekspresję RAMP1 w cytoplazmie komórek mięśni gładkich; (C) koekspresja CLR i RAMP1 w warstwie komórek mięśni gładkich. (D) Składniki receptora CGRP i reszty ważne dla sygnalizacji i internalizacji receptora. Receptor CGRP składa się z CLR (niebieski), RAMP1 (żółty) i RCP (pomarańczowy). Ważne funkcjonalnie reszty są przedstawione w postaci skrótów jednoliterowych. Reszty aminokwasowe są ponumerowane od początku przewidywanego N-końcowego peptydu sygnałowego (Swiss-Prot Q16602). Kilka aminokwasów w obrębie C-końca CLR (∼N400-C436) i I312 w miejscu połączenia ICL3/TM5 jest wymaganych do efektywnej internalizacji CGRP. Zilustrowano ważne cechy receptora CGRP, w tym „załamanie” TM6 (P343) i przypuszczalną ósmą helisę (∼G388-W399) w CLR. C′, C-końcowy; ECL, pętla zewnątrzkomórkowa; ICL, pętla wewnątrzkomórkowa; N′, N-końcowy; TM, transmembranowy. (E) Sygnalizacja wewnątrzkomórkowa pośredniczona przez receptor CGRP: Sygnalizacja Gαs zwiększa aktywność AC (zielony), podnosząc wewnątrzkomórkowy cAMP, aktywując PKA, a następnie wiele potencjalnych efektorów. Panele (A-C) zaadaptowano z Eftekhari et al. (2013), a panel (D,E) z Walker et al. (2010), odpowiednio, za pozwoleniem.
Pierwszy z nich jest znany jako kanoniczny receptor CGRP i jest receptorem sprzężonym z białkiem Gαs, który wymaga białka modyfikującego aktywność receptora (RAMP) 1, aby był funkcjonalny (Goadsby et al., 2017a). Drugim jest ludzki receptor amyliny podtypu 1 (AMY1): amylina należy do rodziny genów kalcytoniny i ma aktywność hormonalną. Kiedy CGRP wiąże się ze swoim receptorem, po skompleksowaniu z β-arrestiną ulega internalizacji zależnej od dynaminy/klatryny (zob. Walker i in., 2010). Dochodzi do zmian konformacyjnych indukujących aktywację cyklazy adenylanowej (AC), wzrost cAMP i aktywację kinazy białkowej A (PKA), co może sprzyjać wazodylatacji poprzez bezpośrednią aktywację śródbłonkowej syntazy tlenku azotu i odpowiedzi bólowej. Ten ostatni receptor może być sprzężony z Gαq/11 z aktywacją fosfolipazy C (PLC), z kinazą białkową aktywowaną mitogenem (MAPK) i z uwalnianiem NO (patrz Walker i in., 2010) (patrz ryc. 1D,E dla schematycznego przedstawienia wewnątrzkomórkowej sygnalizacji pośredniczonej przez receptor CGRP). Podawanie CGRP migrenowcom wyzwala ataki i dowody te wspierają jego kluczową rolę w patogenezie migreny (Lassen i in., 2002). System zakończenia sygnału nie został jeszcze zidentyfikowany: CGRP jest metabolizowany przez neprylizynę, enzym degradujący insulinę i enzym konwertujący endotelinę-1, a także wysunięto hipotezę o aktywnym systemie transportu zwrotnego (zob. Russell i wsp., 2014). Ponadto, gdy receptor jest przejściowo aktywowany przez CGRP, jest internalizowany do endosomów i szybko recyrkulowany z powrotem do błony komórkowej, podczas gdy przewlekła stymulacja receptora indukuje desensytyzację i degradację lizosomalną (patrz Russell i in., 2014).
Interwencje farmakologiczne na szlaku CGRP
Migrena jest wieloaspektowym upośledzającym zaburzeniem nerwowo-naczyniowym, a obecna terapia doustnymi tryptanami jest skuteczna w ostrych atakach, choć około 40% pacjentów jest opornych na leczenie (Ferrari i in., 2001; Edvinsson, 2015). Ci selektywni agoniści 5-HT1B/1D, z których najczęściej stosowany jest sumatryptan aktywny głównie na drogę podskórną, wywierają swoje działanie terapeutyczne poprzez skurcz naczyń czaszkowych oraz hamowanie układu trójdzielnego i trójdzielno-szyjnego (zob. Ferrari i in., 2001). Skurcz naczyń stanowi jednak granicę dla działań niepożądanych ze strony układu sercowo-naczyniowego tych leków. Ponadto leczenie triptanami nie może trwać dłużej niż 9 dni w miesiącu ze względu na ryzyko wystąpienia polekowego bólu głowy. W 2010 roku toksyna botulinowa typu A (BoNT-A) została zatwierdzona przez Food and Drug Administration (FDA) w zapobieganiu migrenie u niereagujących na leczenie migrenowców przewlekłych, a jej skomplikowany sposób podawania (wymaga iniekcji w 31 miejscach) ogranicza compliance pacjentów. Ze względu na kluczową rolę CGRP w patofizjologii migreny, opracowano antagonistów jego receptora. Leki te należą do klasy gepantów. Telgecepant, pierwszy doustny gepant, okazał się dobrze tolerowany u migrenowców dotkniętych chorobą wieńcową (ClinicalTrials.gov NCT00662818, Ho i wsp., 2012), ale wykazywał hepatotoksyczność, dlatego, pomimo ciągłych badań nad tymi małymi cząsteczkami, zaproponowano nowe podejście polegające na opracowaniu przeciwciał monoklonalnych (mAbs) przeciwko CGRP (nezumabs) lub receptorowi CGRP (numabs). Uważa się, że leki te hamują działanie krążących cząsteczek CGRP w celu zapobiegania napadom migreny, a ponieważ ze względu na swój rozmiar nie przekraczają bariery krew-mózg (BBB), miejsca ich działania powinny znajdować się w układzie nerwu trójdzielnego (Edvinsson, 2015). W szczególności, naczynia duralowe nie są objęte BBB. Co więcej, CGRP prawdopodobnie nie przekracza BBB i działa jako modulator parakrynny, ponieważ ulega ekspresji przez połowę neuronów zwoju trójdzielnego, które nie prezentują receptora CGRP, ulega ekspresji przez satelitarne komórki glejowe i 30% somy neuronów zwoju trójdzielnego (zob. Yuan i in., 2017). Obecnie w badaniach klinicznych badane są cztery mAbs: eptinezumab, fremanezumab, galcanezumab i erenumab w leczeniu migreny epizodycznej i przewlekłej. Pierwsze trzy mAbs są humanizowanymi przeciwciałami skierowanymi na CGRP, natomiast erenumab jest ludzkim przeciwciałem skierowanym na jego kanoniczny receptor. Okres półtrwania tych leków jest dość długi, co pozwala na nie więcej niż jedno podanie w miesiącu i jest to interesujące, ponieważ mAbs muszą być podawane drogą dożylną lub podskórną. W szczególności eptinezumab jest podawany wyłącznie dożylnie (Israel et al., 2018). W badaniu III fazy PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) oceniano skuteczność eptinezumabu w zapobieganiu częstym migrenom epizodycznym. Wyniki wykazały istotną redukcję pierwszorzędowego punktu końcowego polegającą na zmniejszeniu liczby miesięcznych dni migrenowych (MMDs) ze średniej wartości wyjściowej 8,5 dnia w tygodniach 1-12 do 4,3 MMDs przy dawce 300 mg, 3,9 przy 100 mg i 4,0 przy 30 mg w odniesieniu do 3,2 dni placebo (Saper et al., 2018). Do oceny eptinezumabu w profilaktyce przewlekłej migreny zrekrutowano 1121 uczestników do badania PROMISE 2 (ClinicalTrials.gov NCT02974153). Galcanezumab oceniano pod względem skuteczności w zapobieganiu migrenie epizodycznej w badaniu EVOLVE-1 fazy 3 z podwójnie ślepą próbą, randomizowanym, kontrolowanym placebo (ClinicalTrials.gov NCT02614183) podzielonym na 4 okresy oraz w badaniu EVOLVE-2 fazy 3 z randomizacją, kontrolowanym podwójnie ślepą próbą, trwającym 6 miesięcy (ClinicalTrials.gov NCT02614196). W badaniu EVOLVE-1 obie dawki galcanezumabu (120 i 240 mg) spełniły pierwszorzędowy wynik istotnego zmniejszenia liczby dni miesięcznego migrenowego bólu głowy odpowiednio o 4,7 dnia i 4,6 dnia w porównaniu z 2,8 dniami w przypadku placebo (Stauffer et al., 2018). W badaniu EVOLVE-2 pacjenci otrzymywali comiesięczne iniekcje 120 lub 240 mg galcanezumabu. Średnia miesięczna liczba dni migrenowych bólów głowy została zredukowana odpowiednio o 4,3 i 4,2 dnia w porównaniu z redukcją o 2,3 dnia uzyskaną w przypadku placebo (p < 0,001) (Skljarevski et al., 2018). Spełnione zostały również drugorzędowe punkty końcowe dotyczące zmniejszenia upośledzenia funkcjonowania ocenianego za pomocą wyniku domeny Role Function-Restrictive (R-FR) kwestionariusza Migraine-Specific Quality of Life Questionnaire (MSQ) oraz poprawy wyniku w skali Patient Global Impression of Severity (PGI-S) i Migraine Disability Assessment (MIDAS; punkt czasowy = miesiąc 6.) (Skljarevski et al., 2018). U 147 (65,0%) i 163 (71,5%) pacjentów leczonych galcanezumabem, odpowiednio 120 i 240 mg, oraz u 287 (62,3%) z placebo wystąpiły zdarzenia niepożądane, wśród których odnotowano ostry zawał mięśnia sercowego i przemijający napad niedokrwienny w grupie siedmiu pacjentów objętych leczeniem galcanezumabem 240 mg (Skljarevski et al., 2018). Nie stwierdzono istotnych statystycznie różnic w zakresie średniej zmiany od linii podstawowej dla skurczowego/rozkurczowego ciśnienia tętniczego. U 19 (8,6%), 11 (5,1%) i 2 (0,5%) pacjentów w grupach odpowiednio galcanezumabu 120 mg, galcanezumabu 240 mg i placebo wystąpiły przeciwciała przeciwleukotrienowe (ang. treatment-emergent anti-drug antibodies, ADA). W badaniu III fazy REGAIN oceniającym galcanezumab przeciwko przewlekłej migrenie MMD uległy skróceniu o 4,8 dnia w przypadku dawki 120 mg i o 4,6 dnia w przypadku dawki 240 mg w porównaniu z 2,7 w przypadku placebo (patrz Yuan i wsp., 2017). Ponadto wykazano, że leczenie galcanezumabem było obdarzone istotną statystycznie trwałością efektu (Forderreuther et al., 2018). Fremanezumab był badany w badaniu III fazy HALO w profilaktycznym leczeniu migreny (ClinicalTrials.gov NCT02638103). Zmniejszał on MMD migreny epizodycznej po 12 tygodniach o 3,7 dnia przy dawce 225 mg miesięcznie przez 3 miesiące oraz o 3,4 dnia przy dawce 675 mg raz na kwartał w schemacie dawkowania w porównaniu ze zmniejszeniem o 2,2 dnia w przypadku placebo (zob. Yuan i wsp., 2017). Skuteczność erenumabu w profilaktyce migreny epizodycznej badano w 3. fazie, randomizowanego, podwójnie zaślepionego, kontrolowanego placebo badania ARISE (ClinicalTrials.gov NCT02483585). MMDs zostały zredukowane przez 70 mg miesięcznie podskórnego erenumabu o 2,9 dnia w porównaniu z 1,8 dniami placebo (p < 0,001) i był skuteczny w drugorzędowych punktach końcowych co najmniej 50% redukcji MMDs i zmiany w miesięcznej liczbie dni leczenia lekami specyficznymi dla migreny (MSMD) (Dodick et al., 2018). Odsetek pacjentów prezentujących zdarzenia niepożądane był podobny pomiędzy grupą leczoną mAbem i placebo; 4,3% testowało dodatni wynik dla przeciwciał wiążących anty-erenumab do 12 tygodnia, z czego jeden z nich przejściowo dodatni dla przeciwciał neutralizujących, ale tylko w 4 tygodniu (Dodick et al., 2018). Również w badaniu klinicznym III fazy STRIVE (ClinicalTrials.gov NCT02456740) oceniano skuteczność erenumabu w zapobieganiu migrenie epizodycznej. Erenumab podawano w dawce 70 lub 140 mg miesięcznie przez 6 miesięcy (Goadsby i wsp., 2017b). Podstawowa średnia liczba MMD wynosiła 8,3, a dawki 70 mg i 140 mg zmniejszyły ją odpowiednio o 3,2 i 3,7 w porównaniu z 1,8 dniami placebo (przy p < 0,001 dla każdej dawki vs. placebo) (Goadsby i wsp., 2017b). Również w ciągu końcowych 3 miesięcy leczenia każda dawka erenumabu spełniała drugorzędowe punkty końcowe w postaci co najmniej 50% redukcji od wartości wyjściowej średniej liczby dni migrenowych w miesiącu oraz redukcji od wartości wyjściowej zarówno w skali Migraine Physical Function Impact Diary (MPFID) everyday-activities (MPFID-EA), jak i physical-impairment (MPFID-PI) (Goadsby et al., 2017b). U pacjentów z przeciwciałami anty-erenumab tylko u jednego w grupie leczonej dawką 70 mg uzyskano dodatni wynik testu na obecność przeciwciał neutralizujących, a mAb był ogólnie dobrze tolerowany pod względem poziomu kreatyniny, toksyczności wątrobowej, całkowitej liczby neutrofilów i funkcji elektrokardiograficznej (Goadsby i wsp., 2017b). Według autorów jednym z ograniczeń tego badania jest to, że wykluczono pacjentów, którzy nie wykazali odpowiedzi terapeutycznej na więcej niż dwie klasy leków zapobiegających migrenie (Goadsby i in., 2017b). Ponadto istnieją badania kliniczne badające skuteczność fremanezumabu (NCT02945046 i NCT02964338) i galcanezumabu (NCT 02397473 i NCT02438826) w profilaktyce klasterowego bólu głowy (zob. Israel i in., 2018), czyli pierwotnego bólu głowy charakteryzującego się silnym jednostronnym bólem w okolicy okołooczodołowej, któremu towarzyszy łzawienie, zaczerwienienie spojówek i katar (Vollesen i in., 2018). Rzeczywiście, wykazano, że ciągły wlew dożylny przez pompę infuzyjną 1,5 μg/min CGRP przez 20 min (w ciągu 2 dni oddzielonych od siebie o co najmniej 7 dni) pacjentom z epizodycznym (faza aktywna lub remisji) lub przewlekłym klasterowym bólem głowy wywoływał ataki klasteropodobne u pacjentów w fazie aktywnej lub z przewlekłym klasterowym bólem głowy, ale nie w fazie remisji (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). Główne zalety PK mAbs to długi okres półtrwania eliminacji, ograniczający konieczność codziennego dawkowania oraz klirens na drodze proteolizy. Ze względu na wpływ gepantów na wątrobę oraz ze względu na naczyniorozszerzające właściwości CGRP, najbardziej obawiane zagrożenia związane z hamowaniem sygnalizacji CGRP polegają na hipotetycznej hepatotoksyczności oraz teoretycznym ryzyku sercowo-naczyniowym (Yuan et al., 2017). European Headache Federation (EHF) opracowała wytyczne dotyczące stosowania mAbs anty-CGRP, stosując metodę GRADE (Grading of Recommendation, Assessment, Development and Evaluation), a gdy nie jest to możliwe, opierając się na opinii panelu ekspertów (Sacco et al., 2019).
Zależność farmakokinetyka (PK)/farmakodynamika (PD) mAbs Anti-Migraine
Rozwój mAbs stanowił zupełnie nowe podejście do hamowania szlaku CGRP. Główna poprawa PD osiągnięta przy użyciu mAbs zamiast małych cząsteczek polega na tym, że łatwiej jest celować w szerokie miejsce wiązania receptora CGRP z ligandem (Taylor, 2018). Główne zalety PK mAbs są reprezentowane przez długi okres półtrwania eliminacji bez potrzeby codziennego dawkowania i klirensu przez proteolizę, a najbardziej obawiane zagrożenia związane z hamowaniem sygnalizacji CGRP polegają na hipotezowanej hepatotoksyczności, ze względu na wpływ gepantów na wątrobę, i teoretycznym ryzyku sercowo-naczyniowym, ze względu na właściwości wazodylatacyjne CGRP. Jednakże, podążając drogą tych mAbs od ich produkcji do celu, pierwszą przeszkodą, jaką napotykają te cząsteczki, jest ich podawanie ze względu na ich niewielką biodostępność doustną. Dlatego wymagana jest pozajelitowa droga podania, a żeby sprzyjać przestrzeganiu leczenia, okres półtrwania musi być długi (Taylor, 2018). Możliwością są immunoglobuliny (Ig)G1, 2, lub 4 (Wang et al., 2008; Taylor, 2018). Poza pochodzeniem IgG, ewentualna reaktywność krzyżowa i indywidualne modyfikacje katabolizmu mogą wpływać na okres półtrwania (Bonilla, 2008; Taylor, 2018). Technologia stosowana do produkcji mAbs opiera się na wykorzystaniu hybrydomów złożonych z komórek w ciągłym podziale, które produkują zdeterminowane klony jednego typu przeciwciała, bez lub z niską zmiennością (Taylor, 2018). Na podstawie pochodzenia aminokwasów wchodzących w skład mAb można wyróżnić mAby chimeryczne (immunizacja gryzoni; zachowanie gryzoniowego regionu wiążącego antygen Fab, ale wprowadzenie ludzkiego regionu krystalizującego Fc), humanizowane (zumaby, z mysimi regionami determinującymi komplementarność, CDRs, zaszczepionymi do ludzkich regionów Fab) i ludzkie (wprowadzenie całej sekwencji genu ludzkiego przeciwciała u myszy, która staje się humanizowana, jak np. XenoMouse) (zob. Taylor, 2018). CDR-y wpływają na dopasowanie do celu. Wśród 4 mAbs anty-migrenowych tylko erenumab jest ludzki, podczas gdy zaszczepione CDR-y pochodzą od myszy dla fremanezumabu, królika dla eptinezumabu i prawdopodobnie myszy dla galcanezumabu (patrz Taylor, 2018). W szczególności, jedynym mAbem przeciwko receptorowi CGRP jest erenumab, który jest ludzką IgG2λ, a pozostałe trzy mAby skierowane przeciwko miejscom CGRP to: eptinezumab, genetycznie zmodyfikowana humanizowana IgG1k; fremanezumab, humanizowana IgG2k; galcanezumab, humanizowana IgG4 (Edvinsson i in., 2018). Erenumab (Tmax 3-14 dni) wymaga comiesięcznego podawania podskórnego, podobnie jak fremanezumab (Tmax 3-20 dni) i galcanezumab (Tmax 7-14 dni) (Taylor, 2018). Przeciwnie, eptinezumab (Tmax 4,8 h) jest podawany dożylnie raz na 3 miesiące; asocjuje szybciej i dysocjuje wolniej niż fremanezumab i galcanezumab. Ponieważ mAbs są białkami o dużych rozmiarach, nie mogą łatwo przekroczyć BBB. Niektóre receptory CGRP znajdują się poza BBB, co umożliwia działanie mAbs anty-CGRP (Edvinsson, 2018). Przed związaniem przeciwciało dostaje się do komórek śródbłonka naczyniowego poprzez pinocytozę. Duża pozorna objętość dystrybucji może zależeć od tkanki i związanej z nią zdolności wiązania mAb (Lobo i wsp., 2004; Taylor, 2018). Erenumab jest najbardziej nowatorskim podejściem, ponieważ jako jedyny celuje w białko fuzyjne zewnątrzkomórkowych domen ludzkiego receptora sprzężonego z białkiem G kalcytoniny CALCRL (wymaganego w receptorach dla CGRP i adrenomeduliny) i RAMP1, w tym kieszeni wiążącej CGRP (Edvinsson i wsp., 2018). Wykazano, że kompetycyjnie hamuje wiązanie -CGRP do ludzkiego receptora CGRP w ludzkich komórkach neuroblastoma (SK-N-MC) z Ki wynoszącym 0,02 ± 0,01 nM (Shi i wsp., 2016). Erenumab wywierał silny i pełny antagonizm akumulacji cAMP stymulowanej przez CGRP z wartością IC50 wynoszącą 2,3 ± 0,9 nM w badaniach czynnościowych przeprowadzonych w SK-N-MC (Shi i wsp., 2016). Co więcej, był on 5000-krotnie bardziej selektywny dla receptora CGRP, nie wykazując działania agonistycznego/antagonistycznego w stosunku do innych ludzkich receptorów z rodziny kalcytoniny, w tym receptorów adrenomedulliny, kalcytoniny i amyliny, aż do najwyższego badanego stężenia 10 μM (Shi i wsp., 2016). Fremanezumab może wywierać swój wpływ na różne naczynia; w rzeczywistości powoduje on zależne od stężenia hamowanie wazodylatacji wywołanej przez CGRP w wstępnie skurczonych ludzkich tętnicach mózgowych, oponowych i obwodowych tętnicach brzusznych (Ohlsson i wsp., 2018). Ponadto CGRP może działać również na neurony i komórki glejowe oraz na limfatyczne (limfopodobne), przy czym te ostatnie są implikowane w ekspresji aury (patrz Messlinger, 2018). Prawdopodobny brak metabolizmu przez enzymy wątrobowe mógłby pozwolić na uniknięcie interakcji lek-lek. Eliminacja następuje poprzez proteolizę aminokwasów w nerkach. Chociaż badania kliniczne donoszą, że te przeciwciała są ogólnie dobrze tolerowane, oprócz podkreślonego bólu w miejscu wstrzyknięcia, istnieją obawy dotyczące ich immunogenności poprzez wytwarzanie ADA (Taylor, 2018). Podczas podwójnie ślepego, randomizowanego, kontrolowanego placebo badania klinicznego (ClinicalTrials.gov NCT 01337596) oceniającego leczenie różnymi schematami pojedynczych i wielokrotnych dawek galcanezumabu, u 11 z leczonych pacjentów (26%) wystąpiły niskie miana (1:10 – 1:80) emergentnej w leczeniu ADA (u 3 pacjentów wzrosło miano wcześniej istniejących przeciwciał), bez odpowiedzi na dawkę i wykrytego wpływu na PK i PD (Monteith et al., 2017). Badanie immunogenności jest niezbędne, ponieważ obecność ADA może przyspieszać usuwanie leku lub, co gorsza, sprzyjać uszkodzeniom narządów końcowych (Taylor, 2018). Główną charakterystykę mAbs przeciwmigrenowych podsumowano w tabeli 1.

Tabela 1. Main characteristics of fremanezumab, eptinezumab, galcanezumab, and erenumab.
Podsumowanie
Migrena jest upośledzającym i wyniszczającym nerwowo-naczyniowym bolesnym schorzeniem stanowiącym ponad 90% przypadków nawracających bólów głowy i w kierunku którego skłonność może być dziedziczona (MacGregor, 2017). Sól sodowa diwalproeksu, walproinian sodu, topiramat, metoprolol, propranolol i timolol mają udowodnione silne, na poziomie A, działanie w profilaktyce migreny (American Academy of Neurology i American Headache Society, 2015). Jednak wszystkie klasyczne doustne terapie zapobiegawcze, w tym trójpierścieniowe leki przeciwdepresyjne, beta-blokery, antagoniści 5-HT2 sporyszu i leki przeciwpadaczkowe nie zostały opracowane dla migreny i zapewniają 50% redukcję liczby miesięcznych dni z bólem migrenowym tylko do 45% migrenowców (D’Amico i Tepper, 2008), również z powodu niskiej adherencji ze względu na skąpą tolerancję. Trwałość i odstawianie leków badano w retrospektywnej analizie roszczeń w USA (Hepp i in., 2017), a wyniki sugerują niską trwałość do początkowo stosowanego leku i wysoką ilość odstawień do 6 miesięcy niezależnie od klasy leku. Ze względu na fundamentalną rolę CGRP w podtrzymywaniu neurozapalenia i sensytyzacji ośrodkowej w szlaku od zwoju trójdzielnego i pnia mózgu do wyższych regionów zaangażowanych w fizjopatologię migreny, opracowano nowe mAbs w kierunku CGRP i jego receptora. Pierwsze małe cząsteczki antagonistów CGRP wykazywały toksyczność wątrobową, ale mAbs nie wytwarzały ani toksycznych metabolitów, ani sercowo-naczyniowych reakcji ubocznych z powodu hamowania wazodylatacji (zob. Deen i wsp., 2017). Nie podkreślono również ośrodkowych działań niepożądanych. Potencjalne długoterminowe efekty blokowania CGRP nadal wymagają badań, ale podstawowa zaleta tych przeciwciał wynika z ich długiego okresu półtrwania, pozwalającego na comiesięczne lub rzadsze iniekcje, co może znacząco poprawić adherencję do leczenia i jego następczą skuteczność (Deen et al., 2017). Tak więc mAbs anty-CGRP mogłyby stanowić skuteczne narzędzia w arsenale terapeutycznym przeciwko niereagującej na leczenie migrenie, jednak konieczne jest dogłębne monitorowanie skuteczności i bezpieczeństwa (tj. produkcji toksycznych metabolitów, immunogenności z ADA, przeciwciał neutralizujących i tkankowej reaktywności krzyżowej oraz działań niepożądanych) (Taylor, 2018). W rzeczywistości dowody ze starszych produktów biotechnologicznych pokazują, że terapie z użyciem mAbs przeciwko czynnikowi martwicy nowotworów α (TNFα) mogą być narażone na wtórne niepowodzenie (w przeciwieństwie do pierwotnych niereagentów) początkowej odpowiedzi terapeutycznej, ponieważ leki te indukują produkcję przeciwciał, które mogą degradować mAb, ale mogą również neutralizować jego działanie przed związaniem się z celem (zob. Prado i in., 2017). Na immunogenność może wpływać glikozylacja, typ mAb, liczba epitopów i zanieczyszczenia w formulacji (zob. Prado i in., 2017). Ponadto kilka pozornie niewytłumaczalnych poważnych działań niepożądanych jest związanych z immunogennością anty-TNFα. Zwrócono uwagę na miejscowe i ogólnoustrojowe reakcje nadwrażliwości, niedobór odporności ze zwiększoną podatnością na infekcje oraz tworzenie kompleksów immunologicznych, które mogą prowadzić nawet do śmierci (zob. Prado i in., 2017). Dlatego zastosowanie diagnostyki terapeutycznej (theranostics) może poprawić wiedzę i prawidłowe postępowanie z tymi farmakologicznymi wyrobami (Bendtzen, 2013; Prado et al., 2017).
Author Contributions
MTC, LAM, PT, and GB conceived the study. DS zebrał wyniki badań, przeanalizował piśmiennictwo i napisał manuskrypt. AA, LR i MN uczestniczyli w przeglądzie piśmiennictwa. Wszyscy autorzy przeczytali i zatwierdzili ostateczną wersję manuskryptu.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
American Academy of Neurology and American Headache Society (2015). Dodatek a: podsumowanie opartych na dowodach wytycznych dla klinicystów, aktualizacja: leczenie farmakologiczne w profilaktyce migreny epizodycznej u dorosłych. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Personalized medicine: theranostics (therapeutics diagnostics) essential for rational use of tumor necrosis factor-alpha antagonists. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmakokinetyka immunoglobuliny podawanej drogą dożylną lub podskórną. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Globalne, regionalne i krajowe obciążenie migreną i napięciowym bólem głowy, 1990-2016: systematyczna analiza dla globalnego badania obciążenia chorobami 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Profilaktyka migreny: ogólne zasady i akceptacja pacjentów. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Blokowanie CGRP u chorych na migrenę – przegląd zalet i wad. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: a phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Extracranial vascular changes and the source of pain in migraine headache. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., and Porreca, F. (2014). Targeting TRP channels for novel migraine therapeutics. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). Antagoniści receptora CGRP oraz przeciwciała przeciwko CGRP i jego receptorowi w leczeniu migreny. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). Szlak CGRP w migrenie jako realny cel dla terapii. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). CGRP jako cel nowych terapii migreny – udane przełożenie z ławki do kliniki. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., and Edvinsson, L. (2013). Differentiation of nerve fibers storing CGRP and CGRP receptors in the peripheral trigeminovascular system. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., and Premkumar, L. S. (2012). Sumatriptan hamuje kanały TRPV1 w neuronach nerwu trójdzielnego. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., and Goadsby, P. J. (2001). Doustne tryptany (agoniści serotoniny 5-HT(1B/1D)) w leczeniu ostrej migreny: metaanaliza 53 badań. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Prewencyjne działanie galcanezumabu u dorosłych pacjentów z migreną epizodyczną lub przewlekłą jest trwałe: dane z badań fazy 3, randomizowanych, podwójnie zaślepionych, kontrolowanych placebo EVOLVE-1, EVOLVE-2 i REGAIN. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). Calcitonin gene-related peptide receptor as a novel target for the management of people with episodic migraine: current evidence and safety profile of erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). Pojawiające się leki w leczeniu migreny. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). Patofizjologia migreny: zaburzenie przetwarzania sensorycznego. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). A controlled trial of erenumab for episodic migraine. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistence and switching patterns of oral migraine prophylactic medications among patients with chronic migraine: a retrospective claims analysis. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomized, controlled study of telcagepant in patients with migraine and coronary artery disease. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). Przeciwciała monoklonalne CGRP do prewencyjnego leczenia migreny. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). Pojawiające się leki w leczeniu migreny: aktualizacja. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002). CGRP może odgrywać rolę przyczynową w migrenie. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Antibody pharmacokinetics and pharmacodynamics. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migraine. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). The application of CGRP(r) monoclonal antibodies in migraine spectrum: needs and priorities. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). The big CGRP flood – sources, sinks and signalling sites in the trigeminovascular system. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Safety, tolerability, pharmacokinetics, and pharmacodynamics of the CGRP binding monoclonal antibody LY2951742 (Galcanezumab) in healthy volunteers. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). Fremanezumab blokuje indukowane przez CGRP rozszerzenie w ludzkich tętnicach mózgowych, oponowych środkowych i brzusznych. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Biologiczne leki anty-TNF: immunogenność leżąca u podstaw niepowodzeń leczenia i zdarzeń niepożądanych. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Calcitonin gene-related peptide: physiology and pathophysiology. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primary results of PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) trial: a phase 3, randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of eptinezumab for prevention of frequent episodic migraines (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Pharmacologic characterization of AMG 334, a potentent and selective human monoclonal antibody against the calcitonin gene-related peptide receptor. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). Efficacy and safety of galcanezumab for the prevention of episodic migraine: results of the EVOLVE-2 Phase 3 randomized controlled clinical trial. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). Ocena galcanezumabu w profilaktyce migreny epizodycznej: randomizowane badanie kliniczne EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). Migrena jest pierwszą przyczyną niepełnosprawności u osób poniżej 50 roku życia: czy politycy zdrowotni zwrócą teraz na to uwagę? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amylina, immunologia i medycyna bólu głowy. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migraine biomarkers in cerebrospinal fluid: a systematic review and meta-analysis. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Effect of infusion of calcitonin gene-related peptide on cluster headache attacks: a randomized clinical trial. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). Regulation of signal transduction by calcitonin gene-related peptide receptors. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Monoclonal antibody pharmacokinetics and pharmacodynamics. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogenne neurozapalenie: reakcje zapalne OUN w odpowiedzi na aktywność neuronów. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). Przeciwciała monoklonalne CGRP dla migreny: przesłanki i postępy. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar
.