Właściwości fizyczne związków jonowych vs. związki kowalencyjne
Ogólnie, jonowe i kowalencyjne związki mają różne właściwości fizyczne. Związki jonowe tworzą twarde krystaliczne ciała stałe, które topią się w wysokich temperaturach i są odporne na parowanie. Właściwości te wynikają z charakterystycznej struktury wewnętrznej ciała stałego jonowego, zilustrowanej schematycznie w części (a) na rysunku 2.7.4, która pokazuje trójwymiarowy układ naprzemiennych jonów dodatnich i ujemnych utrzymywanych razem przez silne przyciąganie elektrostatyczne. W przeciwieństwie do tego, jak pokazano w części (b) na Rysunku 9.5.1, większość związków kowalencyjnych składa się z oddzielnych cząsteczek utrzymywanych razem przez stosunkowo słabe siły międzycząsteczkowe (siły między cząsteczkami), mimo że atomy w każdej cząsteczce są utrzymywane razem przez silne wewnątrzcząsteczkowe wiązania kowalencyjne (siły wewnątrz cząsteczki). Substancje kowalencyjne mogą być gazami, cieczami lub ciałami stałymi w temperaturze i ciśnieniu pokojowym, w zależności od siły oddziaływań międzycząsteczkowych. Kowalencyjne cząsteczkowe ciała stałe mają tendencję do tworzenia miękkich kryształów, które topią się w niskich temperaturach i łatwo odparowują.
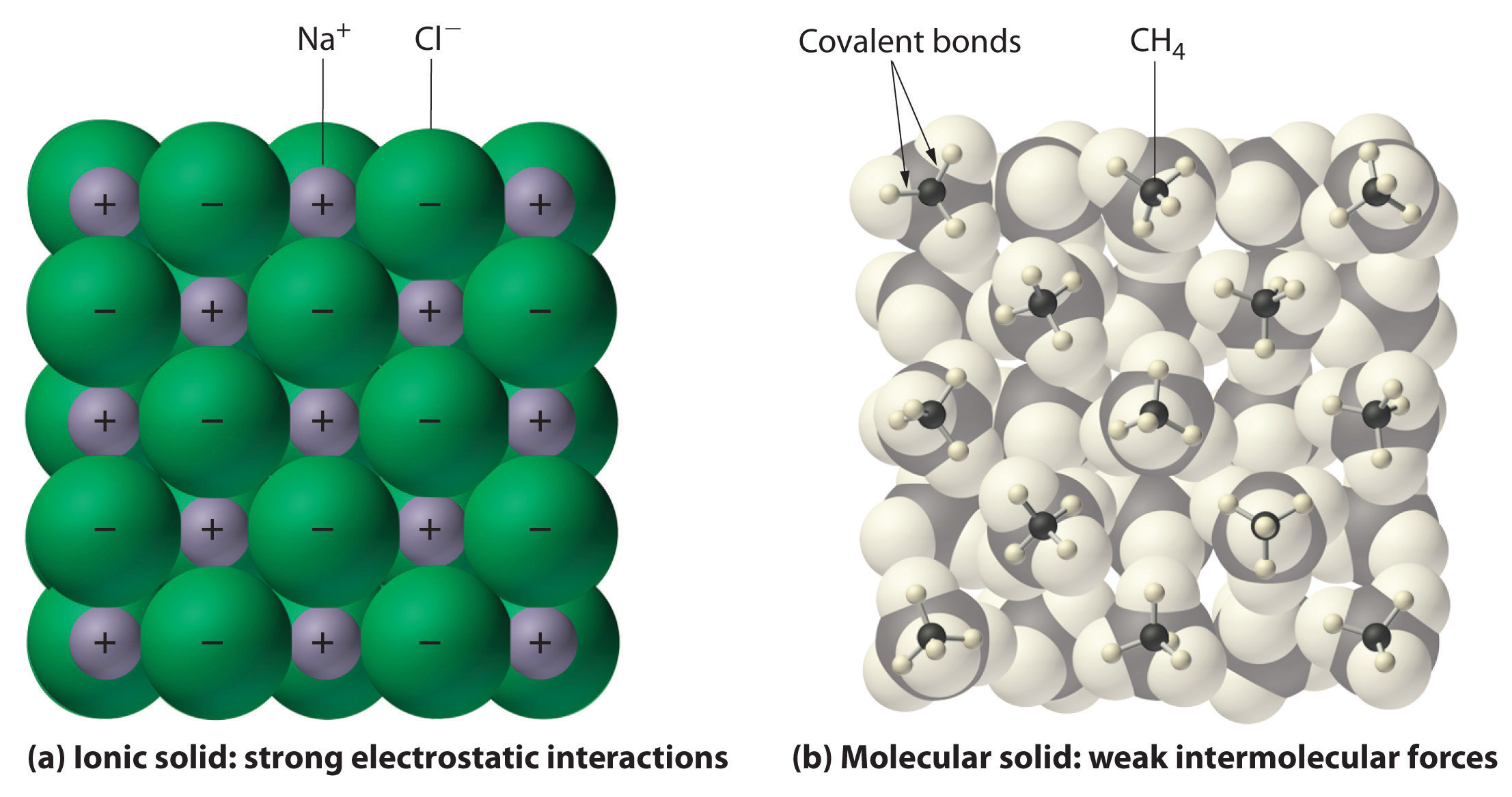
Rysunek 9.5.1: Oddziaływania w ciałach stałych jonowych i kowalencyjnych. (a) Dodatnio i ujemnie naładowane jony w ciele jonowym, takim jak chlorek sodu (NaCl), są utrzymywane razem przez silne oddziaływania elektrostatyczne. (b) W tym przedstawieniu upakowania cząsteczek metanu (CH_4) w metanie stałym, prototypowym ciele stałym molekularnym, cząsteczki metanu są utrzymywane razem w ciele stałym tylko przez stosunkowo słabe siły międzycząsteczkowe, mimo że atomy w każdej cząsteczce metanu są utrzymywane razem przez silne wiązania kowalencyjne.
Węglowodory
Ciała stałe molekularne składają się z atomów lub cząsteczek utrzymywanych ze sobą przez oddziaływania dipolowo-dipolowe, siły dyspersji londyńskiej lub wiązania wodorowe, lub dowolną ich kombinację. Układ molekuł w stałym benzenie jest następujący:

Rysunek 9.5.2: Struktura benzenu w stanie stałym. W stałym benzenie cząsteczki nie są ułożone płaszczyznami równoległymi do siebie, lecz pod kątem 90°.
Ponieważ oddziaływania międzycząsteczkowe w stałych cząsteczkach są stosunkowo słabe w porównaniu z wiązaniami jonowymi i kowalencyjnymi, stałe cząsteczki są zwykle miękkie, niskotopliwe i łatwo odparowują (ΔH_{fus}} i ΔH_{vap}} są niskie). Dla podobnych substancji, siła londyńskich sił dyspersyjnych rośnie płynnie wraz ze wzrostem masy cząsteczkowej. Na przykład, temperatury topnienia benzenu (C6H6), naftalenu (C10H8) i antracenu (C14H10), z jednym, dwoma i trzema stopionymi pierścieniami aromatycznymi, wynoszą odpowiednio 5,5°C, 80,2°C i 215°C. Entalpie syntezy również rosną płynnie w obrębie serii: benzen (9.95 kJ/mol) < naftalen (19.1 kJ/mol) < antracen (28.8 kJ/mol). Jeśli jednak cząsteczki mają kształty, które nie są w stanie upakować się razem w krysztale, wówczas temperatury topnienia i entalpie syntezy są niespodziewanie niskie, ponieważ cząsteczki nie są w stanie ułożyć się tak, aby zoptymalizować oddziaływania międzycząsteczkowe. Tak więc toluen (C6H5CH3) i m-ksylen mają temperatury topnienia odpowiednio -95°C i -48°C, które są znacznie niższe niż temperatura topnienia lżejszego, ale bardziej symetrycznego analogu, benzenu.
Samoregenerująca się guma jest przykładem molekularnego ciała stałego z potencjałem do znaczących zastosowań komercyjnych. Materiał ten może się rozciągać, ale gdy zostanie rozerwany na kawałki, może się ponownie połączyć dzięki przywróceniu sieci wiązań wodorowych, nie wykazując żadnych oznak słabości. Wśród innych zastosowań, jest on badany pod kątem wykorzystania w klejach i oponach rowerowych, które ulegają samoregeneracji.

Rysunek 9.5.3: Toluen i m-ksylen. Grupy metylowe dołączone do pierścienia fenylowego w toluenie i m-ksylenie uniemożliwiają upakowanie pierścieni tak dobrze, jak w litym benzenie.
.