24-6C Reakcje związków nitrowych
Związki nitrowe są dość niestabilne w sensie termodynamicznym; na przykład, ciepło rozkładu nitrometanu, zgodnie z następującą stechiometrią, wynosi \(67.4 ^{kcal mol}^{-1}}).
Wykorzystanie znacznych energii i szybkich szybkości reakcji takich jak ta jest wykorzystywane w komercyjnym użyciu związków nitrowych jako materiałów wybuchowych. W przypadku niektórych związków nitrowych, takich jak trotyl, dodatkową zaletą jest niska wrażliwość na wstrząsy.
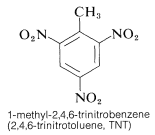
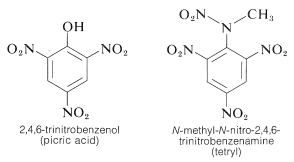
TNT nie ulega łatwo detonacji w wyniku zwykłego uderzenia, a nawet spala się bez eksplozji. Jednakże, po rozpoczęciu detonacji, rozkład postępuje szybko. Cechy umiarkowanej trwałości i wysokiego potencjału termodynamicznego czynią nitrozwiązki szczególnie użytecznymi. Inne polinitrozwiązki, które są użyteczne jako materiały wybuchowe, obejmują PETN (sekcja 17-3C), cyklonit (sekcja 16-4C), kwas pikrynowy i tetryl:
Ważną cechą aromatycznych polinitrozwiązków jest ich zdolność do tworzenia kompleksów „przenoszenia ładunku” z węglowodorami aromatycznymi, zwłaszcza tymi, które są podstawione grupami alkilowymi. Kompleksy 2,4,6-trinitrobenzenolu (kwasu pikrynowego) i węglowodorów aromatycznych często mają postać krystalicznych ciał stałych, które są przydatne do rozdzielania, oczyszczania i identyfikacji węglowodorów aromatycznych. Substancje te nazywane są „pikanami węglowodorów”, ale nazwa ta jest myląca, ponieważ w rzeczywistości nie są one solami. Ponadto, podobne kompleksy tworzą się między węglowodorami aromatycznymi i trinitrobenzenem, co dowodzi, że grupy nitrowe, a nie grupa hydroksylowa są niezbędne do tworzenia kompleksu. Wiązanie w tych kompleksach przypomina wiązanie w kompleksach chlorowców z alkenami i benzenem (sekcje 22-4D i 10-3C) i wynika z sił przyciągających pomiędzy substancjami bogatymi w elektrony i ubogimi w elektrony. Nazwa opisowa – kompleks przenoszący ładunek – sugeruje, że kompleks ma strukturę VB polegającą na przeniesieniu elektronu z cząsteczki donora (bogatej w elektron) do cząsteczki akceptora (ubogiej w elektron). Nazwa kompleks jest również używana, ponieważ zazwyczaj przynajmniej jeden składnik kompleksu posiada układ elektronowy. Kompleksy z przeniesieniem ładunku lub kompleksy z przeniesieniem ładunku pomiędzy polinitrozwiązkami a węglowodorami aromatycznymi wydają się dawać struktury typu sandwich, w których pierścienie aromatyczne znajdują się w płaszczyznach równoległych, choć niekoniecznie wyśrodkowane dokładnie nad sobą:
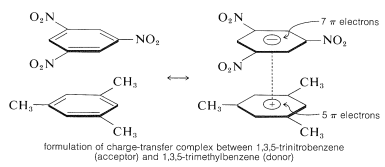
Kompleksy z przeniesieniem ładunku są prawie zawsze silniej zabarwione niż ich poszczególne składniki. Spektakularnym przykładem jest benzen i tetracyanoeten, z których każdy osobno jest bezbarwny, ale które dają jasny pomarańczowy kompleks, gdy zmieszane. Przesunięcie w kierunku dłuższych fal absorpcji, w stosunku do ich składników, jest oczekiwane dla kompleksów przenoszących ładunek z powodu zwiększonej możliwości stabilizacji stanu wzbudzonego poprzez delokalizację elektronów z udziałem obu składników.
Redukcja związków nitrowych zachodzi łatwo przy użyciu różnych czynników redukujących, a takie redukcje umożliwiają szczególnie użyteczną syntezę amin aromatycznych (sekcja 23-12B):
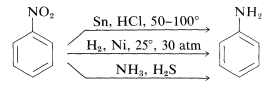
Redukcja związku nitrowego do aminy wymaga sześciu równoważników czynnika redukującego:
Nie można oczekiwać, że taka redukcja zachodzi w jednym etapie. W rzeczywistości, redukcja jest stopniowa i przebiega przez ciąg intermediatów, które w przypadku silnych środków redukujących w roztworze kwasu, mają co najwyżej przejściowe istnienie. Produktami pośrednimi powstającymi kolejno z ∗(∗RNO_2}} przy zwiększeniu o dwa równoważniki reduktora są związki nitrowe, ∗(∗R-N=O}}, i ∗(∗N})-podstawione azanole (hydroksyloaminy), ∗(∗RNHOH}}:
}{{Longrightarrow}}. \NRN=O} \overset{2 \left}{\Longrightarrow} \NHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}}
W ten sposób azanole o podstawieniu aarylowym można otrzymać bezpośrednio z odpowiednich nitrozwiązków za pomocą roztworu cynku i chlorku amonu. Natomiast cynk i kwas solny dają aminę:
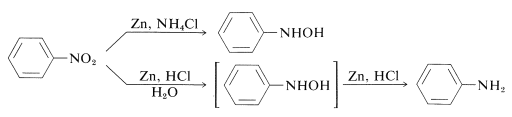
Różnica między tymi reakcjami polega na szybkości redukcji związanej z kwasowością roztworu. Chlorek amonu jest znacznie słabszym kwasem niż chlorek amonu; pH roztworów chlorku amonu wynosi ok. 6.
Otlenianie \(\N) -arylazanoli w kontrolowanych warunkach daje związki nitrozowe. Reakcja ta nie różni się od utleniania alkoholi do ketonów (sekcja 15-6B):
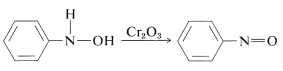
Redukcja arylowych nitrozwiązków za pomocą mniej silnych środków redukujących, szczególnie w środowisku alkalicznym, daje, co może wydawać się tajemniczym konglomeratem dwucząsteczkowych produktów redukcji. Na przykład, w przypadku nitrobenzenu,
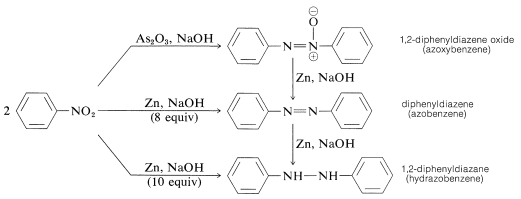
Wszystkie te substancje można zredukować do benzydaminy za pomocą cyny i kwasu solnego. W związku z tym każda z nich może być, choć nie musi, półproduktem w redukcji nitrozwiązków do amin. Tworzenie dwucząsteczkowych produktów redukcji jest wynikiem indukowanych zasadami reakcji między związkami nitrozowymi a azanolami lub aminami i ewentualnie dalszej redukcji pierwotnie wytworzonych substancji.
Kilka pochodnych polinitrobenzenu ma ważne zastosowania chwastobójcze. Przykładami są \(\N}^3\), \(\N}^3\)-diethyl-6-trifluoromethyl-2,4-dinitro-1,3-benzenamina i \(\N}},\(\N})-dipropyl-4-trifluoromethyl-2,6-dinitrobenzenamina:
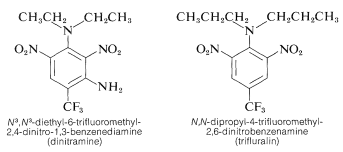
Substancje te po zmieszaniu z glebą zabijają siewki chwastów, ale nie rośliny uprawne, takie jak bawełna, soja i orzeszki ziemne. Aktywność jest wysoka; zwykle tylko około \(0,08 \: \text{g m}^{-2} \) jest wymagane do dobrego zwalczania chwastów.
Najważniejsze reakcje nitroalkanów to te, w których biorą udział \(\alfa\) hydrogeny związków pierwotnych i wtórnych. Na przykład, nitrometan jest wystarczająco kwaśny, aby rozpuścić się w wodnych roztworach wodorotlenków. Powstały w ten sposób anion ma strukturę elektronową analogiczną do anionu azotanowego:
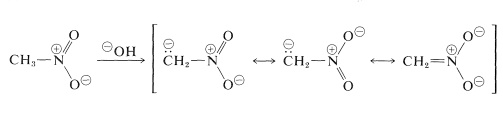
Ciekawa właściwość tego jonu polega na tym, że podczas zakwaszania jego roztworów powstaje niestabilny, dość silnie kwasowy izomer nitrometanu (zwany formą aci), który powoli powraca do bardziej stabilnej formy nitro:
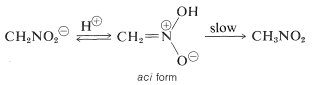
Podobne zmiany zachodzą podczas zakwaszania soli enolowej związku karbonylowego, przy czym podstawową różnicą jest znacznie dłuższy czas życia związku aci-nitro w porównaniu z czasem życia enolu prostego ketonu (patrz sekcja 17-1B).
Pierwotne i drugorzędowe nitrozwiązki ulegają addycji aldolowej i addycji Michaela z odpowiednimi związkami karbonylowymi i katalizatorami zasadowymi:
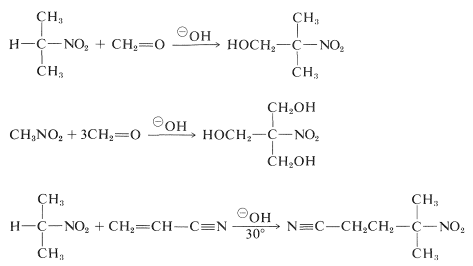
Niestety, reakcje alkilowania analogiczne do katalizowanego zasadami alkilowania związków karbonylowych na ogół nie są przydatne do syntezy wyższych nitrozwiązków, ponieważ alkilowanie zasad sprzężonych pierwszorzędowych nitrozwiązków przebiega wolniej niż alkilowanie.