De meeste medische behandelingen zijn ontworpen voor de “gemiddelde patiënt” als een “one-size-fits-all”-benadering, die voor sommige patiënten succesvol kan zijn, maar niet voor anderen. Precisiegeneeskunde, ook wel “gepersonaliseerde geneeskunde” genoemd, is een innovatieve benadering van het op maat maken van ziektepreventie en -behandeling, waarbij rekening wordt gehouden met verschillen in genen, omgeving en levensstijl van mensen. Het doel van precisiegeneeskunde is om de juiste behandelingen op het juiste moment op de juiste patiënten te richten.
Vorderingen in precisiegeneeskunde hebben al geleid tot krachtige nieuwe ontdekkingen en door de FDA goedgekeurde behandelingen die zijn afgestemd op specifieke kenmerken van individuen, zoals de genetische opmaak van een persoon, of het genetische profiel van de tumor van een individu. Patiënten met een verscheidenheid aan kankers ondergaan routinematig moleculaire tests als onderdeel van de patiëntenzorg, waardoor artsen behandelingen kunnen selecteren die de overlevingskansen verbeteren en de blootstelling aan nadelige effecten verminderen.
- Next Generation Sequencing (NGS) Tests
- De rol van de FDA bij het bevorderen van precisiegeneeskunde
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Clinical Databases Guidance
- Analytical Validation Guidance
- FDA’s Bioinformatica Platform
- Vragen?
- What FDA Officials Are Saying
- NGS Final Guidances
- Reports and Discussion Papers
- Past Meetings
Next Generation Sequencing (NGS) Tests
Precisiezorg zal alleen zo goed zijn als de tests die de diagnose en behandeling begeleiden. Next Generation Sequencing-tests (NGS) kunnen grote delen van het genoom van een persoon snel identificeren of “sequencen” en vormen een belangrijke vooruitgang in de klinische toepassingen van precisiegeneeskunde.
Patiënten, artsen en onderzoekers kunnen deze tests gebruiken om genetische varianten te vinden die hen helpen bij het diagnosticeren, behandelen en meer begrijpen van menselijke ziekten.
De rol van de FDA bij het bevorderen van precisiegeneeskunde
De FDA werkt aan het waarborgen van de nauwkeurigheid van NGS-tests, zodat patiënten en clinici nauwkeurige en klinisch zinvolle testresultaten kunnen ontvangen.
De enorme hoeveelheid informatie die door NGS wordt gegenereerd, stelt de FDA voor nieuwe regelgevingskwesties. Terwijl de huidige regelgevende benaderingen geschikt zijn voor conventionele diagnostica die een enkele ziekte of aandoening detecteren (zoals bloedglucose- of cholesterolwaarden), bevatten deze nieuwe sequencingtechnieken het equivalent van miljoenen tests in één. Daarom heeft de FDA samengewerkt met belanghebbenden in de industrie, laboratoria, de academische wereld en patiënten- en beroepsverenigingen om een flexibele regelgevingsaanpak te ontwikkelen die geschikt is voor deze zich snel ontwikkelende technologie en die gebruikmaakt van consensusnormen, door de massa verzamelde gegevens en geavanceerde open-source computertechnologie om de ontwikkeling van NGS-tests te ondersteunen. Deze aanpak zal innovatie in testen en onderzoek mogelijk maken, en zal de toegang tot nauwkeurige, betrouwbare genetische tests versnellen.
Streamlining FDA’s Regulatory Oversight of NGS Tests
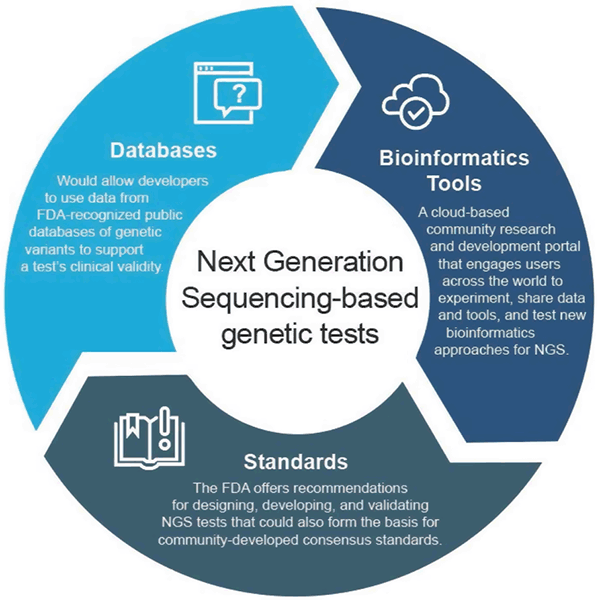
In april 2018 heeft de FDA twee definitieve richtlijnen uitgegeven waarin benaderingen worden aanbevolen om de indiening en beoordeling van gegevens ter ondersteuning van de klinische en analytische validiteit van op NGS gebaseerde tests te stroomlijnen. Deze aanbevelingen zijn bedoeld om een efficiënte en flexibele aanpak van regelgevend toezicht te bieden: naarmate de technologie vordert, kunnen normen snel evolueren en worden gebruikt om passende metrieken vast te stellen voor snelgroeiende gebieden zoals NGS. Evenzo kunnen nieuwe beweringen worden ondersteund naarmate het klinisch bewijs verbetert. Deze adaptieve benadering zou uiteindelijk innovatie onder testontwikkelaars bevorderen en de toegang van patiënten tot deze nieuwe technologieën verbeteren.
Clinical Databases Guidance
De definitieve leidraad “Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” staat ontwikkelaars toe om gegevens van door de FDA erkende openbare databases van genetische varianten te gebruiken om de klinische validiteit van een test te helpen ondersteunen en geeft aan hoe databasebeheerders erkenning voor hun databases kunnen aanvragen als ze aan bepaalde kwaliteitsaanbevelingen voldoen. Deze aanpak stimuleert het delen van gegevens en biedt een efficiëntere weg naar de markt.
Meer informatie over de erkenning van databases is beschikbaar op de webpagina Recognition of Public Human Genetic Variants Databases van de FDA.
Analytical Validation Guidance
De definitieve leidraad “Considerations for Design, Ontwikkeling, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVD’s) Intended to Aid in the Diagnosis of Suspected Germline Diseases” biedt aanbevelingen voor het ontwerpen, ontwikkelen en valideren van NGS-tests. De richtsnoeren moedigen ook de betrokkenheid van de gemeenschap aan bij de ontwikkeling van NGS-gerelateerde normen door organisaties voor de ontwikkeling van normen (SDO’s), aangezien normen sneller kunnen evolueren met veranderingen in technologie en kennis en daarom kunnen worden gebruikt om passende maatstaven vast te stellen, zoals specifieke prestatiedrempels voor snel groeiende gebieden zoals NGS.
FDA’s Bioinformatica Platform
De FDA creëerde precisionFDA, een cloud-gebaseerd community onderzoeks- en ontwikkelingsportaal dat gebruikers over de hele wereld betrekt om gegevens en hulpmiddelen te delen om bestaande en nieuwe bioinformatica benaderingen voor NGS-verwerking te testen, te piloteren en te valideren. Individuen en organisaties in de genomicagemeenschap kunnen meer informatie vinden en zich aanmelden voor deelname op http://precision.fda.gov.
Vragen?
Neem contact met ons op als u vragen heeft over de inspanningen van de FDA op het gebied van precisiegeneeskunde op [email protected].
What FDA Officials Are Saying
- FDA finaliseert richtlijnen voor het versnellen van de ontwikkeling van betrouwbare, voordelige tests op basis van next generation sequencing
NGS Final Guidances
- Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 444KB)
- Considerations for Design, Development, en analytische validatie van Next Generation Sequencing (NGS) -gebaseerde in-vitro diagnostica (IVD’s) bedoeld om te helpen bij de diagnose van verdachte kiembaanziekten – Richtsnoer voor belanghebbenden en personeel van de Food and Drug Administration (PDF – 869KB)
Reports and Discussion Papers
- Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests (PDF – 424KB)
- Report: Paving the Way for Personalized Medicine (Archived)
Past Meetings
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Implications for Patients and Providers
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Technical and Regulatory Aspects
- 11/13/2015: Openbare workshop – Gebruik van databanken voor het vaststellen van de klinische relevantie van menselijke genetische varianten
- 11/12/2015: Standards Based Approach to Analytical Performance Evaluation of Next Generation Sequencing In Vitro Diagnostic Tests
- 02/20/2015: Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests Public Workshop