Onder de menselijke Neisseria en verwante soorten, reduceren drie soorten – N. mucosa, M. catarrhalis, en K. denitrificans nitraat. De nitraatreductietest is een kritische test voor het onderscheid tussen N. gonorrhoeae en K. denitrificans, vooral wanneer stammen van K. denitrificans gramnegatieve diplokokken blijken te zijn in gekleurde uitstrijkjes.
Principe
Bacteriële soorten kunnen worden onderscheiden op basis van hun vermogen om nitraat te reduceren tot nitriet of stikstofhoudende gassen. Onder de Neisseriaceae van menselijke oorsprong, reduceren stammen van Neisseria mucosa, Moraxella catarrhalis, en Kingella denitrificans nitraat. Stammen van M. catarrhalis en K. denitrificans zijn foutief geïdentificeerd als N. gonorrhoeae. Met de nitraatreductietest kan onderscheid worden gemaakt tussen deze nitraatpositieve soorten en N. gonorrhoeae (nitraatnegatief). De reductie van nitraat kan bij sommige soorten gepaard gaan met anaërobe ademhaling.
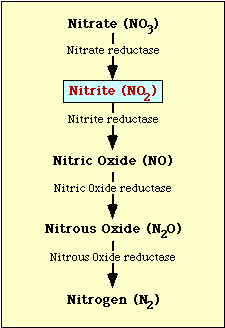
De biochemische route die bij de nitraatreductie betrokken is, is weergegeven in figuur 1. Nitraat wordt gereduceerd tot nitriet, dat vervolgens kan worden gereduceerd tot stikstofmonoxide, stikstofmonoxide of stikstof (figuur 1).
Figuur 1. Nitraatreductietraject.
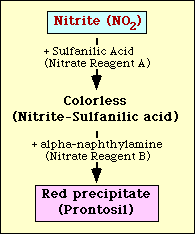
De nitraatreductietest is gebaseerd op de detectie van nitriet in het medium na incubatie met een organisme. Indien nitriet in het medium aanwezig is, reageert het met sulfanilzuur (nitraatreagens A) tot een kleurloos complex (nitriet-sulfanilzuur). Dit complex geeft vervolgens een rood neerslag (prontosil) wanneer nitraatreagens B (alfa-naftylamine) aan de test wordt toegevoegd, zoals afgebeeld in figuur 2.
Figuur 2. Schematische weergave van de detectie van nitriet in het medium.
Een rode kleur in het medium ontstaat alleen wanneer nitriet in het medium aanwezig is. Het ontbreken van een rode kleur in het medium na de toevoeging van sulfanilzuur en alfa-naftylamine betekent alleen dat er geen nitriet in het medium aanwezig is. Er kunnen twee verklaringen voor deze waarneming zijn.
- Het nitraat is wellicht niet gereduceerd; de stam is nitraatnegatief.
- Het nitraat is wellicht gereduceerd tot nitriet dat vervolgens volledig is gereduceerd tot stikstofmonoxide, distikstofmonoxide of stikstof die niet reageert met de reagentia die met nitriet reageren; de stam is nitraat-positief.
Elk testmedium dat een negatief resultaat geeft na toevoeging van de nitraatreagentia moet verder worden getest om te bepalen welke van de twee interpretaties juist is.
Een succesvolle nitraatreductietest is afhankelijk van het uitvoeren van de test onder de juiste omstandigheden.
- De reactie zal het best optreden als het basismedium de groei van het organisme ondersteunt. Hoewel sommige Neisseria-soorten niet goed groeien in een bouillonmedium, kan de nitraatreductietest met succes worden uitgevoerd in een medium dat de groei niet ondersteunt, door het medium zwaar te enten zodat er voldoende voorgevormd enzym is om de reactie te laten plaatsvinden.
- De nitraatreactie treedt alleen op onder anaërobe omstandigheden. Het nitraathoudende medium wordt in buisjes gedoseerd om een lage verhouding oppervlakte/diepte te verkrijgen, waardoor de diffusie van zuurstof in het medium wordt beperkt, b.v. 5 ml medium wordt gedoseerd in een buisje met een diameter van 13 mm. Neisseria en verwante soorten gebruiken de zuurstof in het medium en creëren snel anaërobe omstandigheden die ideaal zijn voor de reductie van nitraat.
De nitraatreductietest wordt uitgevoerd in een medium dat 0,2% kaliumnitraat bevat. Het medium wordt zwaar geënt met een reincultuur van het verdachte organisme en gedurende 48 uur bij 35C tot 36,5C geïncubeerd in een incubator met of zonder extra kooldioxide.
Nitraatreductie wordt gedetecteerd met de Griess Llosvay-reagentia, sulfanilzuur en alfa-naftylamine. Sulfanilzuur (nitraatreagens A) wordt aan het incubatiemengsel toegevoegd en vormt een complex (nitriet-sulfanilzuur) met eventueel in het medium aanwezig nitriet. Wanneer alfa-naftylamine (nitraatreagens B) aan het geïncubeerde medium wordt toegevoegd, zal een rood neerslag (prontosil) worden gevormd met een eventueel in het medium aanwezig nitriet-sulfanilzuur-complex.
Een organisme kan als nitraatpositief worden gerapporteerd als zich in het medium een rode kleur ontwikkelt nadat nitraatreagentia A en B aan het medium zijn toegevoegd, wat erop wijst dat het organisme nitraat tot nitriet heeft gereduceerd.
De afwezigheid van een rode kleur na de toevoeging van beide reagentia betekent niet automatisch dat het organisme niet in staat is nitraat te reduceren. Stammen kunnen het nitraat tot nitriet hebben gereduceerd, en vervolgens het nitriet volledig hebben gereduceerd tot stikstofhoudende gassen die niet worden gedetecteerd wanneer nitraatreagentia A en B aan het medium worden toegevoegd. Indien het medium niet van kleur verandert na toevoeging van sulfanilzuur en alpha-naftylamine, wordt een kleine hoeveelheid (“mespunt”) zinkstof aan het geïncubeerde medium toegevoegd. Het zinkstof katalyseert de reductie van nitraat tot nitriet op chemische wijze. Als het nitraat dus niet door de organismen is gereduceerd, d.w.z. dat zij nitraatnegatief zijn, zal het door het zinkstof worden gereduceerd en zal zich binnen 15 minuten een rode kleur ontwikkelen in het geïncubeerde medium. Als zich na toevoeging van zinkstof geen kleur ontwikkelt in het geïncubeerde medium, hebben de organismen niet alleen nitraat gereduceerd tot nitriet, maar ook nitriet gereduceerd tot stikstofhoudende gassen; deze organismen zijn ook nitraat-positief.
Hoewel nitraatmedium wordt geleverd met omgekeerde Durham-buisjes om gasproductie te detecteren, wordt gasproductie niet geregistreerd voor Neisseria-soorten. Hoewel sommige soorten nitraat voorbij nitriet kunnen reduceren tot stikstofhoudende gassen, is het mogelijk dat het gas zich niet in het buisje ophoopt. De ophoping van gas is afhankelijk van de snelheid waarmee het wordt geproduceerd. Wanneer het gas zeer langzaam wordt geproduceerd, kan het oplossen in het medium en zich niet ophopen in de Durham-buis.
Vereisten voor het specimen
Optimaal specimen: Een reincultuur van een verdachte gramnegatieve, oxidase-positieve diplokok (Neisseria spp. of M. catarrhalis) op chocolade-agar geïncubeerd in een met kooldioxide verrijkte atmosfeer bij 35C tot 36,5C gedurende 18 tot 24 uur.
Onaanvaardbaar specimen: Culturen van isolaten op chocolade-agar geïncubeerd in een met kooldioxide verrijkte atmosfeer bij 35C tot 36,5C gedurende meer dan 24 uur.
Belemmerende factoren die de testresultaten beïnvloeden:
- Testmedium moet zwaar genoeg worden geïnoculeerd om reactie met voorgevormde enzymen mogelijk te maken. Bij onvoldoende inoculum is het mogelijk dat de organismen geen zuurstof kunnen verbruiken om anaërobe omstandigheden te creëren waarin nitraatreductie kan plaatsvinden.
- Te veel zinkstof toegevoegd aan de geïncubeerde buis kan resulteren in een zeer snelle reductie van nitraat voorbij nitriet tot stikstofhoudende gassen, zodat nitriet niet wordt gedetecteerd.
Stabiliteit van het specimen: Detectie van nitraatreductie voor Neisseria en verwante soorten is afhankelijk van de aanwezigheid van voorgevormde enzymen.
- Tests mogen alleen worden uitgevoerd met inoculum geoogst uit 24-uurs culturen.
- Nitraatmedium moet worden geënt binnen 30 min. nadat de cultuur uit de incubator is verwijderd; langdurige blootstelling van de cultuur aan kamertemperatuur kan leiden tot verminderde enzymactiviteit.
Medium/reagentia
Medium: Nitraatbouillon (Hartinfusiebouillon met 0,2% kaliumnitraat)
Hartinfusiebouillon (Difco), 25,0 g
Kaliumnitraat, 2,0 g
Gedestilleerd water, 1000,0 ml
- Oplos de ingrediënten in gedestilleerd water; breng de oplossing op pH 7.0.
- Doseer 5 ml aliquots van de bouillon in buizen van 16 mm x 100 mm met gasinzetstukken (Durham-buizen, 6 mm x 50 mm).
- Autoclaveer gedurende 15 min bij 121C.
Bewaar het medium bij 4C tot 10C (gekoeld) tot gebruik. Verwarm het medium voor op kamertemperatuur vóór inoculatie.
Hulpmiddelen: Sulfanilzuuroplossing (Nitraatreagens A): 0,8% in 5N azijnzuur
Chemische naam: 4-aminobenzeensulfonzuur
Bewaren Nitraatreagens A bij 15C tot 30C (kamertemperatuur) gedurende maximaal 3 maanden, in het donker. Reagentia kunnen worden opgeslagen in donkerbruine glazen recipiënten; flessen kunnen worden gewikkeld in aluminiumfolie om de duisternis te garanderen.
Alpha-Naphthylamine oplossing (Nitraat reagens B): 0,6% in 5N azijnzuur
Chemische naam: N,N-dimethyl-1-naftylamine
Bewaren Nitraatreagens B bij 2C tot 8C (gekoeld) maximaal 3 maanden, in het donker. Reagentia kunnen worden opgeslagen in donkerbruine glazen recipiënten; flessen kunnen in aluminiumfolie worden gewikkeld om de duisternis te waarborgen.
Zinkpoeder, reagenskwaliteit: Bewaren bij kamertemperatuur (15C tot 30C)
Waarschuwing: Azijnzuur is bijtend. Contact met de huid kan blaren en brandwonden veroorzaken. In geval van contact, ogen en huid onmiddellijk spoelen met veel water (gedurende tenminste 15 min.)
Kwaliteitscontrole/Testprocedure
QC-stammen:
- Nitraatreductase-positieve controle: Kingella denitrificans, CDC 10.236
- Nitraatreductase-negatieve controle: Neisseria gonorrhoeae, ATCC 43069
QC-stammen worden bewaard bij -70C in een oplossing van tryptische sojabouillon met 20% glycerol. De reacties van de controlestammen moeten worden bevestigd op het moment dat de ingevroren voorraden worden bereid. QC-stammen kunnen tot 2 jaar bij -70C worden bewaard.
Procedure:
QC-stammen worden op dezelfde manier getest als klinische isolaten. QC-stammen moeten na de eerste kweek van het ingevroren monster ten minste één keer worden gekweekt voordat de test wordt uitgevoerd. Klinische isolaten kunnen worden gekweekt uit selectief medium of gezuiverde subculturen. Zorg ervoor dat de kweken zuiver zijn.
- Dooi flesjes met controlestammen die bij -70C zijn bewaard.
- Streel op platen chocolade-agar of aangevulde GC-agar voor isolatie. Incubeer bij 35C tot 36,5C in een met kooldioxide verrijkte atmosfeer gedurende 18 tot 24 uur.
-
Maak met een steriel wattenstokje een zware suspensie van goed geïsoleerde kolonies van een reincultuur van het isolaat, geïncubeerd op chocolade-medium bij 35C tot 36.5 C in een met kooldioxide verrijkte atmosfeer gedurende 18 tot 24 uur. Inoculeer testmedium om zware troebelheid te geven.
Note: Stammen van N. gonorrhoeae en sommige andere Neisseria spp. groeien mogelijk niet in dit medium. De reactie kan dus afhankelijk zijn van vooraf gevormd enzym.
- Incubeer geïnoculeerde media en een niet-geïnoculeerd controlemediumbuisje bij 35C tot 36,5 C in een met kooldioxide verrijkte atmosfeer gedurende 48 uur.
-
Na 48 uur incubatie voegt u met pasteurpipetten aan elk buisje 5 druppels reagens #A toe, gevolgd door 5 druppels reagens #B. Schud de buisjes goed om de reagentia met het medium te mengen.
Controleer de suspensie op een rozerode kleur die zich binnen enkele minuten zou moeten ontwikkelen als het medium nog warm is. De reactie kan iets langer duren als het medium koud is wanneer de reagentia worden toegevoegd.
Als de suspensie rozerood kleurt vóór de toevoeging van Zn-poeder, is de recitatie positief en is de test voltooid. Voer stap 4 niet uit.
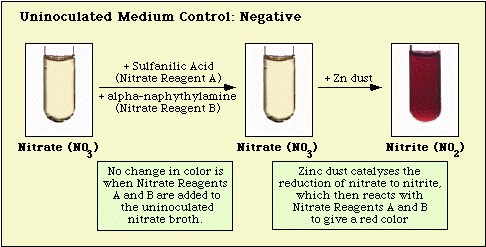
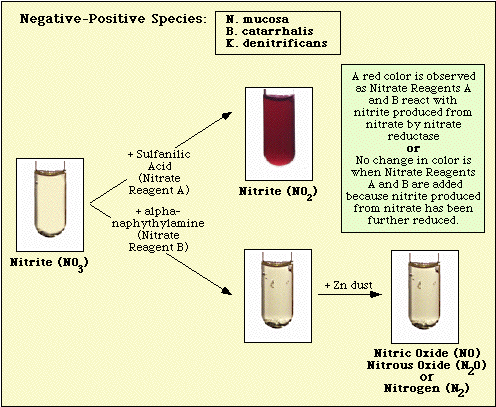
Reacties die zijn waargenomen met het niet-geïnoculeerde medium controle, en nitraat-negatieve, en nitraat-positieve isolaten worden geïllustreerd in respectievelijk figuur 3, figuur 4, en figuur 5.
-
Als de suspensie kleurloos is na de toevoeging van reagentia A en B, voeg dan een kleine hoeveelheid (4 tot 5 mg; “scherpe mespunt”) zinkstof toe aan het medium. Schud het buisje krachtig en laat het 10-15 minuten bij kamertemperatuur staan.
Als het medium kleurloos blijft na toevoeging van Zn-poeder, is het testresultaat positief.
Als het medium roze wordt na toevoeging van Zn-poeder, is het resultaat negatief. - Lees de resultaten af en noteer ze.
Figuur 3. Reactie waargenomen met niet-geïnoculeerd nitraatmedium.
Figuur 4. Reactie waargenomen met nitraat-negatieve soorten.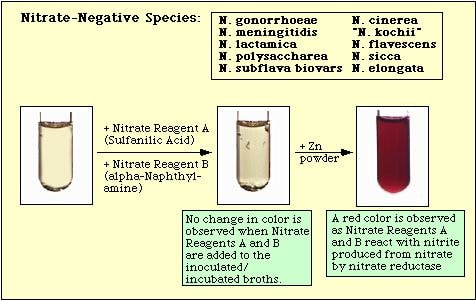
Figuur 5.
Figuur 5. Reacties bij nitraatpositieve soorten.
schema voor kwaliteitscontrole:
- Elke dag dat klinische isolaten worden getest, wordt een nitraatreductase-QC-test uitgevoerd.
problemen &oplossingen
De nitraatreductietest kan vals-negatieve of vals-positieve resultaten geven als het medium niet nauwkeurig wordt aangemaakt of als de test niet nauwkeurig wordt uitgevoerd. De reactie in deze test is afhankelijk van een aantal factoren.
- Het niet aantonen van een roze kleur in het niet-geïnoculeerde medium controlebuisje na toevoeging van Zn-stof kan te wijten zijn (1) aan het feit dat het medium geen nitraat bevat of (2) aan de toevoeging van te veel zinkstof dat de reductie van nitraat voorbij nitriet tot stikstofhoudende gassen heeft gekatalyseerd. De eenvoudigste oplossing is meer nitraatmedium te verkrijgen, zodat aan het basismedium nitraat is toegevoegd. Een andere mogelijkheid is het medium te enten met een positieve controlestam, maar pas na een kortere incubatietijd op een reactie te testen; stammen van N. mucosa zullen na enkele uren incubatie een positieve nitrietreactie geven. Als wordt bevestigd dat het medium nitraat bevat, herhaalt u de test totdat u de juiste hoeveelheid zinkstof hebt bepaald die moet worden toegevoegd. Het is van cruciaal belang te weten hoeveel zinkstof aan de test moet worden toegevoegd. Toevoeging van te veel zinkstof kan resulteren in een vals-positief resultaat.
- Als een roze kleur wordt waargenomen in het niet-geïnoculeerde medium controle nadat nitraatreagentia A en B zijn toegevoegd aan het medium, het medium is verontreinigd met nitriet. De enige oplossing is een nieuwe partij medium te verkrijgen die niet met nitriet is verontreinigd.
- In nitraatbevattend medium zou het uitblijven van een positieve reactie van de positieve controlestam, Kingella denitrificans, zich alleen voordoen als de stam niet K. denitrificans is. Controleer de identiteit van de positieve controlestam opnieuw. Selecteer een nieuwe kweek van de controlestam en herhaal de test. Ook als een positieve nitraatreductasetest wordt verkregen met de negatieve controlestam, N. gonorrhoeae, is ofwel de negatieve controlestam niet N. gonorrhoeae, ofwel de kweek is besmet met een nitraatpositief organisme. Controleer de zuiverheid en identiteit van de gonokokkenreferentiestam opnieuw. Herhaal de test met een reincultuur van een bevestigde cultuur van N. gonorrhoeae.
- De nitraatreductiereactie geeft het vermogen van organismen aan om nitraat te reduceren, een reactie die alleen optreedt onder anaerobe omstandigheden; de reactie treedt niet op als de organismen een voortdurende toevoer van zuurstof krijgen. Het is dus mogelijk dat de reactie niet optreedt in stilstaande culturen (vooral van traaggroeiende soorten) waarin het medium is verdeeld in ondiepe lagen waardoor zuurstof in het medium kan diffunderen. Een test om te bepalen of zuurstof in het medium aanwezig is, kan worden uitgevoerd door een druppel oxidase-reagens aan het medium toe te voegen. Als het medium paars wordt, bevat het medium zuurstof en mag de nitraatreductie niet optreden. Als het medium kleurloos blijft, bevat het medium geen zuurstof en kan de nitraatreductietest plaatsvinden. Er is opgemerkt dat N. gonorrhoeae-cellen de zuurstof snel verbruiken als voldoende cellen in het medium worden geïnoculeerd. Als na ongeveer 1 à 2 uur incubatie oxidase-reagens wordt toegevoegd, blijft het medium helder. Omdat het oxidase-reagens de in het medium aanwezige gonococcen doodt, zal het medium geleidelijk paars kleuren, te beginnen bij de top van het buisje, naarmate de zuurstof in het medium diffundeert. Indien het medium wordt gedoseerd in buisjes van andere afmetingen dan hierboven voorgesteld, moet ervoor worden gezorgd dat de verhouding oppervlakte/diepte ten minste gelijk is aan of kleiner is dan die welke hierboven is voorgesteld. Indien de diameter van het buisje waarin het medium wordt gedoseerd groter is dan hierboven beschreven, gebruik dan een grotere hoeveelheid medium om dezelfde oppervlakte/diepte-verhouding te handhaven.
-
De nitraatreductiereactie mag niet optreden indien het medium waarin de test wordt uitgevoerd geen normale groei van het organisme toelaat. De test kan echter worden uitgevoerd in een medium dat de groei van de organismen niet ondersteunt, als het inoculum voldoende dicht is dat de vooraf gevormde enzymen de bestaande zuurstoftoevoer kunnen uitputten en het nitraat sneller kunnen reduceren dan de zuurstof in het medium diffundeert.
Noot: Om te controleren of de zuurstof uit het medium is verwijderd, voegt u 2 tot 3 druppels oxidase-reagens toe aan een duplicaat van het geïnoculeerde medium. Als de zuurstof voldoende uit het medium is verwijderd, zal het oxidase-reagens niet onmiddellijk paars kleuren. Als het medium opgeloste zuurstof bevat, zal het oxidase-reagens paars kleuren. Merk ook op dat de nitraatreductietest kan worden uitgevoerd in medium waaraan het oxidase-reagens is toegevoegd.
- Wanneer reagens A aan het testmedium wordt toegevoegd, vormt het als gevolg van de reductie van nitraat geproduceerde nitriet een complex met het sulfanilzuur dat een rood neerslag vormt met het alfa-naftylamine in reagens B. De aanwezigheid van een rode kleur in het testmedium wijst erop dat nitriet aanwezig is als gevolg van de reductie van nitraat. De afwezigheid van een rode kleur na toevoeging van de reagentia A en B betekent echter niet noodzakelijk dat het nitraat niet gereduceerd werd. Het uitblijven van een rode kleur kan betekenen (1) dat het nitraat niet gereduceerd werd, of (2) dat het nitriet, geproduceerd als gevolg van de reductie van nitraat, zelf gereduceerd is tot stikstofhoudende gassen. Om te bepalen of het nitriet gereduceerd is, wordt een kleine hoeveelheid zinkstof in het incubatiemengsel gebracht als dit kleurloos is na toevoeging van de reagentia A en B. Het zinkstof katalyseert de reductie van nitraat tot nitriet; in het medium dat nog ongereduceerd nitraat bevat, moet zich een rode kleur ontwikkelen. Het is echter belangrijk niet te veel zinkstof toe te voegen; een teveel aan zinkstof katalyseert de reductie van nitriet uit dat nitraat, wat resulteert in een kleurloos medium en de onjuiste interpretatie van de test als positief (een vals-positief resultaat).
- Een positieve nitraatreductasetest met de negatieve controlestam, N. gonorrhoeae, na toevoeging van het zinkstof wijst erop dat het nitraat is gereduceerd tot nitriet, waarschijnlijk als gevolg van de toevoeging van te veel zinkstof aan de test. Herhaal de test en zorg ervoor dat er zeer weinig zinkstof wordt toegevoegd. De roze kleur, die aangeeft dat het organisme het nitraat niet heeft gereduceerd, kan zich pas na 10 tot 15 minuten ontwikkelen. Voeg niet meer zinkstof toe! Wacht tot de kleur zich ontwikkelt. Als zich na 30 minuten geen kleur heeft ontwikkeld, interpreteer de test dan als positief.
Beperkingen van de test
Als de test goed wordt uitgevoerd en de kwaliteitscontroles de juiste resultaten opleveren, zouden er geen beperkingen aan deze test mogen zijn. Er moet voor worden gezorgd dat alle onderdelen van de test naar behoren worden uitgevoerd.
Op basis van de nitraatreductietest alleen kan geen geslacht of soort worden vastgesteld.
Resultaten, interpretatie en rapportage
Isolaten kunnen als nitraatpositief worden gerapporteerd als in het geïnoculeerde medium nitriet (roze kleur) wordt aangetoond na toevoeging van de reagentia A en B, of als in het medium geen kleur wordt aangetoond na toevoeging van zinkstof.
Isolaten kunnen als nitraatnegatief worden gerapporteerd als geen nitriet wordt gedetecteerd (geen kleurverandering) na toevoeging van de reagentia A en B, of als een roze kleur ontstaat na toevoeging van zinkstof aan het geïnoculeerde medium.
Bibliografie
Knapp JS, Clark VL. Anaërobe groei van Neisseria gonorrhoeae gekoppeld aan nitrietreductie. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. A guide to the identification of the genera of bacteria. The Williams & Wilkins Co., Baltimore, MD.